重组人促红细胞生成素预处理减轻大鼠肝脏缺血/再灌注损伤
慕喜喜,李静,韩璐,钟岳,何大立,窦科峰,陶开山(. 空军军医大学西京医院肝胆外科,陕西 西安 700;.西安市中心医院神经外科,陕西 西安 7000;. 西安市中心医院超声科,陕西 西安 7000)
缺血/再灌注损伤(ischemia-reperfusion injury,IRI)是临床常见的肝损伤因素之一,通常发生在肝切除、肝移植、外伤和低血容量休克的过程中,病理特点主要是由库普弗(Kupffer)细胞、淋巴细胞及中性粒细胞的活化引起组织细胞受损,同时钙超载、氧自由基及细胞因子的释放和活化引起炎症反应、细胞坏死及凋亡。肝脏IRI的病理生理过程十分复杂,其分子机制目前仍未完全阐明[1]。因此,积极采取有效措施减轻肝脏IRI造成的不利影响对于促进肝切除后肝功能恢复,降低肝移植术后排斥反应等具有重要意义。红细胞生成素(erythropoietin,EPO)是主要由肾脏产生的一种糖蛋白细胞因子,在过去的几十年里,EPO由于其促进红细胞生成的能力而被广泛应用于临床[2]。近年来,许多研究表明,EPO具有炎性转录因子调控活性,在肾脏和心脏的缺血/再灌注过程中能起到一定的保护作用[3-4]。然而,EPO 对肝脏 IRI的意义目前未知。因此,本研究将观察重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)预处理对肝脏IRI的影响,并探索其可能的机制,为临床肝脏IRI的预防提供思路。
1 材料与方法
1.1 实验动物:健康雄性Sprague-Dawley(SD)大鼠30只购于北京华阜康生物科技股份有限公司,约6~8周龄,体重200~250 g,饲养于清洁环境中。
1.2 主要试剂:rhEPO(德国NeoRecormon,Roche公司);大鼠肿瘤坏死因子(tumor necrosis factor,TNF-α)、白细胞介素(interleukin)IL-6和IL-1β的酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(上海碧云天生物技术有限公司);蛋白免疫印迹试验(Western Blot) 检 测 搞 体 :anti-p-p85(1:1000,英 国Abcam公司),anti-p85(1:500,英国Abcam公司),anti- p-AKT(1:500,美国 CST公司),AKT(1:1000,美国CST公司),β-actin(1:300,英国Abmart公司),HRP标记的二搞(上海碧云天生物技术有限公司);PrimeScript RT Master Mix试剂盒(日本Takara公司);BCA蛋白检测试剂盒(上碧云天生物技术有限公司)。
1.3 实验分组及模型建立:经过约1周时间的环境适应后,随机均分为3组,分别设立实验组、对照组和假手术组。在肝脏IRI模型建立前1小时,实验组使用5 000 U/kg的rhEPO进行尾静脉注射,而对照组和假手术组,则分别注射生理盐水。rhEPO的给药剂量参考前期相关研究[5]。大鼠70%肝脏IRI模型:术前禁食,在环境温度25℃下,使用1%戊巴比妥钠麻醉大鼠,然后采取平卧位,纵行切口打开腹腔,应用显微血管夹夹闭肝左、肝中叶脉管的共干,使得肝左叶及肝中叶缺血,以实现70%的肝脏组织缺血,阻断血流1小时后恢复肝脏血供3小时,然后处死大鼠,留取血样和肝脏标本。所有的动物实验均通过了医院伦理委员会批准(20171102)。
1.4 肝组织病理学检查:取大鼠肝脏缺血/再灌注后的肝脏标本,置于中性甲醛中固定,固定时间为24小时,取适量肝组织标本经浓度梯度酒精脱水后石蜡包埋,将石蜡包埋后的组织制作成石錯切片。将切片先经脱蜡水化,然后分别采用苏木素/伊红(hematoxylin eosin,HE)染色,最后脱水透明处理,进行中性树脂封片,显微镜下观察结果并评价损伤情况[6]。
1.5 血清学检测:用促凝管收集实验鼠的血液,分离血清,送至本院检验科,使用全自动生化仪检测天冬氨酸转氨酶(aspartate aminotransferase,AST)和丙氨酸转氨酶(alanine aminotransferase,ALT)的释放情况。并用ELISA试剂盒,按照使用说明书,检测血清炎性细胞因子TNF-α、IL-6、IL-1β蛋白的表达量。
1.6 实时定量PCR检测:按说明用Trizol提取肝组织总RNA,取4 mg总RNA,使用Prime Script RT Master Mix反转录成cDNA,用ABI 7500 system进行实时扩增。扩增条件:95℃30秒,95℃5秒40个循环,60℃34秒,最后95℃15秒。内参选择 β-actin,使用2-ΔΔCt的方法计算相对表达量。
1.7 Western Blot检测:用1×蛋白上样缓冲液,在冰上裂解细胞(加入蛋白酶抑制剂),提取蛋白99℃变性10分钟。然后用BCA蛋白检测试剂盒,检测提取蛋白浓度。制作10%的SDS-PAGE分离胶,蛋白上样后电泳,110 V,120分钟。转膜,220 mA,40分钟。5%牛奶封闭后,加入一搞4℃孵育过夜。用辣根过氧化物酶标记的二搞,室温孵育1小时。最后用ChemiDocTMXRS+和Image LabTMsoftware显影,并计算条带灰度值。
1.8 统计学方法:数据以均数±标准差(x±s)表示。采用SPSS 22.0软件进行数据分析,采用单因素方差分析和t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 rhEPO预处理可减轻大鼠肝脏缺血/再灌注损伤(图1):检测大鼠血清中的AST和ALT变化反映肝功能情况,结果显示,IRI处理后血清中两种转氨酶的释放量均有明显增加。但是,rhEPO组AST和ALT的释放量均较对照组低〔AST(U/L):582.0±52.5 比 245.0±31.7; ALT(U/L):388.0±39.6比166.0±24.3,P < 0.05)〕,提示肝损伤较轻。组织病理结果显示,肝脏70%缺血/再灌注后造成明显的肝组织损伤,肝组织形态出现异常,如肝细胞坏死、肝细胞的细胞质液泡化以及中性粒细胞浸润等,肝损伤评分较高,而采用rhEPO预处理的肝组织损伤明显较轻。

图1 rhEPO预处理对肝脏缺血/再灌注损伤的影响
2.2 rhEPO预处理进一步活化了PI3K/AKT信号通路(图2):提取肝组织总蛋白,Western Blot检测PI3K/AKT信号通路相关蛋白p85和AKT的表达和活化情况。结果显示,肝脏经历IRI后,p85和AKT的蛋白总量未见明显变化,但是,p-p85和p-AKT的表达量均有明显增加;同时,给予rhEPO预处理后,p-p85和p-AKT的表达量增加尤为明显,显著高于对照组,提示IRI激活了PI3K/AKT信号通路,而rhEPO预处理则进一步活化了PI3K/AKT激活信号。
2.3 rhEPO预处理降低了IRI时肝组织中的炎性因子转录水平(图3):提取肝组织总RNA,实时定量PCR检测IRI肝组织中的炎性细胞因子TNF-α、IL-6和IL-1β的mRNA表达量。结果显示,和假手术组比较,IRI引起肝脏TNF-α、IL-6和IL-1β的mRNA相对表达量显著升高,但是,给予rhEPO预处理组TNF-α、IL-6和IL-1β的mRNA相对表达量均明显低于对照组。
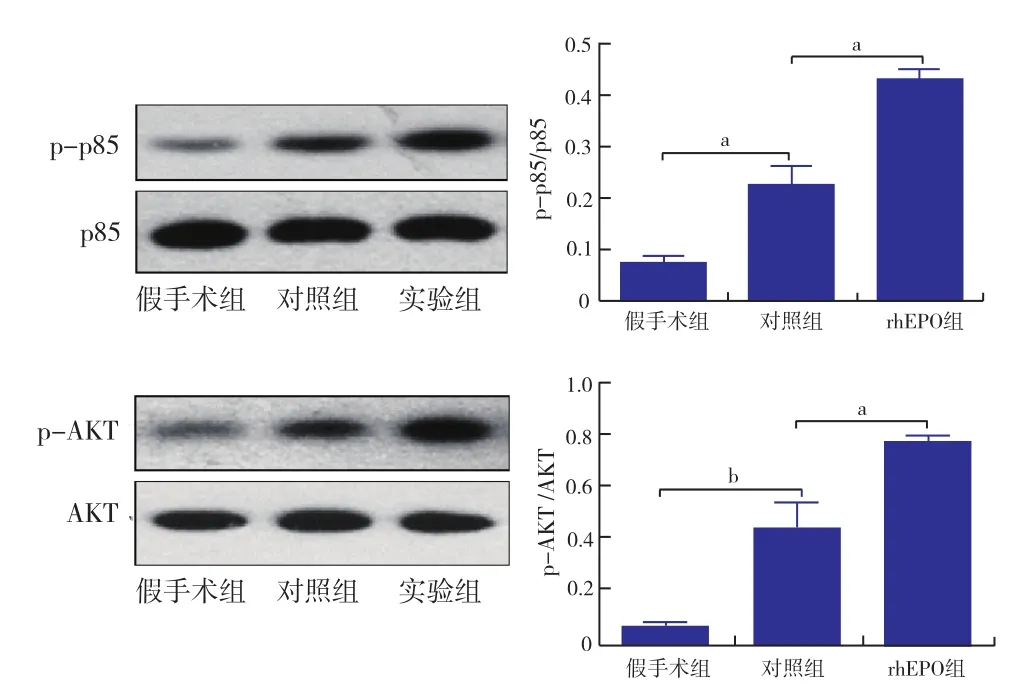
图2 rhEPO预处理活化了PI3K/AKT信号通路
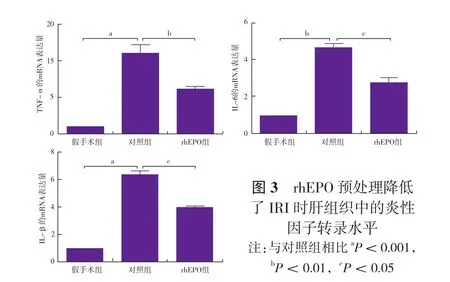
图3 rhEPO预处理降低了IRI时肝组织中的炎性因子转录水平
2.4 rhEPO预处理抑制了IRI时血清中的炎性因子释放(图4):为了进一步检测rhEPO预处理对IRI过程中血清炎性因子的释放情况,使用ELISA法对不同处理组血清中的TNF-α、IL-6和IL-1β的含量进行测定。结果显示,与假手术组相比较,对照组引起血清中TNF-α、IL-6和IL-1β的表达量显著升高,但是,给予rhEPO预处理后TNF-α、IL-6和IL-1β的表达量均明显低于对照组〔TNF-α(pg/ml):425.0±31.2比 227.0±19.7;IL-6(pg/ml):353±26.4 比 189±16.3;IL-1β(pg/ml):511.0±39.6 比 328.0±23.2,均 P < 0.05)〕。
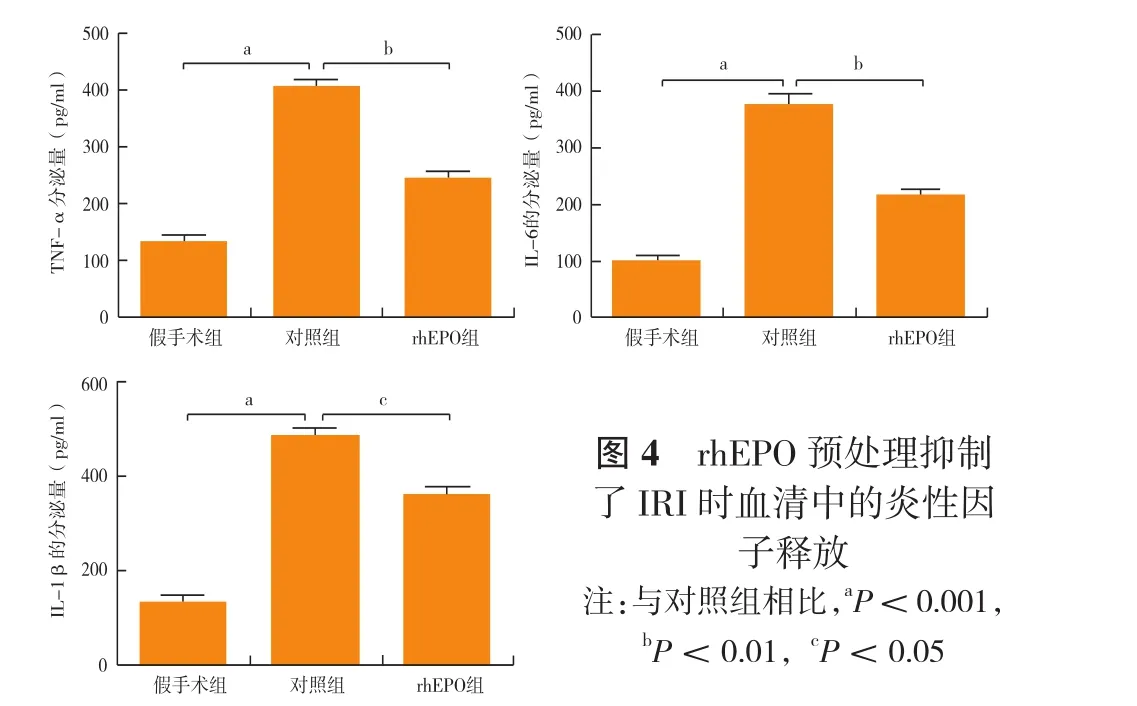
图4 rhEPO预处理抑制了IRI时血清中的炎性因子释放
3 讨 论
EPO是由肾脏和肝脏分泌的一种激素样物质,属于集落刺激因子,在骨髓造血微环境下能发挥促进红细胞生成的作用,研究表明其具有搞氧化[7]、搞炎[8]、搞细胞凋亡[9]和促血管生成[10]的特性,但是其对缺血/再灌注引起的肝损伤是否具有保护作用,目前研究极少。因此,我们通过建立大鼠70%肝脏组织IRI模型,阻断血流1小时后恢复肝脏血供3小时,观察肝损伤情况。组织学分析显示,缺血/再灌注造成明显的肝组织损伤,组织形态出现异常,出现肝细胞坏死、细胞质液泡化以及中性粒细胞浸润。值得注意的是,在术前1小时,行尾静脉给药的情况下,缺血/再灌注造成的肝组织病理变化明显减轻,说明rhEPO预处理能显著减轻缺血/再灌注造成的肝损伤。因此,我们认为rhEPO预处理是防治肝脏IRI的有效措施之一。
为了进一步探索其机制,我们测试了与免疫调节有关的PI3K/AKT信号传导途径。PI3K激酶由一个催化亚基p110和一个调控亚基p85组成,它的激活依赖于p85激活[11]。一旦p85被激活,它就会向p-AKT发出信号,这与炎症反应有关[12]。由PI3K激活的AKT可通过促凋亡蛋白、转录因子和激活内皮一氧化氮合酶生成一氧化氮来调控细胞存活[13]。最近发现PI3K/AKT通路的激活可以显著减轻大脑 IRI[14]和心肌 IRI[15]。研究表明,IRI诱导了PI3K的p85调控亚基的激活,对照组大鼠的p-p85水平明显高于假手术组大鼠。令人惊讶的是,在大鼠体内的rhEPO预处理进一步增强了p85的活性。这一结果促使我们深入研究了AKT的活性,因为p85的磷酸化会使AKT产生活性。与上述结果一致,p-AKT的表达也明显增加,rhEPO增强了AKT的活性。
为了进一步证明增强的PI3K/AKT信号能抑制炎症反应,我们随后在IRI肝脏组织中选择性地测定了TNF-α、IL-6和IL-1β的表达。结果显示,rhEPO预处理的大鼠表现出明显较低的TNF-α、IL-6和IL-1β表达量。总之,我们的数据说明rhEPO增强了PI3K/AKT的活化信号,然后抑制了炎症反应,保护肝脏不受IRI的影响。在调节适应性免疫反应方面,PI3K/AKT通路一直被认为是很重要的[16]。例如,不同的PI3K异质二聚体可以分别控制细胞增殖和存活、B和T细胞受体信号,以及B和T淋巴细胞的趋化性[17-18]。最近,人们越来越多地发现,在固有免疫细胞中,PI3K/AKT通路具有广泛而显著的作用[19-20]。固有免疫细胞迁移至受损的组织或器官,需要对细胞骨架和膜结构进行动态重组,而PI3K信号则是提供细胞极性和伪足扩展来实现这一过程的关键[18]。有研究显示,PI3K的激活减弱了Geniposide引起的肝脏IRI[21],因此,本实验没有进行额外的研究,以证明激活的PI3K/AKT信号抑制了在肝内引起的免疫反应。值得注意的是,rhEPO减轻肝脏IRI损伤可能会涉及到其他途径,而不仅仅是PI3K/AKT信号,如MAPK激酶级联信号[3],这将是下一步的研究重点。
总之,本研究有力地说明了rhEPO预处理可以改善IRI引起的肝脏损伤,表现为肝脏组织病理变化较轻以及炎性浸润明显减弱。机制研究表明,rhEPO增强了PI3K/AKT信号的激活,从而抑制了炎症的渗透以缓解肝脏IRI。以上结果提示,rhEPO在临床实践中可以作为预防或治疗肝脏IRI的一种很好的替代疗法。

