鸭肠炎病毒SORF3基因的克隆及表达载体的构建*
刘存霞 ,吴静 ,田雪 ,赵巧雅 ,路晓 ,王林 ,李玉峰 ,宋敏训 **
(1.山东省农业科学院家禽研究所 家禽疫病诊断与免疫重点实验室,山东 济南 250023;2.济南亿民动物药业有限公司,山东 济南 250105)
鸭肠炎病毒(Duck Enteritis Virus,DEV)为双链DNA病毒,最近一次国际病毒分类报告将DEV归在疱疹病毒科、α疱疹病毒亚科,马立克病毒属成员[1]。本实验室李玉峰[2,3]等率先通过构建基因组文库的方法完成了DEV VAC疫苗株全基因组的序列测定与分析,从而为该病毒的分子生物学研究提供了理论数据。通过对目前已完成基因组测序的禽疱疹病毒分析发现,在人或动物疱疹病毒中未发现而在禽疱疹病毒中特有的5个基因,即 LORF11、LORF9、LORF3、LORF2 和 SORF3, 推测其在禽疱疹病毒感染能力或宿主范围上扮演某种角色,Zelnik V等[4]将lac Z表达盒替换HVT的US1、US10、SORF3基因,重组病毒表达 lac Z基因且病毒复制未受影响,推测SORF3为DEV复制非必需基因,也有报道SORF3蛋白具有跨膜区[5]。本研究对SORF3基因进行原核表达,为SORF3基因功能的功能研究奠定基础。
1 材料与方法
1.1 病毒、细胞和试剂 鸭病毒性肠炎病毒为山东省农业科学院家禽所家禽疫病诊断与免疫重点实验室保存,CEF细胞本实验室制备。Ex-Taq DNA聚合酶、鼠源反转录酶、PCR产物连接试剂盒pMD18-T载体、T4DNA连接酶、BSA、RNA酶及各种限制性内切酶均购自TaKaRa公司和Promega公司;病毒基因组提取试剂盒为天根生化科技(北京)有限公司产品;PCR产物胶回收试剂盒为Axygen公司产品;预染蛋白质分子量标准为Thermo公司产品;HRP标记兔抗His-Tag多克隆抗体购自Proteintech公司;IPTG为BBI公司产品;HRP标记羊抗兔IgG为KPL公司产品;DAB购自Biosharp生物公司。
1.2 引物设计 根据GenBank中SORF3基因已有序列,通过primer primer5软件进行引物设计,设计引物并加入EcoR I、Not I酶切位点,引物序列如下:

扩增片段为902bp,由英潍捷基(上海)贸易有限公司合成。
1.3 病毒基因组提取及PCR扩增 取DEV按0.1MOI接种原代DEF细胞,37℃ 5%CO2培养至出现细胞病变,收集病毒液按试剂盒操作说明提取病毒基因组,用引物SORF3-F、SORF3-R进行PCR扩增,配制 25μl PCR反应体系:10×Ex Buffe 2.5μl、dNTPs(10mM)0.5μl、ExTaq 酶 0.25μl、 上 游引 物 (20pM)、下 游 引 物 (20pM)各 0.5μl,上 述cDNA 4μl,补水至 25μl,PCR 反应条件为:94℃预变性 3min;94℃变性 30s;55℃退火 30s;72℃延伸40s;30 个循环,72℃再延伸 10min。
1.4 目的片段克隆测序 PCR产物用1%的琼脂糖凝胶电泳进行鉴定,用回收试剂盒对目的片段进行回收纯化与pMD18-T载体连接过夜,转化感受态DH5α细胞。提取重组子质粒经酶切鉴定阳性克隆质粒命名为pMD18-T-SORF3,由英潍捷基(上海)贸易有限公司测序分析。
1.5 原核表达载体构建 将克隆质粒pMD18-TSORF3、原核表达质粒 pET32a经 EcoR I、Not I双酶切,分别回收目的片段及载体片段,以T4DNA连接酶连接过夜,转化感受态DH5α细胞,提取质粒进行经EcoR I、Not I双酶切鉴定,阳性质粒转化感受态BL21细胞,再次进行经EcoR I、Not I双酶切鉴定,阳性质粒命名为pET32a-SORF3。
1.6 原核表达及诱导条件优化 挑取pET32a-SORF3 阳性菌单克隆于 4ml LB/Kan(100μg/ml)培养基中振荡培养8~12h;按1:100体积比接种于50ml LB/Kan(100μg/ml)培养基中;37℃摇床培养至 OD600 为 0.55~0.65,加入 IPTG(500mmol/L)至终浓度为1.0mmol/L进行诱导;pET-28a(+)空载体转化菌株同步诱导作为对照,37℃ 5~6h培养,每隔1h取4ml培养液;离心收集诱导后的菌体,用冰预冷的裂解缓冲液重悬菌体,冰浴中超声破碎菌体;离心分离可溶组分与包涵体,进行SDS-PAGE,检测目的蛋白是否表达并分析其表达形式。
表达条件的优化:按上述操作在培养物中加入IPTG至终浓度为0.4~1.2mmol/L(5个浓度,梯度为 0.2mmol/L)分别进行诱导,每隔1h取样1次,超声破碎菌体;离心分离可溶组分与和包涵体,进行SDS-PAGE分析,确定最佳诱导时间和诱导物浓度。
1.7 重组蛋白的Western blot鉴定 将表达产物经SDS-PAGE电泳分离后,电转移至硝酸纤维素膜(NC膜)上;用兔抗 His-Tag多克隆抗体为一抗,辣根过氧化物酶标记的羊抗兔IgG为二抗进行Western-blot检测。
2 结果与分析
2.1 RT-PCR电泳结果 提取DEV基因组,以引物SORF3-F、SORF3-R进行PCR扩增,1%琼脂糖凝胶电泳可见900bp左右片段,与预期大小一致,见图1,表明成功扩增出目的片段。

图1 PCR扩增SORF3基因
2.2 克隆、表达载体构建 将PCR产物与pMD18-T载体连接,经转化小提质粒EcoR I、Not I双酶切鉴定获得阳性质粒pMD18-T-SORF3,见图2(左),同理构建了原核表达质粒pET32a-SORF3,以 EcoR I、Not I双酶切鉴定,见图 2(右),表明成功构建出克隆质粒pMD18-T-SORF3和原核表达质粒pET32a-SORF3。

图2 质粒酶切鉴定图
2.3 原核表达产物的SDS-PAGE分析 BL21/pET32a-SORF3重组菌经IPTG诱导表达,SDSPAGE分析表明IPTG至终浓度为1.0mmol/L,37℃诱导4~5h目的蛋白可获得较高水平的表达,表达产物主要以包涵体形式存在,上清同样有少量表达,重组蛋白电泳检测SORF3蛋白为50kDa左右的蛋白,见图3,结果成功表达SORF3蛋白。
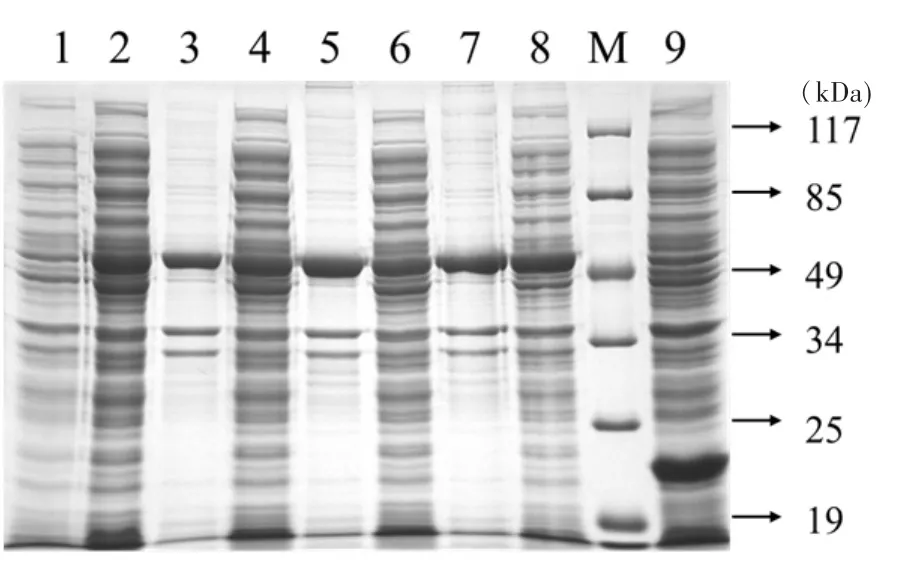
图3 pET32a-SORF3原核表达条件优化SDS-PAGE电泳图
2.4 Western Blot鉴定结果 以兔抗His-Tag多克隆抗体为一抗,辣根过氧化物酶标记的羊抗兔IgG为二抗进行Western-blot检测,上清沉淀中均可见目的条带,见图4所示。

图4 SORF3基因表达Western Blot检测
3 讨论
到目前为止,已完成全基因组测序并发表的禽类疱疹病毒有 MDV、HVT、ILTV 和 PsHV[6,7]。 禽疱疹病毒基因分成两大类:一是与其他α疱疹病毒同源的基因,这类基因在病毒基因组中占大多数;二是禽疱疹病毒特有基因,这类基因与病毒特有的生物学特性有关。程安春等[8]对鸭病毒性肠炎病毒基因组进行了系统分析,但大多数基因的功能仍不清楚。 LORF11、LORF9、LORF3、LORF2 和SORF3分别位于DEV基因组长片段的两端和短片段的内部。氨基酸同源性分析显示与其他禽疱疹病毒相应基因的同源性在24%~50%之间。其中LORF11、LORF9、LORF3、LORF2 存 在 于 MDV、HVT、DEV基因组内,已知SORF3基因不仅存在于ILTV的基因组中,而且存在于其它禽疱疹病毒中。据推测仅存在于禽疱疹病毒基因组中5个基因可能与病毒独特的致病机理有关。Zhong zhou等[9]以DEV为载体在其SORF3与US2基因之间插入鸭坦布苏病毒(Duck Tembusu virus,DTMUV)的E基因,免疫鸭后获得抗病毒抗体。本研究针对SORF3基因构建原核表达载体,SDS-PAGE及WB检测结果表明,SORF3基因可在大肠杆菌培养上清及沉淀中检测到蛋白表达,与母晓宇等[10]研究结果一致,该研究为下一步制备抗SORF3蛋白血清及功能的研究奠定基础。
——一道江苏高考题的奥秘解读和拓展

