银屑病皮损CD8αα+T细胞表型鉴定
张洋洋 李冰 王刚
710032西安,第四军医大学西京皮肤医院
银屑病是以T细胞免疫紊乱为主的慢性炎症性皮肤病,发病机制尚未阐明。目前普遍认为,CD4+T细胞过度活化是银屑病免疫学发病机制的中心环节,其中CD4+T细胞活化后产生的白细胞介素17(IL⁃17)是介导银屑病发病的关键细胞因子[1⁃2]。近年研究发现,CD8+T细胞也可以分泌IL⁃17A,且银屑病患者皮损也有CD8+T细胞浸润[3⁃4]。近年研究发现,CD8+T细胞分群更复杂且发挥的功能更丰富。除了细胞毒性T细胞外,CD8+T细胞中还存在发挥负向免疫调控功能的CD8+调节性T细胞(CD8+Treg)和分泌IL⁃17的Tc17细胞。CD8+Treg细胞参与多种自身免疫性疾病的发病,包括系统性红斑狼疮、风湿性关节炎、多发性硬化等[5]。Tc17细胞在银屑病、风湿性关节病中也发挥重要作用[6]。本研究探究CD8+T细胞在银屑病中发挥的作用,为CD8+T细胞在银屑病等炎症性皮肤病的机制研究奠定基础。
材料和方法
一、材料
1.皮肤标本:银屑病皮损标本来自第四军医大学西京皮肤医院2017年1-12月明确诊断的8例进行期斑块状银屑病,男女各4例,年龄24~50岁,银屑病皮损面积和严重程度指数(PASI评分)13.2~22.7,均数为18.3,近3个月未使用系统性药物,近1周未使用外用药物及光疗。健康对照皮肤取自8例与银屑病组年龄、皮损取材部位匹配的西京医院整形外科手术剩余皮肤,男女各4例,年龄23~46岁。本研究通过第四军医大学西京医院医学伦理委员会批准(KY20172030⁃1),受试者均签署知情同意书。
2.主要试剂:兔抗人CD8α单抗、小鼠抗人CD8α单抗、小鼠抗人CD3单抗、小鼠抗人CD56单抗、小鼠抗人CD11c单抗、小鼠抗人Foxp3单抗、小鼠抗人CD25单抗、兔抗人CD122多抗、兔抗人CD103单抗、兔抗人CCR7单抗、Alexa Fluor 488-山羊抗兔、Cy3-山羊抗鼠、Alexa Fluor 488-驴抗羊二抗(美国Abcam公司),小鼠抗人CD8β单抗(美国Santa Cruz Biotechnology公司),小鼠抗人CD45RA单抗(美国Biolegend公司),山羊抗人IL⁃17A抗体(美国R&D Systems公司)、山羊血清(美国Boster Biological Technology公司)。Hochest为上海碧云天生物技术有限公司产品。
二、方法
1.免疫荧光:取银屑病皮损、健康对照皮肤组织,4%甲醛固定,石蜡包埋、切片,常规脱蜡至水,高压修复,于山羊血清中室温孵育30 min,分别滴加50 μl稀释后的 CD8α、CD3、CD56、CD11c、CD8β、Foxp3、CD25、CD122、CD103、CCR7、CD45RA、IL⁃17A一抗混合液(稀释比例按说明书),4℃过夜。次日室温复温1 h,滴加相应的二抗复合物50 μl(1∶200),室温放置 45 min,洗涤液冲洗,滴加Hochest复合物(1∶1 000),室温放置10 min,洗涤液反复冲洗,甘油封片。激光共聚焦显微镜(日本OLYMPUS公司)于暗室观察,采集图像。根据镜下荧光强度判断分子表达,低倍镜及高倍镜下均未见荧光为阴性,低倍镜下及高倍镜下均可见荧光为阳性,低倍镜下可见弱荧光,高倍镜下明显可见荧光为阳性。手动计数表型分子与CD8α共染阳性细胞占CD8α阳性细胞百分比。
2.统计学方法:应用Graphpad Prism7软件,计量资料用±s表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
一、银屑病皮损浸润的CD8+细胞主要是CD8αα+T细胞
银屑病组皮损浸润的CD8+细胞表达T细胞标志CD3,不表达树突细胞标志CD11c和自然杀伤细胞标志CD56。银屑病组CD8+T细胞中CD8αα+表型占88.48%±7.39%,对照组皮肤局部仅有个别CD8+T细胞浸润,CD8αα+表型占14.43% ± 13.14%,两组比较差异有统计学意义(t=11.5,P<0.01)。见图1。
二、银屑病皮损浸润的CD8αα+T细胞分泌IL⁃17A
银屑病皮损中分泌IL⁃17A的CD8αα+T细胞占24.85%±4.25%,健康对照组皮肤CD8αα+T细胞不分泌IL⁃17A,差异有统计学意义(t=5.853,P <0.01)。见图2。
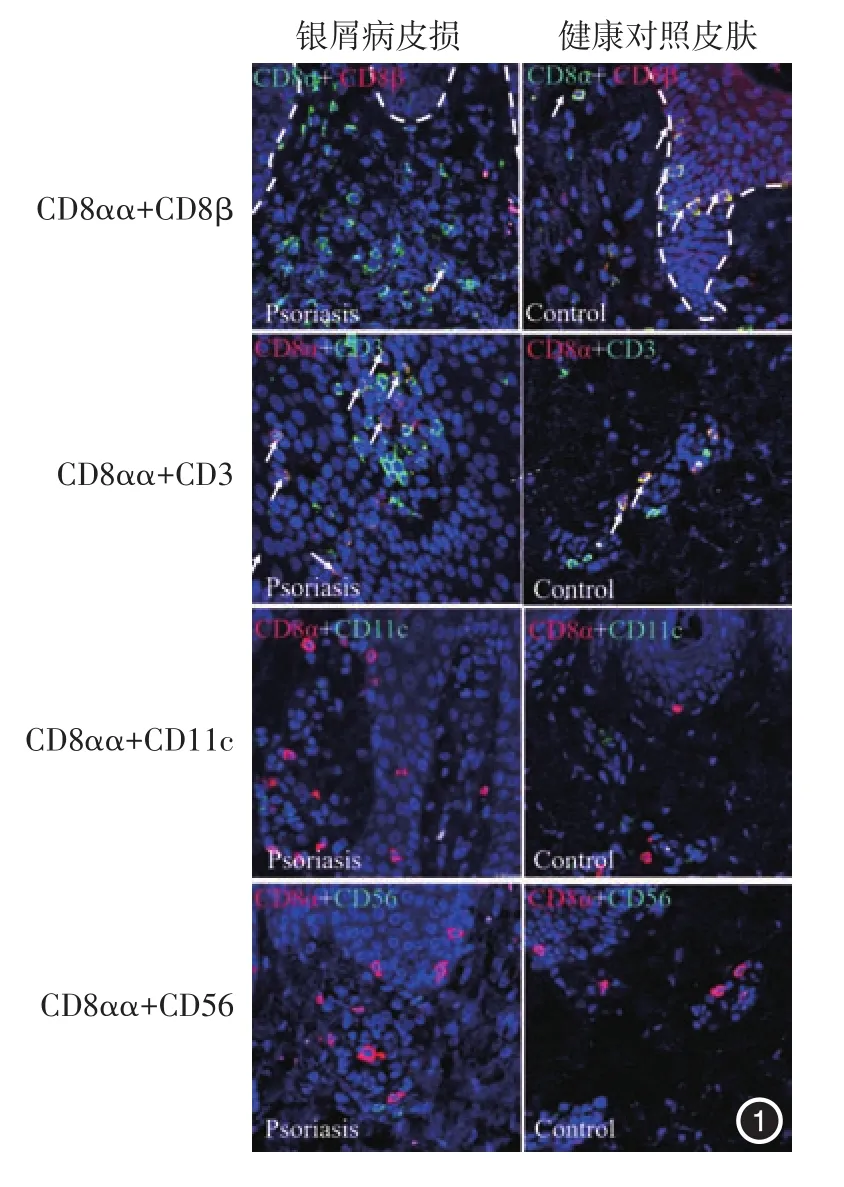
图1 免疫荧光检测银屑病皮损与健康人皮肤局部浸润的CD8+细胞表型(×600) 银屑病皮损浸润的CD8+细胞表达T细胞标志CD3,不表达树突细胞标志CD11c与自然杀伤细胞标志CD56,主要为CD8αα+T细胞
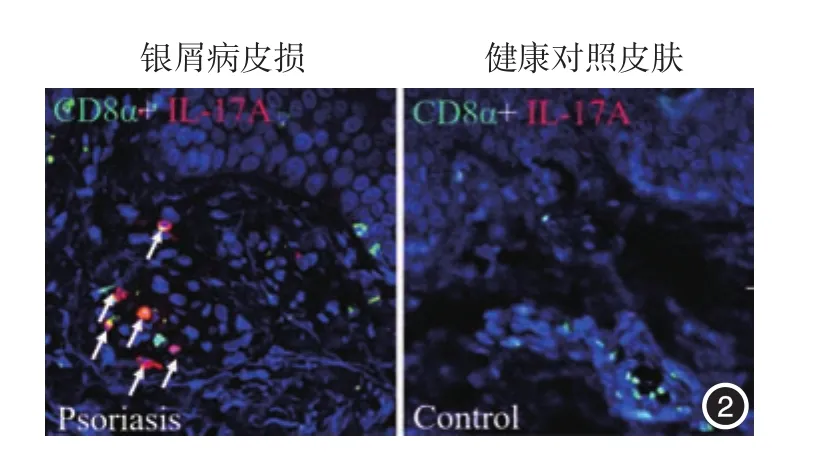
图2 免疫荧光检测银屑病皮损及健康人皮肤局部CD8α与IL-17A共染情况(×600) 银屑病皮损浸润的CD8αα+T细胞分泌IL-17A的比例显著高于健康对照
三、银屑病皮损浸润的CD8αα+T细胞表型
银屑病皮损浸润的CD8αα+T细胞不表达CCR7和CD45RA,呈CD45RA-CCR7-效应记忆性T细胞表型,表皮浸润的CD8αα+T细胞98.3%±1.0%表达组织局部定植标志CD103,真皮浸润的CD8αα+T细胞基本不表达CD103;健康对照皮肤不表达CD103(图3A)。银屑病皮损浸润的CD8αα+T细胞上未见CD8+Treg细胞标志分子Foxp3、CD25和CD122(图3B)。
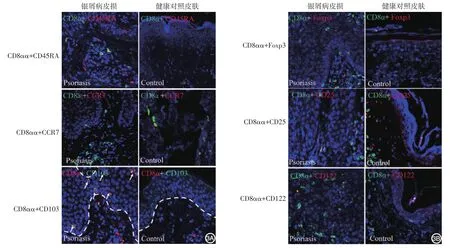
图3 免疫荧光检测银屑病皮损浸润的CD8αα+T细胞的表型(×600) 3A:银屑病皮损浸润的CD8αα+T细胞不表达CCR7与CD45RA,表达CD103,表达CD8αα+T细胞浸润于表皮;3B:银屑病皮损浸润的CD8αα+T细胞上未见CD8+Treg细胞标志分子Foxp3、CD25和CD122
讨 论
普遍认为,T细胞免疫紊乱是银屑病发病免疫学机制的中心环节[1]。以往研究发现,银屑病皮损局部有CD8+T细胞浸润[4],Boniface等[7]发现,银屑病皮损浸润的CD8+T细胞部分是组织局部定植细胞,但其具体细胞表型尚不明确。CD8+细胞上表达的CD8分子有两种二聚体亚型,包括α链组成的同源二聚体CD8αα和α、β链组成的异源二聚体CD8αβ,两者功能有显著差别。CD8αβ作为T细胞共受体促进细胞活化,表达于杀伤性CD8+T细胞表面。CD8αα通过识别T细胞受体衍生的肽链靶向活化的T细胞发挥负向免疫调控功能[8],可表达于CD8+T细胞,或非T细胞包括自然杀伤细胞和树突细胞表面[9]。以往研究发现,在肠道黏膜局部肠上皮淋巴细胞中,CD8αα+T细胞表型占43%[10],在人皮损单纯疱疹复发皮损局部,CD8αα+T细胞主要分布于真表皮交界处[11],而银屑病皮损浸润的CD8+T细胞是否有CD8αα+T表型尚不清楚。
我们发现,银屑病皮损真、表皮均有CD8+细胞浸润,通过检测银屑病皮损CD8α、CD8β及T细胞标志CD3、树突细胞标志CD11c和自然杀伤细胞标志CD56,确定了银屑病皮损浸润的CD8+细胞,主要是CD8αα+T细胞表型。为了进一步探究银屑病皮损浸润的CD8αα+T细胞的表型,我们检测了鉴别初始细胞分子CD45RA、记忆细胞分子CCR7与组织局部定植细胞标志CD103[12]。免疫荧光示,银屑病皮损浸润的CD8αα+T细胞呈CCR7-CD45RA-效应T细胞表型。表皮浸润的CD8αα+T细胞表达CD103,真皮浸润的CD8αα+T细胞不表达CD103,提示银屑病表皮浸润的CD8αα+T细胞是组织局部定植细胞,真皮处细胞可能来源于外周血。以往研究示,CD8αα+T细胞作为CD8+Treg细胞在小鼠肠道黏膜局部免疫中发挥负向免疫调控作用[10]。我们通过检测CD8+Treg亚群的标志Foxp3、CD25和CD122[13],发现银屑病皮损浸润的CD8αα+T细胞非CD8+Treg表型,提示CD8αα+T细胞在银屑病患者皮损发挥的作用可能与小鼠肠道的CD8αα+T细胞不同。
银屑病发病机制中,IL⁃17A是关键的促炎因子[1⁃2]。近年来研究发现,IL⁃17A不仅来源于CD4+T细胞,CD8+T细胞、γδT细胞、中性粒细胞等也可以产生IL⁃17A,参与银屑病发生发展[1]。我们发现,银屑病皮损浸润的CD8αα+T细胞分泌IL⁃17A的细胞比例显著高于对照组,提示银屑病皮损浸润的CD8αα+T细胞通过分泌IL⁃17A参与银屑病的发生发展。
本研究发现,银屑病皮损处浸润的CD8+细胞主要为CD8αα+T细胞,通过分泌IL⁃17A参与银屑病的发病,拓展了对CD8αα+T细胞亚群及其功能的认识,明确了CD8+T细胞在银屑病发病中的作用,丰富了银屑病的免疫学机制,为CD8+T细胞在炎症性疾病中的作用研究提供了新思路。

