胃泌素释放肽前体及胃蛋白酶原与胃息肉的相关性研究
刘姗 冯玉良 郑培奋⋆
胃息肉是胃镜检查最常发现的病变之一,由胃黏膜上皮或腺体过度增生形成[1]。亚洲国家胃息肉主要以增生性息肉和胃底腺息肉为主[2],但国内相关报道较少。有研究显示,有2%~19%的增生性息肉发生异型增生,0.6%~2%伴随同时性胃癌[3]。胃泌素释放肽前体(ProGRP)是胃泌素释放肽基因编码的产物,在血浆中稳定表达,能反映胃泌素释放肽的水平。胃泌素释放肽刺激胃窦G细胞分泌胃泌素,可能通过影响细胞增殖、凋亡、迁移、血管形成等,促进胃上皮肿瘤形成[4]。本文分析胃息肉患者内镜下息肉切除术后血清ProGRP及胃蛋白酶原的变化,现报道如下。
1 临床资料
1.1 一般资料 选择2017年1月至6月本院行胃镜检查的患者120例。排除:(1)因患者不耐受或其他原因未完成胃镜检查。(2)既往有胃癌、胃手术史。(3)胃镜及病理活组织检查证实存在癌变。(4)1个月内曾接受过质子泵抑制剂、铋剂、抗生素等药物治疗。(5)幽门螺旋杆菌感染。(6)有严重心、肾、肝、肺等疾病患者。胃息肉诊断标准:胃息肉胃镜下表现为由胃黏膜面突起到胃腔的一种隆起性病变,病理组织学提示增生性、腺瘤性息肉、炎性息肉、胃底腺息肉。幽门螺旋杆菌(HP)感染诊断标准:14C呼气试验>100Dpm。诊断胃息肉患者60例,男28例,女32例;平均年龄(62.74±8.59)岁。无胃息肉者(胃镜检查提示非萎缩性胃炎及大致正常胃黏膜)60例,男27例,女33例;平均年龄(61.01±9.30)岁。两组性别、年龄,差异无统计学意义。本项目经本院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 方法 所有患者均于清晨空腹状态下进行胃镜检查并取活组织病理检查,组织学标本固定于10%的甲醛溶液中,常规石蜡包埋、切片、HE染色后行组织学评价与分类。抽取肘静脉血检测ProGRP、PGI、PGII水平,14C呼气试验检测HP感染情况、比较两组血清ProGRP、PGI、PGII水平及PGI/PGII差异。观察组患者接受内镜下息肉摘除术后6个月时复查胃镜,根据内镜下胃息肉切除术后是否有息肉复发将观察组分为治愈组及复发组,比较息肉切除前后血清ProGRP、PGI、PGII水平及PGI/PGII差异。检查均由有经验的消化内科医师进行操作,ProGRP、PGI、PGII均采用酶联免疫吸附测定检测,ProGRP测定采用ProGRP定量试剂盒,PGI、PGII采用胃蛋白酶原定量试剂盒。
1.3 统计学方法 采用SPSS19.0统计统计。计量资料以()表示,用t检验,计数资料比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 胃息肉部位及组织学类型 发生在胃窦的增生性息肉35例,占58.3 %,发生在胃体及胃底的增生性息肉10例,占16.7 %,腺瘤性息肉15例,占25%。
2.2 胃息肉组与对照组ProGRP、PG水平比较 见表1。
表1 两组患者ProGRP、PG水平比较()

表1 两组患者ProGRP、PG水平比较()
组别 ProGRP(pg/ml) PGI(ng/ml) PGII(ng/ml) PGI/PGII观察组(n=60) 105.88±18.10 128.82±16.58 16.62±1.59 7.77±0.84对照组(n=60) 59.74±13.89 81.13±8.55 7.40±1.45 11.34±2.53 t值 161.691 229.079 343.753 -93.190 P值 <0.001 <0.001 <0.001 <0.001
2.3 不同病理类型胃息肉患者ProGRP、PG水平比较 见表2。
表2 不同病理类型胃息肉患者ProGRP、PPGI/PGII G水平比较()
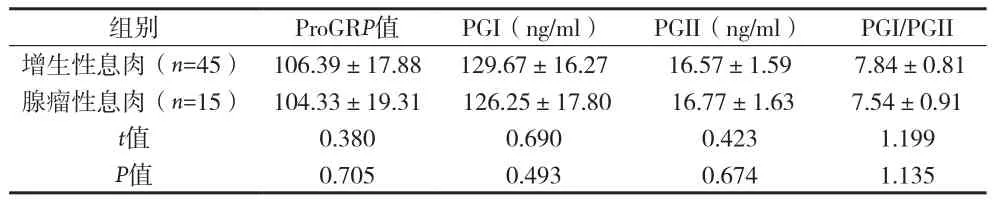
表2 不同病理类型胃息肉患者ProGRP、PPGI/PGII G水平比较()
组别 ProGRP值 PGI(ng/ml) PGII(ng/ml) PGI/PGII增生性息肉(n=45) 106.39±17.88 129.67±16.27 16.57±1.59 7.84±0.81腺瘤性息肉(n=15) 104.33±19.31 126.25±17.80 16.77±1.63 7.54±0.91 t值 0.380 0.690 0.423 1.199 P值 0.705 0.493 0.674 1.135
2.4 复发组与未复发组患者治疗前后ProGRP、PG水平比较 见表3。
表3 复发组与未复发组患者治疗前后ProGRP、PG水平比较()

表3 复发组与未复发组患者治疗前后ProGRP、PG水平比较()
组别 时间 ProGRP(pg/ml) PGI(ng/ml) PGII(ng/ml) PGI/PGII复发组 治疗前 100.41±10.63 131.00±10.35 16.39±1.69 8.02±0.69(n=14) 治疗后 103.39±11.53 128.57±16.15 16.23±1.63 7.94±0.76 t值 -0.615 0.405 0.247 0.285 P值 0.544 0.689 0.807 0.778未复发组 治疗前 107.39±19.22 128.21±16.92 16.69±1.54 7.70±0.86(n=47) 治疗后 83.41±16.15 107.76±15.71 11.40±1.28 9.48±1.16 t值 6.476 6.009 17.890 -8.374 P值 0.001 0.001 0.001 0.001
3 讨论
胃息肉为胃癌的癌前病变,发病率正逐年升高,但关于胃息肉发生癌变的具体机制目前尚不完全清楚,可能与幽门螺旋杆菌感染、长期使用质子泵抑制剂、遗传与环境、胆汁反流等多种因素有关[5]。胃泌素释放肽是一种重要的胃肠肽类激素,刺激胃窦G细胞分泌胃泌素,在胃肠道疾病,尤其是胃肠道肿瘤的发生发展中具有重要作用[6-7]。INS-GAS小鼠的动物实验研究表明,高胃泌素血症能促进胃腺癌发生发展[8]。胃泌素释放肽半衰期较短,临床通常采用检测血清ProGRP反映胃泌素释放肽水平。PG为胃蛋白酶前体,分为PGI和PGII两种亚型,PGI由胃底黏膜的主细胞和黏液颈细胞分泌,PGII由贲门、胃底、胃窦、十二指肠近端黏膜分泌,两者经胃酸活化后形成胃蛋白酶,在分解蛋白质中具有重要作用,是诊断胃部疾病的重要血清学标志物[9]。血清胃蛋白酶原水平反映胃黏膜腺体和细胞的数量,体现了胃黏膜的形态及分泌功能[10]。目前临床长期使用质子泵抑制剂、幽门螺旋杆菌根除失败率增加,胃息肉的患病率也逐年升高。研究表明,在胃酸抑制状态及幽门螺旋杆菌感染时胃泌素分泌增加[11]。本资料显示胃息肉患者血清ProGRP、PGI、PGII水平较正常对照组明显升高,PGI/PGII比值降低。而内镜下息肉切除术后血清ProGRP、PGI、PGII水平较治疗前下降、PGI/PGII比值升高。提示胃息肉患者血清ProGRP、PG水平异常,可能与胃息肉的发病相关。胃炎状态下ProGRP水平升高,促进胃泌素分泌增加,胃窦G细胞周围的细胞因子释放增加[12]。高胃泌素血症促使胃腺体囊状扩张,形成息肉。血清PG水平受胃黏膜病理生理状态影响,与胃炎严重程度、胃萎缩程度有关[13]。血清ProGRP、PG 可能通过改变胃内pH值,促进白介素-1、细胞生长因子等多种促炎细胞因子的释放,损害胃黏膜屏障,使胃黏膜长期处于炎症状态,引起胃黏膜萎缩。胃息肉与胃黏膜炎症、萎缩等组织学病变相关。ProGRP、PG可能通过以上机制,促进胃息肉的发生。此外,不同病理类型胃息肉患者血清ProGRP、PGI、PGII水平差异均无统计学意义,提示血清ProGRP、PG水平可能与胃息肉病理类型无关,也可能与本研究样本量等因素有关。
总之,胃息肉患者血清ProGRP、PG水平明显升高,进一步研究血清ProGRP、PG与胃息肉发生的机制,可为深入探究胃息肉的发病机制及早期诊断,对于胃息肉癌变的早期干预和临床治疗具有重要意义。

