垂体腺瘤伴肢端肥大症患者双侧颈内动脉间距变化病例对照研究☆
江常震 丁陈禹 颜小荣 张元隆 林元相 康德智 林章雅
肢端肥大症主要由生长激素(growth hormone,GH)型垂体腺瘤导致[1-2]。由于患者长期暴露于过量的GH,常出现内脏、骨骼和/或软组织增大等表现。与一般人群相比,肢端肥大症患者的脑血管病死亡率要明显增高[3-4],意味着肢端肥大症除了引起一系列合并症,如糖尿病、高血压、垂体功能低下和心血管疾病等,还可能对颅内血管的结构产生影响。已有文献报道肢端肥大患者发生颅内动脉瘤的风险明显增加[5-6],且该风险与GH过量有关[5]。一些研究还表明肢端肥大症患者的颈内动脉(internal carotid artery,ICA)迂曲程度和血管扩张程度均有所改变[7]。由于肢端肥大症患者的主要治疗方式为经鼻蝶切除垂体腺瘤,手术过程中存在ICA损伤的风险,患者双侧ICA的间距变化对手术暴露范围具有一定影响。本研究对肢端肥大症患者及无功能型垂体腺瘤患者的双侧ICA间距做对比分析,了解肢端肥大症患者双侧ICA的间距变化。
1 对象与方法
1.1 研究对象回顾2016年8月至2018年3月期间我科收治的肢端肥大症和无功能型垂体腺瘤患者。纳入标准:①符合肢端肥大症或无功能型垂体腺瘤的临床诊断[8-9];②术前垂体MRI增强检查提示垂体腺瘤;③术后病理和免疫组化结果证实为GH型垂体腺瘤或无功能型垂体腺瘤。排除标准为:①年龄<18岁;②曾手术、放疗及生长抑素治疗;③临床资料、内分泌学检查、影像学检查、病理和免疫组化结果等资料不齐全。将符合纳入和排除标准的研究对象,肢端肥大症患者纳入试验组;无功能型垂体腺瘤按照年龄和性别,与试验组病例1:2进行配对,纳入对照组。
1.2 影像学检查与测量患者均进行CT(AquilionTM ONE系统,东芝公司,日本)和MRA检查(Magnetom Verio Tim MRI成像系统或Skyra MRI成像系统,西门子公司,德国),将影像资料导出为DICOM格式文件。随后将DICOM格式文件导入到3D打印图像软件上 (PolyJet StudioTM软件,遨杰上海公司,中国),进行影像重建并测量以下参数:①双侧ICA眼段起始部间距(C6起始部,双侧ICA在远侧硬膜环处的间距);②双侧ICA虹吸段膝状弯曲的最大距离(C4-C6,双侧ICA海绵窦段和床突上段移行处的最大间距);③双侧ICA海绵窦段间距 (C4);④双侧ICA破裂孔段间距(C3)(图 1)。
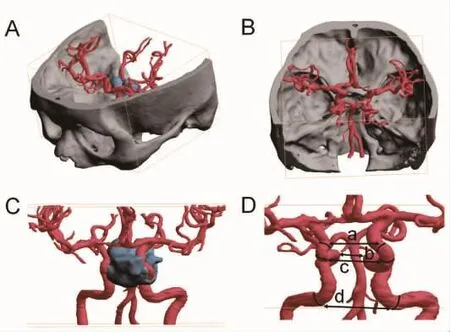
图1 应用3D打印图像软件进行ICA重建及间距测量。A:将原始影像学检查资料导入3D打印图像软件上,重建出颅骨、垂体瘤和ICA;B:颅骨与ICA融合图像,可借助颅骨自然孔道判断ICA分段;C:垂体瘤与ICA融合影像,可见本例患者的垂体瘤主要包绕和推挤左侧ICA;D:在图像上测量双侧ICA间距,包括:双侧ICA眼段起始部间距 (a)、双侧ICA虹吸段膝状弯曲的最大距离(b)、双侧 ICA 海绵窦段间距(c)和双侧 ICA 破裂孔段间距(d)
1.3 内分泌学检测患者均于术前7时晨起空腹安静状态下抽取静脉血,检测垂体激素全套和IGF-1。均采取化学发光免疫分析法(ADVIA Centaur XP检验系统,西门子公司,德国)进行测值。
1.4 统计分析统计分析采用SPSS 19.0进行,计量资料以 x±s或中位数(四分位数)[M(QL,QU)]表示,计数资料以n表示。计量资料的对比采用t检验或Wilcoxon秩和检验,计数资料的对比采用χ2分析或Fisher确切概率法。检测水准α=0.05。
2 结果
2.1 临床特征试验组和对照组患者的临床特征见表l,试验组患者的空腹GH为 45.6(7.7,62.8)μg/L(范围 5.3~456.4 μg/L);对照组患者的空腹 GH 为0.8(0.4,1.4)μg/L(范围 0.3~2.6 μg/L),差异具有统计学意义(Z=-6.423,P<0.001);其余临床特征均无统计学意义。
2.2 双侧ICA相应间距比较相较于对照组患者而言,试验组患者的双侧ICA虹吸段膝状弯曲部的最大距离 [(25.1±3.9)mm vs.(23.2±2.9)mm,t=2.089,P=0.041)]和双侧 ICA 破裂孔段间距[(26.2±3.1)mm vs.(23.8±4.1)mm,t=2.350,P=0.022]均有明显扩大;双侧ICA海绵窦段间距[(20.7±4.3)mm vs.(22.4±3.1)mm,t=-1.806,P=0.076]趋向于更小,但差异无统计学意义;双侧ICA眼段起始部间距无明显差异 [(15.7±5.1)mm vs.(16.0±2.5)mm,t=-0.223,P=0.826]。
3 讨论
经鼻蝶切除垂体腺瘤是肢端肥大症患者的主要治疗方式,术中ICA破裂和术后ICA假性动脉瘤形成是已知的手术并发症之一,均与术中ICA损伤有关。相较于无功能型垂体腺瘤,功能型垂体腺瘤术中ICA出血的风险更高[10]。因此,患者双侧ICA间距是制定手术策略时的重要考量因素,尤其是对于功能型垂体腺瘤[11]。
肢端肥大症患者由于长期过量的GH刺激,可能导致ICA发生形态学改变。部分肢端肥大症患者存在血管结构和功能上的改变,例如:主动脉硬化、皮下小动脉血管壁重构、血管弯曲度增加和血管内皮功能障碍等[12-14]。本研究通过对比肢端肥大症患者和无功能型垂体腺瘤患者的双侧ICA间距,发现肢端肥大症患者的双侧ICA虹吸段膝状弯曲部的最大距离和双侧ICA破裂孔段间距均较无功能型垂体腺瘤患者有明显扩大 (平均差值分别为1.9 mm和2.4 mm)。同时,试验组的双侧I CA海绵窦段间距趋向于更小(平均差值为-1.7 mm),虽然差异无统计学意义。该结果与MANARA R等[7]的研究结果存在差异,MANARA R等分析176例肢端肥大症患者的影像学检查数据后,发现肢端肥大症患者的双侧ICA破裂孔段间距变小 (平均差值为-1.2 mm),而海绵窦段间距扩大(平均差值为1.3 mm),且ICA扭曲度增加。究其原因,除了人种差异之外,MANARA R等[7]研究中的对照组均为头痛或短暂性神经功能障碍的患者,而本研究所纳入的对照组均为无功能性垂体腺瘤。无功能性垂体腺瘤同样存在鞍区占位效应,可对ICA造成局部压迫,但缺乏肢端肥大症的高GH分泌状态导致的系统性ICA结构改变。
随着内镜经鼻蝶手术的应用日益推广,颅底ICA解剖结构的变化也越来越受到重视。经鼻内镜手术已成为鞍区手术常规术式,本研究报道了肢端肥大症患者的ICA结构改变,对促进肢端肥大症患者经鼻蝶内镜手术的安全性具有一定的价值。由于许多沿着垂体窝、前颅底和中颅底发生的病变,都能够影响正常的ICA解剖结构,对于神经内镜手术而言,明确ICA基本走行和解剖结构变异,是确保手术安全的重要前提之一。过去常常认为双侧颈内动脉和视神经是经鼻蝶手术的界限,然而随着神经内镜手术的发展,在术前评估充分的情况下,许多时候术中可以选择扩大鞍区海绵窦入路,显露海绵窦、翼腭窝和颞下窝内血管神经等结构,此时ICA暴露在手术视野中,同时又成为重要的解剖标志,避免进一步损伤其他重要结构[15]。因此术前明确ICA的定位和解剖结构改变就尤为重要。

表1 两组患者的临床特征对比

表2 两组患者双侧颈内动脉间距的对比 (mm,x±s)
肢端肥大症患者的双侧ICA虹吸段膝状弯曲部的最大距离和双侧ICA破裂孔段间距扩大的原因可能包括了局部因素和系统性因素。其中局部因素主要是垂体腺瘤的局部压迫效应。GH型垂体腺瘤患者多为大腺瘤[16],容易侵犯海绵窦,可能会推挤颈内动脉导致双侧ICA海绵窦段间距扩大。然而,也有部分研究表明垂体腺瘤侵袭海绵窦与ICA形态改变无关,GH微腺瘤具有比GH大腺瘤更大的ICA扭曲度[7]。本研究选择以无功能型垂体腺瘤患者为对照组,实验组和对照组在垂体腺瘤直径和Knosp分级上均无明显差异,但双侧ICA虹吸段膝状弯曲部的最大距离与双侧ICA破裂孔段间距的差异显著,进一步说明了局部因素对肢端肥大症患者双侧ICA间距的影响可能较小。
过量分泌的GH及其导致的相关并发症可能是肢端肥大症导致双侧ICA间距改变的系统性因素。GH能够促进血管组织细胞进行分裂,包括平滑肌细胞、成纤维细胞、脂肪细胞、巨噬细胞、淋巴细胞和血管内皮细胞,并在控制血管组织细胞的生长和代谢过程中起到关键作用[17-18]。这可能是本研究中肢端肥大症患者的双侧ICA间距扩大的主要原因。

