隐源性多灶性溃疡狭窄性小肠炎临床特征分析
李文坤,刘揆亮,吴 静
隐源性多灶性溃疡狭窄性小肠炎(CMUSE)是一种罕见疾病,日本学者称之为慢性非特异性多灶性小肠溃疡(CNSU)。目前,全世界仅有60余例CMUSE或CNSU病例报道[1],首例是DEBRAY等[2]于1964年报道,该病特点为不明原因的小肠狭窄、梗阻和多发浅表溃疡,病程反复发生,激素治疗有效[3]。本文报道1例CMUSE病例,并收集国内外报道的CMUSE或CNSU病例,以分析该病的临床特征,为该疾病的诊治提供参考。
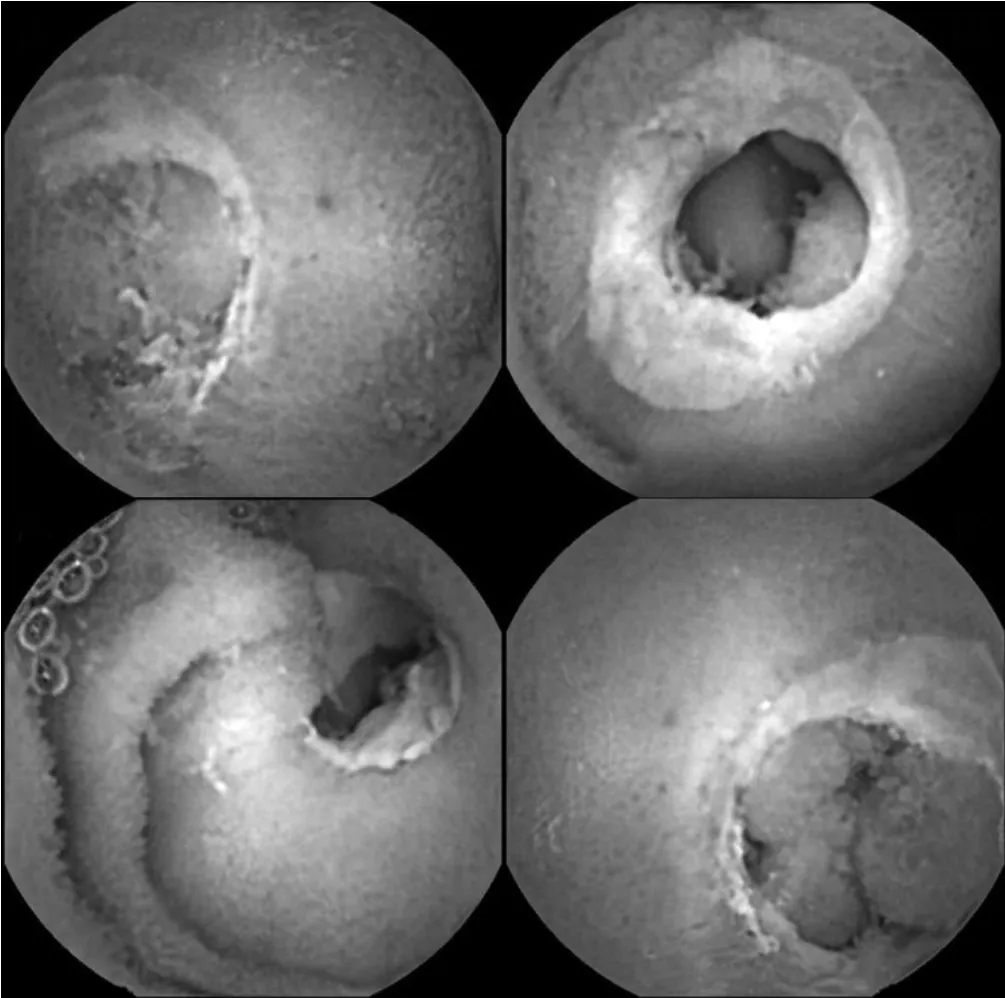
图1 胶囊内镜检查图像Figure1 Capsule endoscopy image

图2 术后大体病理图像Figure2 Image observed by the naked eye

图3 术后病理图像(HE染色,×100)Figure3 Postoperative pathological images
1 病例简介
患者,女,21岁,主因“发现贫血16年,生长发育迟缓12年,间断腹胀7年”于2012年2月入院。患者自4岁始出现乏力、食欲不振;8岁起出现生长发育迟缓,青春期无第二性征发育,无月经;13岁后间断发作腹胀、双下肢凹陷性水肿。病程中始终有缺铁性贫血、低清蛋白血症,血色素最低至34 g/L,血清清蛋白最低至13.4 g/L,予补充铁剂、清蛋白及肠内肠外营养治疗。本院胶囊内镜检查提示,全段小肠阶段性跳跃性溃疡,环周溃疡为主,周围黏膜充血水肿,部分黏膜增生呈息肉状,溃疡间小肠黏膜光滑(见图1,本文彩图见本刊官网www.chinagp.net电子期刊相应文章)。胶囊内镜嵌顿于小肠,未进入结肠。后为明确病因,行部分小肠切除术。术中于距盲肠15~230 cm处见回肠肠腔呈阶段性狭窄,并于距盲肠200 cm处肠腔内扪及胶囊内镜。术后大体病理见局部呈瓷白增厚,可见多发溃疡(见图2),镜检提示小肠黏膜慢性炎症,绒毛广泛异常,固有层可见密集淋巴浆细胞浸润,并有淋巴滤泡形成(见图3),肠腔内可见多发浅表溃疡形成,溃疡呈跳跃性分布,溃疡间黏膜未见明显异常,固有层、黏膜层、肌壁间可见较多扩张的淋巴管,考虑诊断为CMUSE合并小肠淋巴管扩张。
2 文献复习
于中国知网、万方数据知识服务平台、维普数据库等中文数据库以“隐源性多灶性溃疡狭窄性小肠炎”“cryptogenic multifocal ulcerous stenosing enteritis”“chronic nonspecific multiple ulcers of the small intestine” 为 检 索 词, 在PubMed数 据 库 以“cryptogenic multifocal ulcerous stenosing enteritis”“chronic nonspecific multiple ulcers of the small intestine”为检索词检索文献,检索时间截至2017年4月,共检索19篇个案报道(中文8篇,英文10篇),包括22例病例,18例为确诊病理,4例为疑诊病例,确诊病例中1例为重复报道,予排除;另本文报道明确诊断1例,共计22例。
另外,PERLEMUTER等[3]曾通过向法国所有公立医院及大学附属医院的消化科以信件咨询的方式收集了12例CMUSE病例,CHUNG等[4]曾收集并分析20例韩国CMUSE患者的临床特点及治疗效果,吴东等[5]报道了北京协和医院确诊的10例CMUSE病例。
2.1 一般资料 22例患者中,男10例(45.5%),女12例(54.5%);年龄4~77岁(中位年龄32岁);自发病至确诊的时间为4个月~27年(中位时间3年)。
2.2 临床表现 腹痛20例(90.9%),腹胀10例(45.5%),恶心、呕吐8例(36.4%),便血、黑便7例(31.8%),体质量减轻5例(22.7%),腹泻4例(18.2%),生长迟缓4例(18.2%),发热3例(13.6%),水肿2例(9.1%)。1例(4.5%)合并雷诺现象、干燥综合征、哮喘、左侧肘关节疼痛,1例(4.5%)合并肠结石,1例(4.5%)合并X连锁网状色素异常综合征。首发症状中,15例(68.2%)为腹痛,4例(18.2%)贫血,2例(9.1%)黑便、便血,2例(9.1%)腹部不适,2例(9.1%)生长迟缓,1例(4.5%)水肿。
2.3 实验室检查 20例检测血常规,血红蛋白(72.0±30.7)g/L,15例为贫血;13例检测血清清蛋白,平均(22.74±9.34)g/L,12例为低清蛋白血症;11例行便隐血试验,均为阳性;14例检测红细胞沉降率为1~144 mm/1 h,其中4例升高;10例检测C反应蛋白(CRP)为1.0~71.7 mg/L,1例升高;2例检测超敏CRP分别为12.2、129.0 mg/L。
2.4 影像学检查 5例行腹部X线检查,4例发现有肠梗阻或不全梗阻征象;10例行腹部CT,8例显示小肠管壁增厚、管腔狭窄;8例行小肠气钡双重对比造影,均可见狭窄、充盈缺损;3例行核医学检查,均可见病变处高代谢灶。
2.5 内镜检查 11例行胃镜检查,3例于十二指肠见典型的浅表溃疡及肠腔狭窄;14例行结肠镜检查,结肠内均未见明显病变,3例于回肠末端见浅表溃疡及肠腔狭窄;9例行胶囊内镜检查,均可见典型的多发浅表溃疡和肠腔狭窄,虽有4例发生嵌顿,但均未引起梗阻症状,2例为手术取出,1例自行排出,最长滞留时间为5个月;11例行小肠镜(9例为双气囊小肠镜,2例为单气囊小肠镜)检查,均可见典型多发浅表溃疡和肠腔狭窄。
2.6 病理检查 1例患者拒绝手术及小肠镜检查,无病理结果,其余21例有病理诊断,其中7例为手术标本,9例为内镜活检标本,5例为手术标本+内镜活检标本。肉眼观,均可见浅表溃疡形成,有环形、条形及斜型溃疡,病变融合处可见地图样溃疡,并可见溃疡性狭窄,最多者可见18处,溃疡间黏膜未见异常。镜检结果均提示黏膜慢性非特异性炎症,病变主要累及黏膜层及黏膜下层(炎性细胞主要有淋巴细胞、浆细胞、嗜酸粒细胞),均未见肌层浸润、肉芽肿形成、血管炎改变;1例黏膜固有层、黏膜下层及肌层可见淋巴管扩张,诊断合并小肠淋巴管扩张;1例合并真性肠结石形成,主要成分为碳酸钙。
2.7 治疗方法与转归 22例患者均接受营养支持治疗,包括输血、补充清蛋白、肠外营养,仅可改善症状;12例行手术治疗,其中5例术后症状改善,7例术后病情复发,最多者接受6次手术。12例接受糖皮质激素治疗,8例出现症状缓解,但3例于激素减量后症状再发;4例激素抵抗患者中,1例使用英夫利昔单抗后症状缓解。另有4例患者单独使用5-氨基水杨酸制剂,无缓解。
3 讨论
CMUSE是一种罕见病,目前全世界仅有60余例报道[1]。其病因和发病机制仍未明确,主要有以下几种假设:(1)该病可能为一种特殊类型的血管炎,PERLEMUTER等[6]认为其本质为补体C2的缺乏造成免疫复合物异常沉积引起的血管炎,其在另一回顾性分析中发现部分患者血管造影和病理提示血管炎改变[3];但本研究未见血管炎证据,该假设需进一步探讨。(2)纤维组织过度增生和胶原蛋白降解受阻导致肠腔狭窄[7]。(3)近年有学者在1例CMUSE患者中发现cPLA2-α基因突变,该基因突变造成了某种磷脂酶合成的减少甚至缺失,影响肠道黏膜的完整性,进而形成溃疡[8-9]。
CMUSE可发生于各年龄段,年龄最小者为1岁,最长者为88岁,多发于中青年[10-11]。首发症状有反复腹痛、腹胀、贫血、生长迟缓、恶心、呕吐、黑便等;常见的肠外表现包括消瘦、发热,偶见多发性关节炎、口腔溃疡、雷诺现象、对称性下肢神经感觉异常、高血压、心房颤动[4]。
该病无特异性的实验室检查,最常见为贫血、低清蛋白血症,便隐血试验持续阳性,CRP、红细胞沉降率基本正常[3-12]。本研究中有3例红细胞沉降率、2例CRP明显升高,但均伴高热,考虑患者合并其他部位感染,与CMUSE病情无关。
腹部X线检查、腹部CT仅可见肠梗阻征象,对该病诊断意义有限。小肠气钡双重对比造影简便易行,是诊断CMUSE的首选检查,典型表现为非对称性、多发肠管僵硬及充盈缺损,肠腔狭窄呈螺旋形分布[11]。本研究中有8例患者行该检查,均可见阳性改变。
近年来,随着双气囊小肠镜及胶囊内镜的发展,小肠疾病的诊断效能得到了提升。CMUSE的内镜下表现主要有多发浅表性溃疡,边缘锐利,形状多样(可见线性溃疡、三角形溃疡、环行溃疡、纵行溃疡,病变融合处可呈地图样),表面覆有薄白苔,伴有数量不等的肠腔狭窄,重者内镜不能通过,溃疡间黏膜表现正常[4,12-14]。两种方法各有优缺点,因双气囊小肠镜可直接观察病变并获取活检组织,其成为该病最有价值的诊断方法[4],但患者痛苦较大,需在全身麻醉下进行,操作难度及风险相对较大;胶囊内镜因其痛苦小、患者依从性较好,但易发生嵌顿[14]。本研究9例采用胶囊内镜的患者中,4例发生嵌顿,最长嵌顿时间为5个月,但均未引起严重的肠梗阻。所以,该病并非胶囊内镜检查的绝对禁忌证。
CMUSE病变主要分布于空肠、回肠,也可见于十二指肠;其病理改变有黏膜多发、浅表性溃疡,累及黏膜层、黏膜下层,黏膜下层因纤维化而增厚,并伴有轻度非特异性炎性浸润,病变处纤维化及炎症超过溃疡边缘;肠腔狭窄的数目不定,肠壁厚度为1~2 cm,表面覆有纤维蛋白及中性粒细胞;未见巨细胞肉芽肿;肠壁肌层及浆膜层正常[3-4,12,14]。
CMUSE的诊断为排他性诊断,需综合临床表现、影像学检查、内镜检查及病理检查等因素后做出诊断,目前无公认的诊断标准。PERLEMUTER等[3]总结如下:(1)不明原因的小肠梗阻;(2)累及黏膜及黏膜下层的浅表性溃疡;(3)慢性或反复发作性溃疡性小肠狭窄,术后易复发;(4)无系统性炎症表现;(5)糖皮质激素治疗有效。
该病主要与以下疾病鉴别:(1)克罗恩病:CMUSE与克罗恩病均可发病于小肠,表现为溃疡性病变,病程反复,两者极易误诊,本研究中即有6例误诊为克罗恩病。不同的是,克罗恩病为透壁性炎症,典型病变为纵行、裂隙状溃疡,易并发瘘管形成、肠穿孔,病理见巨细胞性肉芽肿[3,6];另外,WAKEFIELD等[15]曾提出克罗恩病患者肠管黏膜层可见血管炎。(2)非甾体类抗炎药(NASAIDs)相关性肠病:该病与CMUSE内镜极为相似,均可见表浅溃疡、肠腔狭窄[12],但NASAIDs相关性肠病有长期服药史,停药后可恢复[16]。MATSUMOTO等[13]发现CMUSE的溃疡多处于活动期,而NASAIDs相关性肠病的溃疡多为愈合期,可见CMUSE的黏膜病变为非自限性的,不易愈合,治疗上更为棘手。另外该病还需与肠结核、淋巴瘤、缺血性肠病等相鉴别。
该病暂无对因治疗。目前主要治疗方式有:(1)糖皮质激素:是目前普遍采用的一线治疗药物,但容易引起激素依赖,易复发,且存在激素抵抗;CHUNG等[4]研究显示12例患者采用激素治疗后有效4例;本组12例患者采用激素治疗,8例有效,3例复发,4例激素抵抗。(2)内镜下球囊扩张术:PERLEMUTER等[3]研究中有1例接受球囊扩张术治疗,症状得到缓解,避免了小肠切除术。(3)外科手术:手术切除病变肠管可缓解症状,但术后易复发,反复手术易导致短肠综合征等并发症。(4)营养支持治疗:肠内/肠外营养、要素饮食及补充铁剂可改善营养状态[1]。
另外,DE SCHEPPER等[17]报道1例激素抵抗患者,接受英夫利昔单抗(一种特异性阻断肿瘤坏死因子α的人鼠嵌合型单克隆抗体)治疗后症状获得缓解,复查肠镜见肠腔狭窄消失,病理提示仅有轻度慢性非特异性炎症;文斌[18]研究证实,CMUSE病变组织肿瘤坏死因子α表达较正常组织明显增多,这可能与英夫利昔单抗治疗有效存在相关性,但仍需进一步研究证实。
CMUSE是一种罕见的、病因不明的疾病,小肠多发浅表溃疡和肠腔狭窄是其典型表现,其诊断依靠临床表现、影像学检查、内镜检查及病理检查综合判断,胶囊内镜、双气囊小肠镜是诊断该疾病的重要方法,激素为其一线治疗药物,其他有营养支持、内镜球囊扩张术及外科手术等,英夫利昔单抗等生物制剂的治疗效果有待进一步证实。
作者贡献:李文坤、刘揆亮进行文章的构思与设计;李文坤进行数据收集与整理,撰写论文;刘揆亮、吴静进行论文的修订,负责文章的质量控制及审校;吴静对文章整体负责,监督管理。
本文无利益冲突。

