野大黄含药血清体外抑制猪繁殖与呼吸综合征病毒活性试验
蔡丙严,田其真,刘 莉,郝福星,戴建华
(江苏农牧科技职业学院,泰州 225300)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是一种以种猪繁殖障碍、仔猪和育肥猪呼吸困难为主要特征的具有高度传染性的病毒病[1]。近年来,该病对我国的生猪养殖造成了极大的损失,尤其是病毒容易发生变异[2],现有疫苗毒株较多[3],疫苗免疫尚有争议[4],替米考星、泰万菌素等抗生素在控制猪繁殖与呼吸综合征继发感染中虽然取得一定效果[5,6],但不能全面解决疫病防控中的一些难题。因此,生产中急需找到控制猪繁殖与呼吸综合征感染的药物来防控疫情的发生。中药抗病毒已成为近年来国内外研究的热点,现代中药药理研究结果表明,部分清热解毒功效的中药具有抑制多种病原微生物的作用[7]。孙加节等[8]研究发现,人参多糖在体外可有效阻断或抑制PRRSV对Marc-145细胞的感染;赵昕等[9]研究表明,苦参碱在体外可有效抑制PRRS对Marc-145细胞的感染,在直接杀灭和复制抑制试验中最高抑制率分别达到105.10%、91.53%;刘樱等[10]研究表明,黄芪能对PRRS感染Marc-145细胞提供100%的保护率,板蓝根多糖对细胞保护率能达到48.03%。本项目所选“野大黄”是由中药野拔子、土大黄、癞蛤蟆草、苎麻根等组成的复方,均为清热解毒类中药。野拔子是云南的一种药食同源植物,具有疏风解表、利湿、消食化积的功效,研究表明,其粗提液对枯草芽孢杆菌、大肠杆菌有较好地抑制效果[11]。土大黄为蓼科植物钝叶酸模及羊蹄的根与根茎,其性凉,味辛、苦,具有清热行瘀、杀虫、解毒之功,用于治疗咳血、肺痈、腮腺炎、大便秘结、痈肿毒等[12]。癞蛤蟆草,药名为荔枝草,本品味苦、辛,性凉,归肺、胃、肾经,具有清热解毒利尿消肿、凉血止血等功效[13]。苎麻根是荨麻科苎麻属植物苎麻根茎,具有清热解毒、止血、止痛、利水、消肿、安胎、接骨等功效[14]。上述4种单味中药体外抑制猪繁殖与呼吸综合征病毒活性尚未见报道,依据中兽医对猪繁殖与呼吸综合征的辩证原则,该病属于瘟热病范畴[15]。本试验以野拔子、土大黄、癞蛤蟆草、苎麻根清热解毒的中药科学组方,并饲喂SD大鼠,制备野大黄含药血清,研究其体外抑制猪繁殖与呼吸综合征病毒活性,为寻找治疗猪繁殖与呼吸综合征的高效纯中药制剂提供新思路。
1 材料与方法
1.1 药物与试剂野拔子、土大黄、癞蛤蟆草、苎麻根4种中药,采自云南禄劝彝族苗族自治县海拔1700 m的当地野生药材。利巴韦林注射液购自裕松源药业有限公司,规格0.1 g/L,批号:20170301001,临用前细胞维持液配成 0.05 g/mL。DMEM 培养基(Gibco 公司生产),按说明书配制,加入双抗(各100 IU/mL)再加入犊牛血清,10%浓度为细胞生长液(以下称生长液),5%浓度为维持液(以下称维持液);犊牛血清为杭州四季青公司生产;MTT(四唑溴盐,Sigma公司产品),称取四唑溴盐,用 pH值7.2 的细胞维持液加温搅拌溶解,使终浓度为5 mg/mL,用0.22 μm 混合纤维素酯微孔滤膜过滤除菌,分装后4℃冰箱保存;裂解液二甲亚砜(DMSO),上海国药集团生产。
1.2 毒株猪繁殖与呼吸综合征病毒高致病性毒株PHTZ201606,由江苏农牧科技职业学院猪病检测中心分离鉴定,按Reed-Muench法测得病毒半数组织感染量(TCID50)为10-7.5/0.1mL,按终浓度100 TCID50用量使用。
1.3 Marc-145细胞由江苏农牧科技职业学院江苏省兽用生物制品重点实验室提供,常规传代培养。
1.4 SD大鼠18只SD大鼠,体质量(250±5)g,雌雄各半,由江苏农牧科技职业学院实验动物房提供。
1.5 野大黄中药复方药液制备野大黄由中药野拔子18 g、土大黄14 g、癞蛤蟆草24 g和苎麻根10 g组成复方。称取对应份量的野拔子,加入野拔子总质量4倍的蒸馏水浸泡36 h,使药材充分膨胀后蒸馏2次,收集蒸馏液备用。向蒸馏后的残渣、残夜中加入对应份量的土大黄、癞蛤蟆草、苎麻根3味中药,并添加药材总质量5倍的蒸馏水,浸泡24 h后进行2次煎煮,合并2次煎液加热浓缩至稠状,加质量百分比浓度为95%的乙醇,沉淀48 h后过滤,反复进行2次,滤液加热挥发至无醇味得到滤液,滤液中加入备用的野拔子蒸馏液,调节药液的pH值为7.2~7.4,高压蒸汽灭菌121℃、15 min,冷却后用生理盐水调至其生药含量为2 g/mL,4℃保存备用。
1.6 野大黄与利巴韦林对照品含药血清制备将18只SD大鼠按体质量随机分为野大黄组、利巴韦林对照组、空白对照组,每组6只,雌雄各半,分笼喂养。野大黄组和利巴韦林对照组分别以2、0.025 g/mL的药物浓度灌胃,每天2次,每次1 mL,空白对照组以等体积的生理盐水灌胃,连续给药共3 d。末次给药后1 h腹主动脉无菌采血,血样于无菌离心管中静置2 h以上,待血块收缩良好后,50×g无菌分离血清10 min,经56℃、30 min灭活处理,-20℃冰箱冻存备用。
1.7 含药血清对Marc-145细胞毒性测定取已长满单层Marc-145细胞的96孔培养板,弃生长液,用PBS洗板2次,以不含胎牛血清的DMEM将野大黄、利巴韦林对照含药血清及空白对照组血清均以2 倍浓度梯度稀释为1∶1、1∶2、1∶4、1∶8、1∶16共5 个浓度,分别加至96孔细胞板上,每孔100 uL,每个稀释度做4个重复,同时设细胞对照孔(不加血清,仅加细胞维持液),置37℃、5% CO2恒温培养箱中培养,每日观察细胞生长情况,细胞生长情况判定标准:“-”表示细胞单层、轮廓清晰度完好,细胞折光性良好;“+” 表示细胞单层、轮廓清晰度较好,折光性稍差;“++”表示部分细胞肿胀、变形,单层完整性遭到破坏;“+++”表示细胞大面积肿胀、变形、脱落,折光性差,无完整单层细胞[16]。连续观察72 h,弃培养液上清,每孔加入MTT(终浓度0.5 mg/mL)50 uL,继续培养2 h,弃MTT上清,每孔加入DMSO100 uL,振荡5~10 min,酶标仪测OD492值,计算细胞存活率[17]。细胞存活率=(含药血清各稀释度组平均OD492/正常细胞对照孔平均OD492)×100%。含药血清无毒浓度判定标准为:含药血清各稀释度组与正常细胞对照孔比较,以细胞不出现肿胀、变形、脱落及MTT法测得细胞存活95%以上的最小稀释度为含药血清应用的无毒浓度[18]。
1.8 野大黄含药血清体外抑制猪繁殖与呼吸综合征病毒活性作用将野大黄、利巴韦林对照含药血清及空白对照组血清在最大无毒范围内以无血清DMEM 进行2 倍浓度梯度稀释,最终为1∶4、1∶8、1∶16 3个浓度,分3种加药方式观察野大黄含药血清抑制猪繁殖与呼吸综合征病毒活性。
第1种方式:先加入含药血清,后加入猪繁殖与呼吸综合征病毒,目的是观察含药血清对猪繁殖与呼吸综合征病毒吸附细胞的阻断作用。取已长满单层Marc-145细胞的96孔培养板,先加入野大黄、利巴韦林对照、空白对照各3个浓度的血清,每孔加入100 uL,每份血清平行测定4孔,同时设正常细胞和病毒对照孔,培养2 h,取出细胞板,然后每孔接种100 TCID50猪繁殖与呼吸综合征病毒液100 uL,继续培养,每日观察致细胞病变效应(cytopathic effect,CPE)进展情况。CPE记录标准:“-”为无CPE;“+”为25% 细胞出现CPE;“++”为50% 细胞出现CPE;“+++”为75%细胞出现CPE;“++++”为100%细胞出现CPE[19]。当病毒对照孔出现“+++”以上病变时,弃培养液上清,每孔加入MTT(终浓度0.5 mg/mL)50 uL,继续培养2 h,弃MTT上清,每孔加入DMSO 100 uL,振荡5~10 min,酶标仪测OD492值,计算病毒抑制率。病毒抑制率=(各试验组平均OD492-病毒对照孔平均OD492)/(正常细胞对照孔平均OD492-病毒对照孔平均OD492)×100%。
第2种方式:先加入猪繁殖与呼吸综合征病毒,后加含药血清,目的是观察含药血清对猪繁殖与呼吸综合征病毒增殖的抑制作用。取已长满单层Marc-145细胞的96孔培养板,每孔接种100 TCID50猪繁殖与呼吸综合征病毒液100 uL,置37℃、5%CO2恒温培养箱中培养2 h吸附感染细胞,然后加入野大黄、利巴韦林对照、空白对照各3个浓度的血清,每孔100 uL,每份血清平行测定4孔,同时设正常细胞和病毒对照孔,同第1种方式培养、CPE检查、计算病毒抑制率。
第3种方式:含药血清与猪繁殖与呼吸综合征病毒混合后加入细胞培养板,目的是观察含药血清对猪繁殖与呼吸综合征病毒的直接杀灭作用。取野大黄、利巴韦林对照、空白对照各3个浓度的血清,分别与猪繁殖与呼吸综合征病毒等量混合,置37℃恒温培养箱中培养2 h,将混合液加入已长满单层Marc-145细胞的96孔培养板中,同时设正常细胞和病毒对照孔,同第1种方式培养、CPE检查、计算病毒抑制率。
1.9 数据处理数据以±s表示(均值±标准差),检测结果采用SPSS19.0统计软件进行组间单因素方差分析。
2 结果
2.1 含药血清对Marc-145细胞毒性测定结果由表1可知,野大黄含药血清与空白对照血清在稀释度为1∶4及其以上时,其细胞存活率均达到95%以上,在5个稀释度中,镜检Marc-145细胞单层完好,轮廓清晰,未见细胞肿胀、变形,仅在1∶1和1∶2这2种较低稀释度时,细胞折光性较差,其原因可能是血清中的一些其他成分对细胞的存活有一定影响,与正常细胞对照差异显著(P<0.05)。利巴韦林含药血清在1∶4稀释度时,细胞存活率达到95.05%,但其在1∶1和1∶2这2种较低稀释度时,对Marc-145细胞的生长表现出了一定的毒性,其细胞存活率分别为62.88%、83.26%,镜检Marc-145细胞单层完整性遭到破坏,见有大量细胞肿胀、变形、收缩且与周围细胞分界明显,与正常细胞对照差异显著(P<0.05)。依据细胞不出现肿胀、变形、脱落,细胞存活95% 以上的最小稀释度为血清体外抑制猪繁殖与呼吸综合征病毒的无毒浓度。野大黄含药血清、利巴韦林对照血清及空白对照血清无毒稀释度均选择1∶4。

表1 含药血清对Marc-145细胞毒性测定结果Table 1 Determination of cytotoxicity of drug containing serum on Marc-145 cells
2.2 野大黄含药血清体外抑制猪繁殖与呼吸综合征病毒活性作用结果由表2可知,在第1种加药方式中,与正常细胞对照相比,各浓度含药血清组其OD492均值显著降低(P<0.05);与病毒对照比,各浓度野大黄含药血清组、利巴韦林对照含药血清,其OD492均值显著升高(P<0.05);与各浓度空白对照血清组比,各浓度野大黄含药血清组与利巴韦林对照含药血清组,其OD492显著升高(P<0.05),对猪繁殖与呼吸综合征病毒抑制率明显升高;与各浓度利巴韦林对照含药血清组比,在1∶4 稀释度时,野大黄含药血清组与利巴韦林对照血清组OD492均值差异不显著,但野大黄含药血清组对猪繁殖与呼吸综合征病毒的抑制率为71.16%,大于利巴韦林对照含药血清组的病毒抑制率63.58%,同时,利巴韦林对照含药血清组在1∶4 稀释度时Marc-145细胞已出现约25%的CPE病变;从对猪繁殖与呼吸综合征病毒的抑制率来比较,野大黄含药血清组在1∶8稀释度时病毒抑制最高,为80.77%,而利巴韦林对照含药血清组在1∶16稀释时其病毒抑制最高,为77.44%。综合比较,在第1种加药方式中,即预防性给药时,野大黄含药血清对猪繁殖与呼吸综合征病毒的抑制作用优于利巴韦林含药血清对照组。

表2 第1种给药方式对猪繁殖与呼吸综合征病毒增殖的抑制作用Table 2 Inhibitory effects of first dosing methods on the proliferation of PRRSV
由表3可知,在第2种加药方式中,各浓度含药血清组与正常细胞对照比,其OD492均值均显著降低(P<0.05)。与病毒对照、各浓度空白对照血清组比,各浓度野大黄含药血清组、利巴韦林对照血清,其OD492均值显著升高(P<0.05),对猪繁殖与呼吸综合征病毒抑制率明显升高,这些结果与第1种加药方式相同;与各浓度利巴韦林对照血清组比,野大黄含药血清组在1∶4 稀释度时,对猪繁殖与呼吸综合征病毒的抑制率最高为77.30%,随着稀释度的逐渐升高,其对病毒的抑制率逐渐降低,呈现出典型的量效关系,即病毒抑制率与血清稀释度成反比,在1∶16稀释度时,病毒抑制率为66.60%,且已出现约25%的CPE病变。利巴韦林对照含药血清组在1∶4和1∶8这 2种稀释度时,病毒抑制率分别为78.96%、79.70%,在1∶16稀释度时病毒抑制率下降至70.29%,亦呈现一定的量效关系。综合比较,在第2种加药方式中,即治疗给药时,利巴韦林含药对照血清组对猪繁殖与呼吸综合征病毒的抑制作用优于野大黄含药血清组。
由表4可知,在第3种加药方式中,各浓度含药血清组分别与正常细胞对照、病毒对照相比,各浓度野大黄含药血清组、利巴韦林对照含药血清、各浓度空白对照血清组比与各浓度空白对照血清组比,其OD492均值、对猪繁殖与呼吸综合征病毒抑制率等结果均与第1种加药方式相同。与各浓度利巴韦林对照血清组比,在1∶4 稀释度时,野大黄含药血清组与利巴韦林对照含药血清组OD492均值差异显著(P<0.05),两者对猪繁殖与呼吸综合征病毒抑制率分别为83.51%、73.07%,相差约10%。同时,野大黄含药血清组与利巴韦林对照含药血清组,对猪繁殖与呼吸综合征病毒的抑制率呈现出典型的量效关系,即随稀释度的逐渐升高,病毒抑制率逐渐降低。在1∶16稀释度时,利巴韦林对照含药血清组病毒抑制率为63.55%,已出现约25%的CPE。因此,综合比较,第3种加药方式,即对猪繁殖与呼吸综合征病毒有直接杀灭作用,野大黄含药血清组优于利巴韦林对照含药血清组。
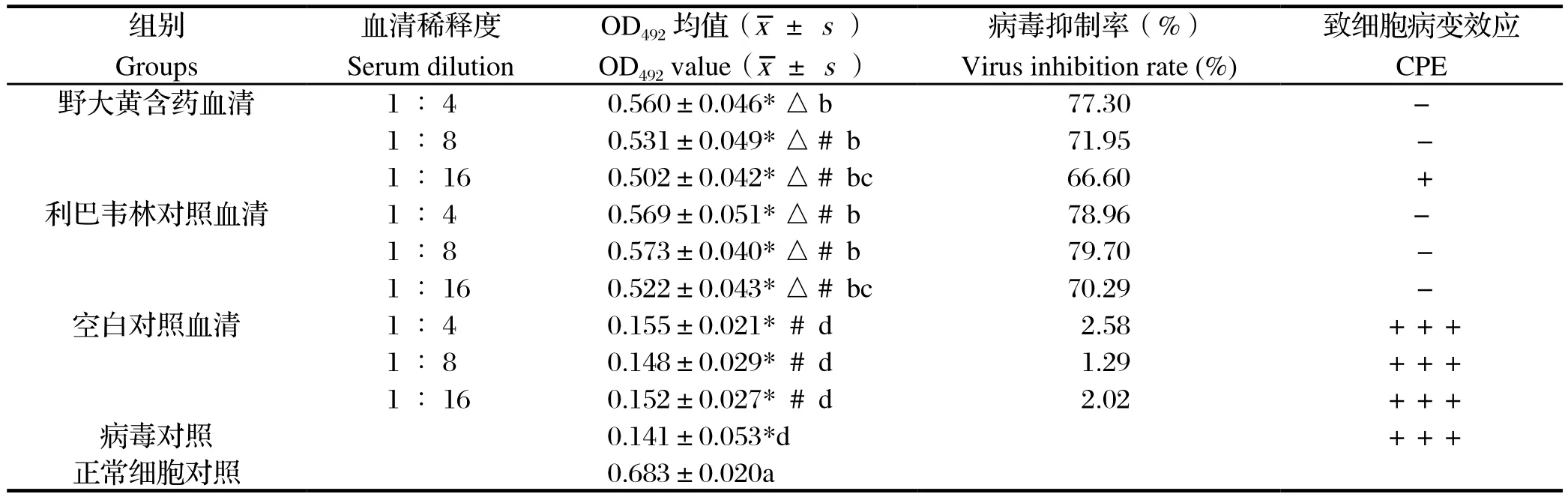
表3 第2种给药方式对猪繁殖与呼吸综合征病毒增殖的抑制作用Table 3 Inhibitory effects of second dosing methods on the proliferation of PRRSV

表4 第3种给药方式对猪繁殖与呼吸综合征病毒增殖的抑制作用Table 4 Inhibitory effects of third dosing methods on the proliferation of PRRSV
3 讨论
中药体外抗病毒研究多以中药提取物直接加入体外培养的细胞中,通过观察中药是否能抑制细胞病变的产生、MTT染色测量吸光值,计算病毒抑制率等综合判定中药体外抗病毒活性[20]。本研究采用将中药提取物饲喂SD大鼠制备含药血清,以血清药理学的方法验证野大黄含药血清体外抗猪繁殖与呼吸综合征病毒的活性。血清药理学方法是将受试药物经口给予动物后,取其血清作为药物源加入离体反应系统中研究其药理作用[21],其优点是克服了以往的离体试验方法中药粗提物对试验结果的干扰,如中药粗提物的pH 值、鞣质、无机物等许多非特异性理化因素,容易造成试验结果的假阳性或假阴性[22]。同时,血清药理试验结果与在体试验有较好的一致性,不仅能反映中药母体药物及其可能的代谢产物的药理作用,而且还能反映可能药物诱导机体内源性成分所产生的作用[23]。中药血清药理在医学研究中报道较多,如彭志等采用观察CPE 及MTT 法,观察了银黄清肺胶囊含药血清体外抗呼吸道合胞病毒作用[24]。本试验选取4味中药野拔子、土大黄、癞蛤蟆草、苎麻根组方为野大黄,制备含药血清,方中各单味药以血清药理的方法体外抗猪繁殖与呼吸综合征病毒活性在兽医研究中尚属首次报道。
中药提取物体外抗病毒作用机制的研究,通常以中药提取物抑制病毒吸附、抑制病毒复制、直接杀灭病毒3个方面进行阐述,落实到具体的体外抗病毒试验中是分3种加药方式观察抗病毒活性。多数研究报道表明,中药提取物的体外抗病毒作用机理是能较好地抑制病毒吸附和直接杀灭病毒作用[25],而不具备抑制病毒复制作用或作用相对较差[26]。本研究结果表明,野大黄含药血清在3种给药方式中,以含药血清与猪繁殖与呼吸综合征病毒混合后直接加入Marc-145细胞,其病毒抑制率最高,其次是先加入含药血清后加入病毒,再次是先加入病毒后加入含药血清,其病毒抑制率分别为83.51%、80.77%、77.30%,说明野大黄含药血清能直接杀灭猪繁殖与呼吸综合征病毒,同时,其能阻断猪繁殖与呼吸综合征病毒对Marc-145细胞的吸附与侵入,但对进入细胞内的猪繁殖与呼吸综合征病毒抑制其脱壳、生物合成及释放作用相对较差,该研究结果与多数研究结果相一致[27]。中药无论是单体还是复方提取物,均有多种成分,这些化学成分的作用并非简单的叠加,而是相互影响、弥补,通过多层次,多个作用途径,多靶点和机理发挥综合作用[28],因此野大黄含药血清的确切抗病毒机制有待进一步研究。
猪繁殖与呼吸综合征是我国也是国际养猪业在今后相当长一段时间内面临的一个难题。其致病机理、新型疫苗研发及综合防控研究是当今科技工作者研究的热点,伴随无抗养殖的需求,研发新型、高效治疗猪繁殖与呼吸综合征的药物,减少养猪业的经济损失是当前亟待解决的课题。本研究发现野大黄含药血清体外具有显著杀灭猪繁殖与呼吸综合征病毒活性,该发现丰富了野大黄中药复方中野拔子、土大黄、癞蛤蟆草、苎麻根等的临床药理研究资料,也为猪繁殖与呼吸综合征的治疗提供了新的思路,为后续研发新型抗猪繁殖与呼吸综合征纯中药制剂奠定基础。
野大黄含药血清体外具有显著的抑制猪繁殖与呼吸综合征病毒活性,以同时给药时具有直接杀灭猪繁殖与呼吸综合征病毒作用,在1∶4 稀释度时,野大黄含药血清对猪繁殖与呼吸综合征病毒抑制率为83.51%,有望作为抗猪繁殖与呼吸综合征病毒药物进行开发。

