复元醒脑汤对糖尿病脑梗死大鼠BMECs的影响及miRNA-320的调控机制研究*
沈俊逸,赵智明,刘春丽,壮雨雯,徐文俊,蔡 辉
(中国人民解放军东部战区总医院中西医结合科,南京 210002)
糖尿病并发脑梗死是多因素、多途径、多方式共同作用的结果[1-2]。近年来,多项研究显示在糖尿病脑梗死的缺血区可以观察到血管新生现象,以毛细血管密度增高、微血管形成和侧枝循环建立为主要表现,这些新生血管有助于神经缺损功能的修复[3]。糖尿病脑梗死后,基质细胞衍生因子-1(SDF-1)和CXC趋化因子受体4(CXCR4)下调,造成内皮祖细胞(EPCs)的数量减少,黏附、迁移功能的下降,复元醒脑汤能够有效地促进缺血脑组织血管内皮生长因子(VEGF)的表达,同时增强了EPCs增殖、黏附和迁移的功能[4]。阻断SDF-1/CXCR4轴信号通路后,梗死组织还有部分血管新生,说明可能有其他机制参与了糖尿病脑梗死后的血管新生。Wang等[5]研究结果显示在糖尿病大鼠中微小RNA-320(miRNA-320)的表达升高。将miRNA-320的类似物转染至糖尿病心肌微血管内皮细胞中,细胞的增殖和迁移就会受到抑制;如果转染miRNA-320的抑制剂则会出现相反的结果,细胞的增殖和迁移能力增强,胰岛素样生长因子-1(IGF-1)的表达上调,从而促进了血管新生[6-8]。miRNA-320负性调控IGF-1及其胰岛素样生长因子-1受体(IGF-1R),对糖尿病诱发的血管病变有重要影响[9-11]。因此,课题组推测复元醒脑汤对糖尿病脑梗死的作用机制可能与miRNA-320基因表达调控因子促进缺血脑组织的血运重建有着重要联系。本研究以脑皮质微血管内皮细胞(BMECs)为研究对象,观察miRNA-320基因表达及其基因沉默后的变化,以及复元醒脑汤对其干预前后的变化,以期阐述复元醒脑汤促进糖尿病脑梗死缺血脑组织区域血运重建的分子机制。
1 材料和方法
1.1 主要实验材料
1.1.1 实验动物 20只健康雄性SD大鼠,体质量(250±25)g,购自上海SLAC实验动物有限公司[动物合格证:SCXK(沪)2011-009]。
1.1.2 实验药物 复元醒脑汤[人参10 g(单煎),三七 10 g,石菖蒲 12 g,水蛭 10 g,益母草 30 g,生天南星 15 g,制大黄 9 g(后下),浓度 388 g/L]由南京军区南京总医院药剂科制备。
1.1.3 主要试剂及仪器 胎牛血清(FBS),青霉素和链霉素溶液(P/S)和DMEM/F12培养基购买于法国Biosera公司;血管内皮细胞培养基(ECM)购买于美国ScienCell公司;RNA抽提试剂,反转录试剂盒和SYBR green实时荧光定量PCR试剂盒购自日本 Takara 公司;MiR control inhibitor,LipofectamineTMRNAi MAX Transfection Reagent、rno-miRNA-320 inhibitor购买于Thermo公司;链脲佐菌素(STZ)、MTS、结晶紫 和Ⅱ型胶原酶(Type2 Collagenase)购买于美国Sigma公司,Ⅷ因子相关抗原(vwF)抗体购于美国Abcam公司;基质胶Matrigel购买于美国Gibco公司。酶标仪(美国Thermo公司,Multiskan MK3型),实时荧光定量PCR仪(美国Bio-Rad公司,CFX 96型),CO2细胞培养箱(日本三洋,MCO-18AC)。
1.2 BMECs的分离 根据文献[12]复制糖尿病脑梗死大鼠模型,注射STZ制备糖尿病大鼠模型,线栓法制备脑梗死模型,依照Berderson评分(≥1)[13]确定造模成功。成模后,用10%的水合氯醛(1 mL/kg)腹腔注射麻醉大鼠后,再脱颈处死大鼠。用75%乙醇消毒大鼠,迅速断头取出完整的脑组织,放到预冷的磷酸缓冲盐溶液(PBS)中进行漂洗,将大脑皮质组织剪成1 mm3的小块,放入1 mL DMEM/F12培养液。离心收集组织,将组织加入到0.1%的Ⅱ型胶原酶,于37℃水浴消化40 min,离心8 min(1 000 r/min),去除上清,加入20%FBS悬浮中和,离心(1 000 r/min)20 min,去除神经和血管组织,收集沉淀。继续将2 mL的Ⅱ型胶原酶悬浮沉淀,于37℃进行水浴消化,离心 8 min(1 000 r/min),去上清后用 20%FBS混匀,进行离心(1 000 r/min)20 min,底部沉淀为微红色的微血管段。
1.3 BMECs的培养和鉴定 用ECM培养基(ECM+10%FBS+1%P/S)混悬细胞,接种于10 cm细胞培养皿,培养过夜,于倒置显微镜下拍照记录细胞形态。将2×105细胞接种到24孔板,培养3 d,用PBS漂洗细胞,加入4%的多聚甲醛固定细胞10 min,37℃用抗体 vwF 孵育细胞(1∶200)30 min,用 PBST 漂洗细胞3次,用细胞核染料DPAI染细胞核,并在倒置荧光显微镜下拍照。
1.4 对照血清和含药血清的制备 取健康雄性SD大鼠20只,按照随机数字表法随机分为2组,每组10只,SPF级饲养。一组常规饲养,另一组常规饲养的基础上以复元醒脑汤灌胃,根据临床经验每日2次按10.4 g/kg体质量给以复元醒脑汤灌胃(参照陈奇主编《中药药理实验方法学》依实验动物与人体表面积比计算),连续3 d。于末次给药1 h后腹主动脉采血,制备对照血清和含药血清。腹主动脉采血后,血样室温放置1 h,离心,无菌分离并混合血清,56℃水浴中灭活补体30 min,-20℃冰箱冻存备用。
1.5 BMECs转染miRNAinhibitor 当培养的BMECs达到60%~80%贴壁后,以3×105个/孔铺于6孔板,一半给予对照血清(5%)处理,一半给予含药血清(5%)处理,培养24 h后用Lipofect RNAi MAX试剂盒分别转染 miRNA inhibitor control、rno-miRNA-320inhibitor40pmol。共分为4个实验组:对照血清+control inhibitor组,对照血清+miRNA-320inhibitor组,含药血清+controlinhibitor组,含药血清+miRNA-320 inhibitor组。
1.6 BMECs细胞的增殖能力测定 miRNA转染24h后的BMECs细胞,用胰酶消化离心(1000r/min,5 min)收集细胞,接种入 96孔板(3×103/孔)。于第1、2、3、4、5 天用甲臜化合物(MTS)检测细胞活性:每孔中加入 20 μL MTS,37 ℃、5%CO2恒温培养箱中孵育1 h后,用酶标仪检测490 nm处的吸光度值。
1.7 BMECs细胞的迁移能力测定 miRNA-320转染BMECs 24 h后,用胰酶消化细胞,将1×106个细胞接种到24孔的Transwell小室的上室中(孔径8 μm),在下室中加入 500 μL 的 ECM 培养基(含有空白大鼠血清和中药大鼠血清)。24 h后,将上室取出,用4%的多聚甲醛固定细胞,用0.1%的结晶紫染色,小室的上室用棉签擦拭干净,在倒置显微镜下拍照观察细胞迁移。拍照结束后用10%的醋酸洗脱结晶紫,将洗脱后的液体收集在酶标仪下检测吸光值(560 nm)。
1.8 BMECs细胞的小管形成能力测定 将100 μL Matrigel均匀涂抹到24孔板中,37℃放置30 min,待凝固,加入 500 μL 的细胞悬液(1×106),然后24孔板放置到37℃、5%CO2培养箱12 h,拍照观察成管能力。
1.9 BMECs miRNA-320、IGF-1 和 IGF-1R mRNA基因表达水平检测 BMECs细胞转染miRNAinhibitor control和rno-miRNA-320 inhibitor,并分别用空白血清和中药血清处理培养48 h后,收集的BMECs细胞样本,抽提RNA,并反转录为cDNA,采用实时荧光定量 PCR(qPCR)检测 miRNA-320、IGF-1、IGF-1 R的基因表达,以U6作为miRNA内参,GAPDH作为mRNA内参。引物序列如下:MiR-320-F ACACTCCAGCTGGGACTTAAACGTGGTTGTAC;MiR-320-R TGTCGTGGAGTCG GCAATTC;U6-F GCTTCGGCAGCACATATACTAAAAT;U6-RCGCTTCAC GAATTTGCGTGTCAT;IGF-1-F ACTCGATAACTTTGCCAGAAGAG;IGF-1-RTTCTTGTGTGTCGATAGGGGC;IGFR-F TAGTGGGT GTGTTGCCACC;IGFRR TCCACCGTGTTGCAAGA CTAG;GAPDH-F ACTTTGGCATCGTGGAAGGG;GAPDH-R TGCAGGGATGATGTTCTGGG。
1.10 统计学方法 所有实验数据采用GraphPad软件进行统计学分析,计量资料以均数±标准差(x±s)表示,P<0.05为差异具有统计学意义。
2 实验结果
2.1 BMECs的鉴定 白光下分离培养的BMECs细胞形态呈短梭形,见图1A。Ⅷ因子为BMECs的标志性蛋白,DAPI为核酸染料用于指示细胞核,见图1B,用免疫荧光的方法检测BMECs发现细胞浆及细胞核周围具有绿色荧光,见图1C,免疫荧光(vwF)鉴定结果显示分离的细胞为阳性的BMECs,而且纯度高,见图1D。

图1 分离培养的BMECs细胞形态和Ⅷ因子免疫荧光Fig.1 BMECs morphology and factorⅧimmunofluorescence
2.2 miRNA-320 inhibitor显著抑制miRNA-320的表达 BMECs转染miRNA inhibitor control和rnomiRNA-320 inhibitor 48 h后,收取细胞,抽提RNA,反转录,做qPCR检测miRNA-320的表达,用U6作为内参,验证miRNA inhibitor的效率。结果显示miRNA-320 inhibitor的相对基因表达量 (0.19±0.03)可以显著抑制miRNA-320的相对基因表达(miRNA control为 1.02±0.14,P<0.01)。抑制效果可以达到80%以上。
2.3 BMECs细胞的增殖能力 BMECs细胞转染miRNA control inhibitor和rno-miRNA-320 inhibitor 24 h 后,于第 1、2、3、4、5 天分别用 MTS 法做细胞增殖实验。如图2所示,与对照血清+control inhibitor组相比,对照血清+miRNA-320 inhibitor组、含药血清+control inhibitor组、含药血清+miRNA-320 inhibitor组 BMECs的细胞增殖能力都显著增强(P<0.01)。从培养的第2天开始,BMECs的细胞增殖能力出现显著差异,可见含药血清和miRNA-320抑制剂都可以促进BMECs的细胞增殖,从培养的第3天开始,中药血清促进BMECs增殖能力与miRNA-320抑制剂相当,在含药血清和miRNA-320抑制剂的双重作用下,BMECs的增殖最为明显。
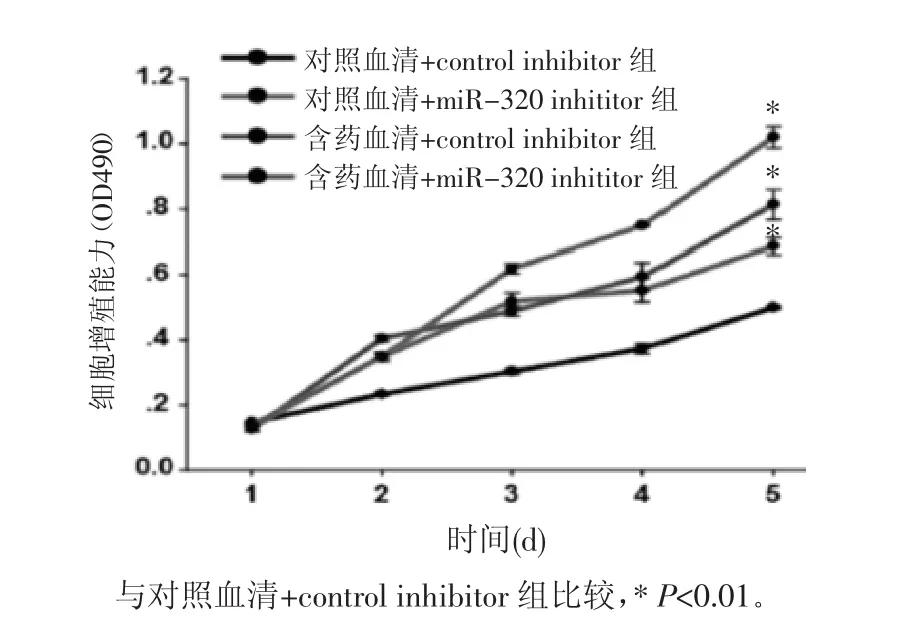
图2 各组BMECs细胞的增殖能力Fig.2 Proliferative capacity of BMECs cells in each group
2.4 BMECs细胞的迁移能力 见图3和表1。与对照血清+control inhibitor组相比,对照血清+miRNA-320 inhibitor组、含药血清+control组和含药血清+miRNA-320 inhibitor BMECs的细胞迁移能力具有显著差异(P<0.01),可见含药血清和抑制 miRNA-320都可以促进BMECs的细胞迁移,miRNA-320抑制剂促进BMECs迁移的能力与中药血清相类似,没有统计学差异,在中药血清和miRNA-320抑制剂的双重作用下,BMECs的迁移能力增加更明显。
2.5 BMECs细胞的小管形成能力 取处于对数生长期的BMECs细胞进行小管形成能力的测定。对照血清+control inhibitor组的成管能力最弱。含药血清和miRNA-320 inhibitor对成管都有一定的促进作用,但含药血清+miRNA-320 inhibitor组促进成管能力最强。见图4。说明复元醒脑汤和miRNA-320抑制剂均可以通过促进小管形成修复糖尿病脑梗死的血管损伤。
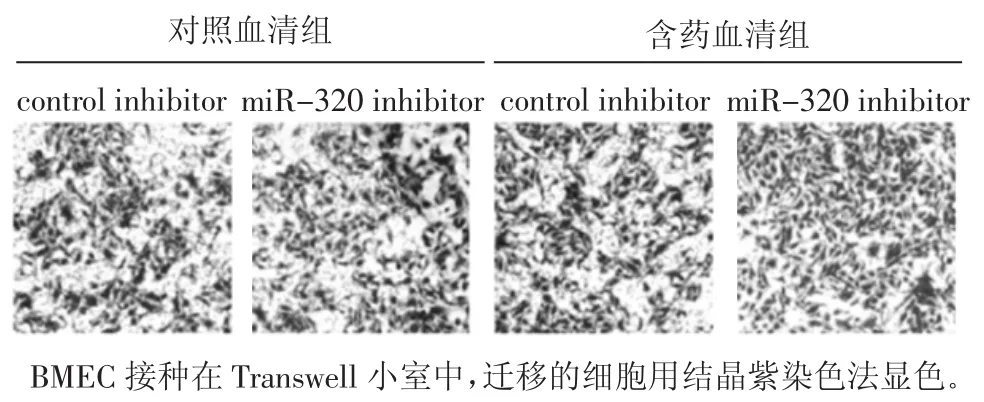
图3 含药血清对BMEC迁移能力的影响(×200)Fig.3 Effect of serum containing traditional Chinese medicine on the BMEC mobility(×200)
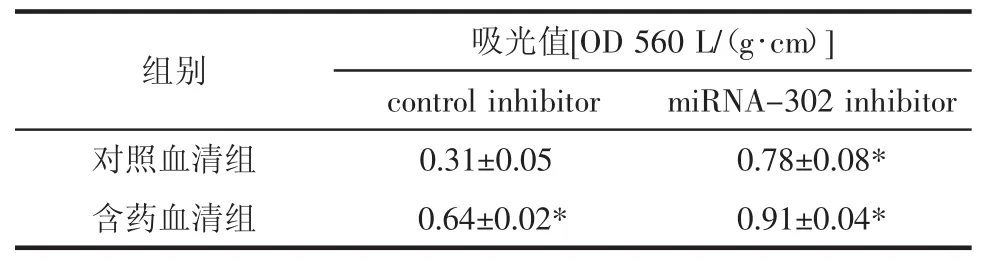
表1 酶标仪检测含药血清对BMEC迁移能力的影响Tab.1 The effect of serum containing traditional Chinese medicine on the migration of BMEC was detected by enzyme labeling apparatus
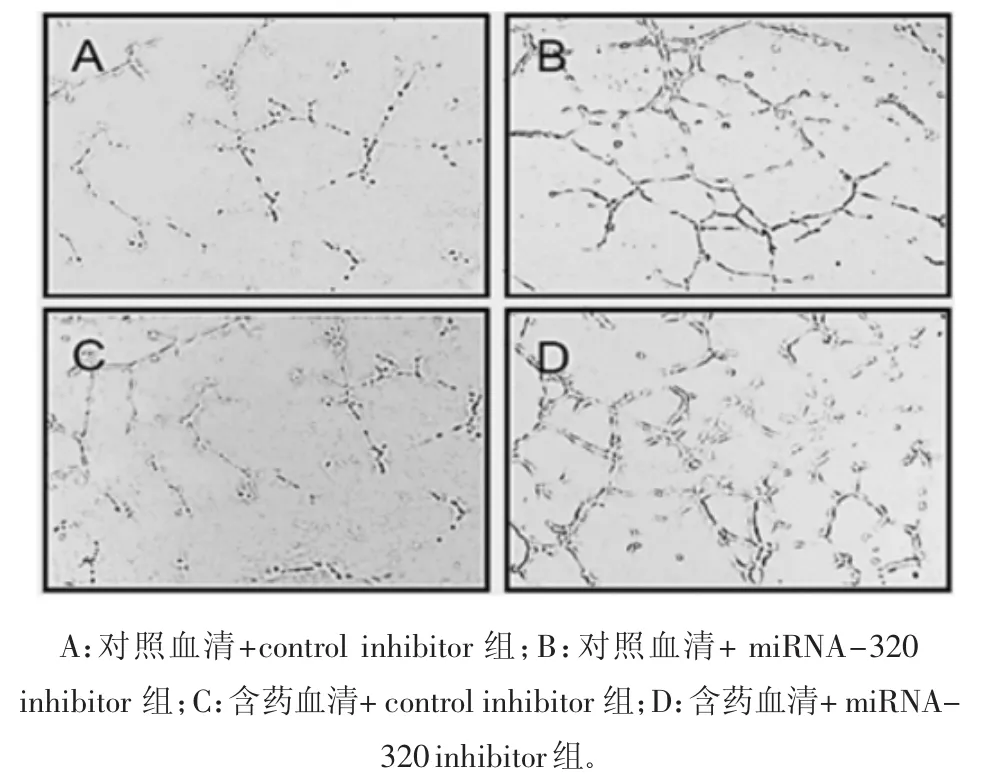
图4 各组BMECs细胞的成管能力(×40)Fig.4 Tube forming ability of BMECs cells in each group(×40)
2.6 各组BMECs miRNA-320、IGF-1、IGF-1R基因表达水平 如表2所示,与对照血清+control inhibitor组比较,对照血清+miRNA-320 inhibitor组、含药血清+control inhibitor组和含药血清+miRNA-320 inhibitor组的miRNA-320和IGF-1的基因表达水平均有统计学差异(P<0.01)。可见含药血清和抑制miRNA-320都可以抑制miRNA-320的基因表达,并促进IGF-1的基因表达,其中miRNA-320抑制剂的作用强于含药血清。各组IGF-1R 基因的表达无统计学差异(P>0.05)。

表2 各组BMECs miRNA-320、IGF-1、IGF-1R基因表达水平Tab.2 Expression levels of microRNA-320,IGF-1 and IGFR of BMECs in each group
3 讨论
糖尿病脑梗死发生后miRNA-320的表达升高,miRNA-320作为IGF-1的负性调节因子,会降低IGF-1的表达[14-16]。脑缺血发生后,IGF-1及IGF-1R持续内源性消耗,合成减少,IGF-1及其IGF-1R表达下降,血管新生能力受到抑制。同时由于缺血神经组织处于缺氧状态,会诱发神经组织的凋亡和坏死,IGF-1作为一种神经保护和促进神经再生因子,可以促进神经功能的恢复,同时可以降低神经细胞的凋亡,而IGF-1的缺乏会使神经组织失去自我保护和修复的能力[17-18]。本研究发现复元醒脑汤可以促进BMECs的增殖、迁移及成管能力。BMECS的数量增加和功能增强一方面为脑部神经组织提供了大量的氧气和营养的供应,同时改善了梗死脑组织内血管内皮细胞与神经元的损害,促进血运重建,有助于神经缺损功能的恢复。
复元醒脑汤能够发挥良好作用主要是因为其方剂配伍符合中医的诊治思想。中医认为糖尿病属于“消渴”,脑梗死为“中风”。“消渴”以燥热为标,“中风”是经络瘀血、肝脏和肾脏阴虚以及气血阻滞造成。治疗糖尿病脑梗死要坚持扶正元气,化痰祛瘀、息风泄热、醒脑开窍[19-20]。复元醒脑汤方剂由人参、生天南星、石菖蒲、三七、水蛭、益母草、大黄组成,有很好的临床疗效。人参为君补元气;石菖蒲和生天南星的作用是豁痰泻浊开窍,水蛭、三七和益母草用于活血化瘀;大黄具有息风泄热功效。本研究从miRNA-320负性调控IGF-1的表达方向对复元醒脑汤促进糖尿病脑梗死缺血脑组织血运重建的分子机制和作用靶点进行了深入探索,丰富和发展了复元醒脑汤的作用机制。

