苏州市患病水生动物体内细菌的分离鉴定及药敏试验
冯永杰,孙振丽,宣引明,蒋 明,潘云生,张益明,龚叶平,薛仁宇,胡小龙,曹广力,贡成良
(1.苏州大学基础医学与生物科学学院,江苏苏州 215123;2.昆山市水产技术推广站,江苏苏州 215300)
鱼类的细菌性疾病是一类严重危害鱼类健康的疾病,常造成水产养殖的严重损失,很多疾病的爆发能引起水生动物大面积的死亡。目前,发现的主要细菌性疾病有淡水鱼出血性败血症、溃疡病、烂鳃病、爱德华氏病等。水产养殖对象感染水生动物的细菌种类很多,不同细菌感染往往使患病鱼呈现不同的症状,生产上的细菌性疾病往往表现出一病多症、一症多病,从而给细菌性疾病的防治带来了极大的困难。
抗生素对水生动物细菌性疾病有良好的防治效果,自1945年磺胺药成功应用于治疗鳟疖疮以来,土霉素、卡那霉素、氨苄青霉素、金霉素、强力霉素、恩诺沙星、呋喃唑酮、恶喹酸、四环素、新霉素等相继在水产养殖中应用[1]。不同的细菌对不同的抗生素敏感性存在很大差异,由于生产上对细菌性病原没有进行分离、鉴定,也没有进行药敏试验,随意选择抗生素进行治疗往往导致防治效果很不理想。近年来,随着抗菌药物的广泛使用,细菌的耐药性也不断增强[2-3],耐药菌,尤其是多重耐药菌的不断增加[4],给水生生物的细菌病的治疗带来极大的困难。
为了解苏州市不同地区水生动物中致病菌的种类及耐药性,指导生产上科学合理使用抗生素,我们对2014年6-10月从不同地区采集的患病中华鳖、虾、河蟹及鱼中分离的细菌通过16S rRNA基因序列对分离菌进行了鉴定,并在此基础上,对分离菌进行了药敏试验,以此探明不同细菌对抗生素的敏感性是否存在明显差异,为科学用药提供方向。
1 材料与方法
1.1 病样采集
2014年6月15日于苏州市吴江区金家坝镇采集的患病南美白对虾(Cyprinuscarpio);6月19日于苏州常熟市采集的患病锦鲤(夏花)和草鱼(Ctenopharyngodonidellus);7月1日于苏州吴中区采集的患病异育银鲫(Carassiusaumtusgibelio);7月11日、9月9日在苏州昆山市张浦镇采集的患病中华鳖(Pelodiscussinensis);9月28日于昆山淀山湖镇采集的患病异育银鲫、周市镇采集的青鱼、千灯镇采集的患病河蟹(Eriocheirsinensis);10月22日于昆山淀山湖镇采集的鳙(Aristichthysnobilis)。所有采集的患病水生动物均存活,且有明显的症状。
1.2 细菌分离
首先对采集患病水生动物用75%的酒精体表消毒,在超净工作台中无菌解剖,取小块肝脏或肝胰腺移入LB液体培养基,37 ℃震荡培养12 h,取50 μL菌液用无菌水稀释适当倍数后均匀涂布到LB固体培养基中,37 ℃培养12 h,挑取单菌落在新LB固体培养基中划线纯化培养,37 ℃培养12 h,挑取单菌落接种LB液体培养基,37 ℃震荡培养12 h。
1.3 细菌基因组抽提、16S rRNA基因克隆与测序
取新鲜菌液50 μL,煮沸5 min,12 000 r/min离心2 min,取上清液用作模板,用16S rRNA基因的通用引物27F(5′-agagtttgatcctggctcag-3′)/1492R(5′-tacggttaccttgttacgactt-3′)进行PCR扩增。扩增产物经1%琼脂糖凝胶电泳后,用DNA凝胶回收试剂盒(AXYGEN公司)回收特异性扩增产物。回收产物连接到pMD18-T载体(TaKaRa公司)后,转化大肠杆菌TG1感受态细胞,挑取单菌落,用质粒抽提试剂盒(AXYGEN公司)抽提质粒,酶切鉴定,取阳性克隆送上海生工生物工程有限公司测序。
1.4 细菌鉴定
将测序获得的16S rRNA基因序列用在线Blast程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源搜寻,根据所测序列与GenBank中已公开的细菌16S rRNA基因序列的相似性确定所分离细菌的分类地位。
1.5 药敏试验
1.5.1 纸片扩散法
取200 μL菌液(浓度为108cfu/mL)均匀涂布到LB固体培养基,然后用无菌镊子将分别加有10 μL(10 mg/mL)的链霉素、恩诺沙星、强力霉素、庆大霉素硫酸盐、甲砜霉素的滤纸片(直径6 mm)紧贴在培养基表面,于37 ℃恒温培养12 h,测量各药敏纸片的抑菌圈直径,同设无菌水对照。
1.5.2 倍比稀释法
将12支无菌薄壁透明EP管排列一排,依次编号,向第1管加入1 mL LB培养基,其余管各加0.5 mL培养基,然后向第1管中加5 μL(25 mg/mL)抗生素混匀,从中取0.5 mL加到第2管中,混匀后取0.5 mL加到第3管中,依次倍比稀释到第11管;从第11管中吸出0.5 mL弃去,第12管不加抗生素作对照。向12支EP管中各加2 μL浓度为108cfu/mL的细菌悬液。37 ℃培养12 h,观察结果。将未观察到待检菌繁殖的最低药物浓度定义为最低抑菌浓度。
1.5.3 细菌耐药情况判定
参考动物源细菌药敏试验标准(CLSI,2013),分别以敏、中敏和耐药三种形式对细菌的MIC进行统计分析。
1.6 分离菌中的质粒抽提与电泳检测
取1.5 mL新鲜液体培养的细菌悬液,按质粒抽提试剂盒(AXYGEN公司)说明书提取各分离细菌的质粒,用1%琼脂糖凝胶电泳检测。回收具有多重抗性的细菌的高拷贝质粒,转化大肠杆菌TG1,涂到带有氨苄青霉素(0.1 mg/mL)的LB固体培养基中,37 ℃培养12 h,观察转化结果,并进一步从转化子中抽提质粒进行琼脂糖凝胶电泳检测。
2 结果与分析
2.1 患病水生动物的症状
患病的南美白对虾肝胰脏颜色变深,溃烂,体色失去原有的淡青色;患病锦鲤的皮肤发炎充血,在水中打圈游动;患病的草鱼、青鱼和鲫都有体表充血、鳍基充血的症状;患病的中华鳖行动缓慢;患病白鲢的体表充血,脱鳞,鳍基充血。
2.2 基于16S rRNA基因序列的分离细菌的鉴定
分离到的14种菌的16S rRNA基因序列在GenBank上的登录号及与相应菌的16S rRNA基因序列的同源性如表1所示。

表1 不同患病水生动物中分离细菌的基本信息Tab.1 Basic information of bacteria isolated from aquatic animals with different diseases
注: 4,5,6,7,8号,分离于同一条鱼体内;11,12,14号分离于同一地区的不同品种鱼体内。
2.3 分离菌药敏试验
2.3.1 纸片扩散法药敏试验结果
选择了链霉素、恩诺沙星、强力霉素、庆大霉素硫酸盐、甲砜霉素的药敏纸片对各分离菌进行了抗生素的敏感性试验(表2)。结果显示,不同分离细菌对不同抗生素的敏感程度有很大差异,来源不同的同种细菌对某些抗生素的敏感程度也存在一定差异。来源吴中区的4号菌(A.veronii)对庆大霉素的敏感程度高于来源昆山市淀山湖镇的11、12和14号同种细菌(A.veronii),也高于来源同条鱼体内的另一种A.veronii即5号菌,而对恩诺沙星的敏感性低于5、11、14号菌。9号菌为嗜水气单胞菌,10号菌为摩根氏菌属均从中华鳖中分离获得,9、10号菌对6种抗生素均表现出较强的的耐药性。
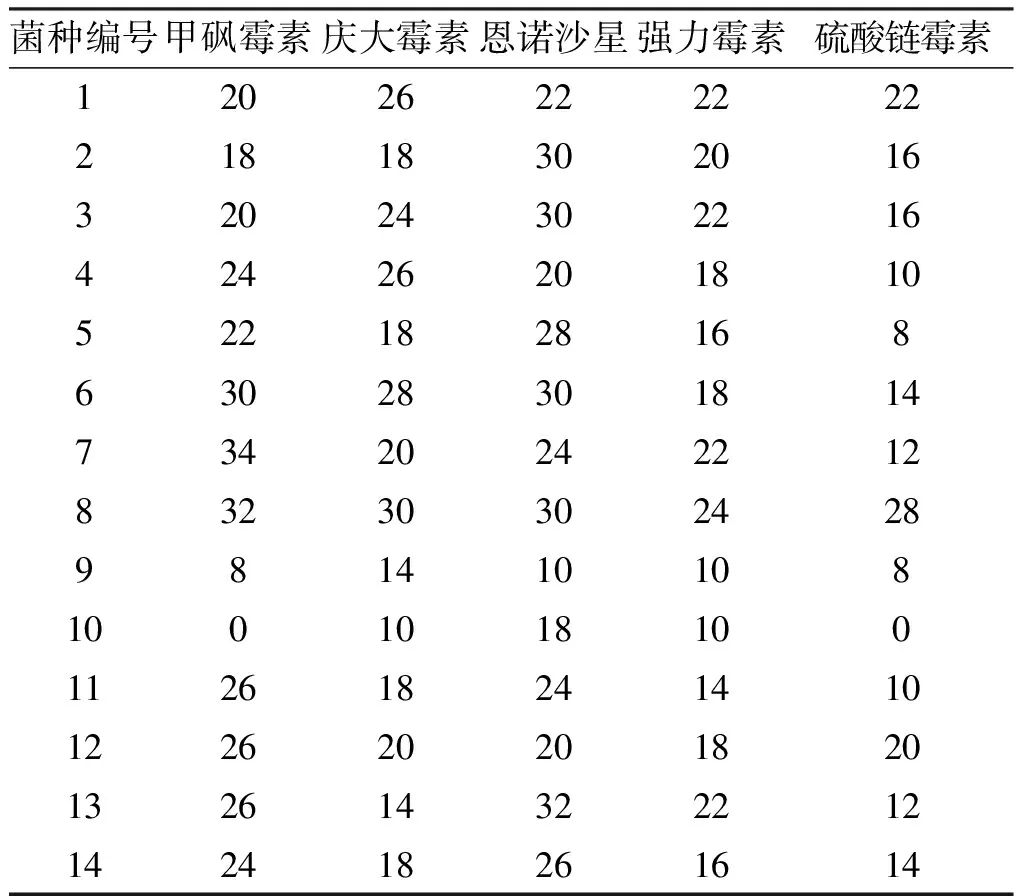
表2 分离细菌对抗生素的纸片的抑菌圈直径Tab.2 Results of the disk diffusion test for the isolated bacteria against antibiotics mm
注:滤纸片的直径:6 mm,每片滤纸抗生素的含量为100 μg;1~14号细菌名称对应于表1。
2.3.2 最低抑菌浓度测定结果
最低抑菌浓度测定结果显示,最低抑菌浓度因抗生素种类和分离菌的不同而有很大差异(表3),该结果所反映的各分离菌的耐药性与纸片扩散法药敏试验的结果基本一致。硫酸链霉素对各分离菌的最低抑菌浓度均较高,说明硫酸链霉素不适宜用于水生动物细菌性疾病的防治;试验中所选择的抗生素对嗜水气单胞菌(9号菌)、摩根氏菌属(10号菌)的最低抑菌浓度均较高,说明这2种菌具有较强的多重耐药性;4、5号菌为同一条鱼中分离到的维氏气单胞菌,庆大霉素对5号菌的最低抑菌浓度比4号菌的高64倍,而恩诺沙星对5号菌的最低抑菌浓度是4号菌的1/64;而来自同一地区不同病鱼体中分离的同种细菌(11、12、14号菌)对抗生素的敏感性也存在一定的差异。

表3 不同抗生素对分离菌的最低抑菌浓度Tab.3 The minimum inhibitory concentration of different antibiotics to the isolated bacteria μg/mL
注“1~14号细菌名称对应于表1。s:高敏,s-:中敏,r:耐药。
14种细菌对5种抗生素的耐药情况见表3。结果显示:所有细菌对硫酸链霉素均表现为耐药,9号菌为嗜水气单胞菌,10号菌为摩根氏菌属均从中华鳖中分离获得,除9号菌对庆大霉素表现为高敏外,9号10号菌对其它抗生素均表现为耐药。5种维氏气单胞菌A.veronii(4、5、11、12和14号)对甲砜霉素、强力霉素均表现为高敏,5、12、14号菌对庆大霉素中敏,4号菌对庆大霉素高敏;5、11号菌对恩诺沙星表现为高敏,14号菌对恩诺沙星表现为中敏,4、12号菌对其耐药。1号菌(不动杆菌属)对恩诺沙星中敏,2、3号菌(黄杆菌属)对试验选择的抗生素(除硫酸链霉素)均为高敏;除硫酸链霉素外,6号菌(弧菌)和7号菌(弧菌)对所试验的抗生素均表现出高敏,8号菌(希瓦氏菌属)和 13号菌(A.enteropelogenes)对所试验的抗生素也均表现出高敏。
2.4 质粒检测
2.4.1 质粒抽提
对分离菌进行了质粒抽提和电泳检测,结果显示(图3,表5),1、2、5、8~12菌中明显存在质粒,其中1和10号菌可能存在分子量不同的多种质粒;同一种细菌中不同的分离株之间所含质粒的情况存在不同,例如同属于A.veronii的4、5、11、12、14号菌,5、11、12号菌可明显检测到质粒,而4、14号菌则几乎没有检测到。2株耐药性较强的9号菌(嗜水气单胞菌属)和10号菌(摩根氏菌属)均明显存在质粒。
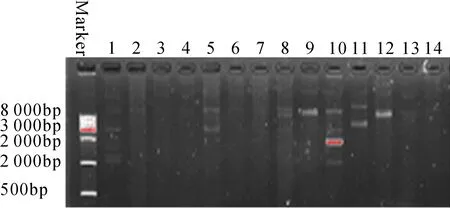
图3 不同分离菌来源的质粒DNA检测Fig.3 Detection of plasmid DNA extracted from the isolated bacteria

表4 不同分离菌的质粒检测Tab.4 Detection of plasmid extracted from the different isolated bacteria
1~14号细菌名称对应于表1。
2.4.2 质粒抗性检测
将摩根氏菌属中拷贝数较高的1.8 kb大小的质粒和嗜水气单胞菌中6 kb的质粒转化大肠杆菌TG1,涂到带有氨苄青霉素的LB固体培养基中,前者可以观察到转化子,挑取转化子培养,抽提质粒进行电泳检测,其质粒的分子量与原质粒相同,而后者则未成功得到转化子。说明1.8 kb大小的质粒可能与分离菌的氨苄青霉素抗性有关,而嗜水气单胞菌中的6 kb大小的质粒可能与氨苄青霉素抗性无关。随后将9号菌中的6 kb质粒回收,进行全长测序,结果得出6 141 bp的序列(GenBank登录号:KR677378.1),并对序列进行分析,并未发现抗性基因,可以推测9号菌中对抗生素的抗性与其6 kb质粒无关。
3 讨论
目前,水生动物中主要分离到的病原菌有气单胞菌属的斑点气单胞菌(Aeromomaspunctata)、温和气单胞菌(A.sobria)、嗜水气单胞菌,假单胞菌属的荧光假单胞菌(Pseudomonasfluorescens)、白皮假单胞菌(P.dermoalba)、水型点状假单胞菌(P.punctatafascitae)、类志贺邻单胞菌(Plesimonasshigelloides),弧菌属的鳗弧菌(Vibrioanguillarum)、霍乱弧菌(V.cholerae)、创伤弧菌(V.vulnificus)等,这些细菌的感染引起水生动物发生多种细菌性疾病。在本研究中,我们从不同地区采集的患病南美白对虾、河蟹、锦鲤、草鱼、鲫、中华鳖、青鱼和鳙中分离到不动杆菌、黄杆菌、气单胞菌、弧菌、希瓦氏菌、嗜水气单胞菌、摩根氏菌,由于这些细菌均是从患病的活的有症状的水生动物血液中分离获得,引起苏州地区养殖水生动物细菌性疾病的细菌种类较多。气单胞菌的致病范围十分广泛,它可导致多种水产动物患病,引起大量死亡[5-6]。在本研究中,从患病鱼类的血液中分离的细菌以气单胞菌属最多,推测引起苏州地区养殖鱼类细菌性疾病的主要流行菌为气单胞菌属的细菌。从同一条患病的鲫中可以同时分离到维氏气单胞菌、弧菌和希瓦氏菌,表明鱼类的细菌性疾病有时可以由多种细菌共同感染引起。
正确使用抗生素是防治水生动物细菌性疾病的有效方法,但是,不同种的细菌、同一种细菌的不同的分离株对抗生素的敏感性存在明显差异,同时由于养殖生产上滥用抗生素,细菌的耐药性增加,往往导致生产上使用抗生素的治疗效果不令人满意。9号嗜水气单胞菌和10号摩氏摩根菌对所选择的抗生素均表现出明显的耐药性,特别是摩氏摩根菌,对硫酸链霉素表现出极强的耐药性,其最低抑菌浓度>125 μg/mL;从昆山不同患病鱼(鲫、青鱼、鳙)中分离的维氏气单胞菌(11、12、14号菌)对恩诺沙星表现出不同的敏感性,来自青鱼的维氏气单胞菌(12号)对恩诺沙星的耐药性分别比来自鲫(11号菌)、花鲢(14号菌)维氏气单胞菌的高15和3倍,不同鱼体来源的同一种细菌的耐药性存在明显不同;同一病鱼中存在细菌种相同但抗性不同的菌株,提示在筛选抗生素时对从病鱼中分离到同一种细菌需分别进行耐药性检测。本实验中所分离菌对硫酸链霉素均表现出耐药性,因此,硫酸链霉素不太适合用于苏州市的水产养殖业中细菌病防治。通过药敏试验筛选合适的抗生素用于水生动物细菌性疾病的防治有重要作用,但是由于不同抗生素在鱼体内代谢各不相同,往往有可能在体外对细菌有作用的抗生素在体内不一定能发挥治疗作用,因此,在药敏试验的基础上进一步进行药代动力学分析,对指导养殖生产中抗生素类药物的正确使用有重要指导作用。
抗菌药物作用主要是通过干扰病原微生物的生理生化代谢过程产生抗菌作用。细菌产生耐药性有多种机制,部分菌的耐药性与菌体存在质粒有密切关系[7-8],本研究的结果显示,4、5、11、12和14号菌均为维氏气单胞菌,但4和14号菌中没有检测到质粒,因此可以认为这二个菌的耐药性与质粒无关;而5、11、12号菌中可检测到明显的质粒,且不同菌株之间的质粒种类和分子量存在不同,维氏气单胞菌不同分离株的耐药性差异是否与其带有的质粒有关还需进一步分析。
摩氏摩根菌的多重耐药性与其质粒含有抗性基因密切关联,从摩氏摩根菌已分离到61 093 bp的R485(GenBank登录号:NC_016036.1)、2683bp的pCGH69(GenBank登录号:NC_021524.1)和 2 683 bp的pM60(GenBank登录号:NC_023901.1)质粒,在R485质粒中具有与磺类药物抗性相关的二氢蝶酸合酶基因,在pCGH69和pM60中均检测到编码喹诺酮类耐药性蛋白的基因[9]。在本研究中,我们发现从中华鳖中分离到的摩氏摩根菌呈多重耐药性,并从摩氏摩根菌中检测到表观分子量不同的4种质粒(表4),将表观分子量为1.8 kb的质粒转化到大肠杆菌可使其获得抗氨苄青霉素的性能,表明该质粒可赋予摩氏摩根菌获得氨苄青霉素耐药性。本研究从摩氏摩根菌分离到的其他质粒是否与耐药性有关还需进一步探讨。
嗜水气单胞菌对多种抗生素呈现耐药性,对不同的抗生素有不同的耐药机制。已有报道,在对环丙沙星、庆大霉素以及妥布霉素多重耐药的嗜水气单胞菌菌株中,检测出9 416 bp、4 361 bp 以及1 925 bp 3 种质粒[7-8],在GenBank已登录的从不同嗜水气单胞菌分离到分子量不同的质粒有12种,其中质粒pRA3(GenBank登录号:NC_010919;45 909 bp)中含有链霉素-3′-腺苷转移酶基因,编码氨基糖苷类抗生素抗性蛋白;pBRST7.6质粒(GenBank登录号:EU925817.1;7 621 bp)中存在喹诺酮类耐药性基因,而pRA1质粒(GenBank登录号:NC_012885.1;143 963 bp)是一种IncA/C 多药物抗性质粒,含有四环素抗性基因和四环素阻遏蛋白基因。 本研究从嗜水气单胞菌(9号菌)检测到一种约6 kb的质粒,质粒全序列测序结果(GenBank登录号:KR677378.1)显示,该质粒中不存在与抗生素耐药性有关的基因序列,因此该嗜水气单胞菌的多重耐药性与质粒无关,有必要从细菌的基因组水平进一步深入研究。

