鱼胶原蛋白肽对高脂膳食小鼠肝脏脂肪代谢和氧化还原状态的影响
田 许,杨玉辉,王雅楠,张佳红,郭海涛,施用晖,乐国伟,*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学食品学院,江苏 无锡 214122)
近年来随着物质生活水平的不断提高,我国居民从传统的植物性食物为主的膳食结构向高脂肪、低碳水化合物的膳食结构发展,导致肥胖的发生率逐年增加[1-2]。当前肥胖已经成为全球性的公共卫生问题而被广泛关注[3]。许多研究已经证明了肥胖是代谢综合征发生最常见的危险因素,而且还是糖尿病、心脑血管疾病和多种癌症发生的重要诱因[4]。长期高脂膳食(high-fat diet,HFD)会使机体产生过量的自由基,破坏氧化还原状态的平衡,继而导致脂代谢的紊乱[5],最终诱使肥胖发生。已有大量研究表明通过饮食中添加抗氧化因子能够对氧化还原状态失衡导致的脂代谢紊乱起到良好的改善作用[6-9]。
胶原蛋白肽已被证实具有降血压、抗氧化、抗衰老、调节肠道微生态、抗肿瘤、改善骨骼和皮肤以及免疫调节等多种活性[10-14]。近年来,陆源性胶原蛋白的开发利用遇到宗教和安全性方面的诸多问题,水产鱼类加工利用后的下脚料中因富含胶原蛋白而受到研究者们的重视[15]。鱼胶原蛋白肽(fish collagen peptides,FCPs)是从鱼类加工后的皮、骨、鳞和鳍等废弃物中提取胶原蛋白后经过酶法处理所得[12]。过去的研究已经发现猪骨胶原蛋白肽具有改善HFD小鼠抗氧化和血脂代谢的作用[16],丁进锋等[17]使用海蜇胶原蛋白肽也观察到了相似的结果,但具体的作用机制还缺乏深入研究。肝脏作为机体脂类消化、吸收、合成、分解和运输的重要场所[18],是很多营养功能因子的作用位点。因此,本实验以HFD C57BL/6小鼠为实验动物模型,研究FCPs干预对HFD小鼠肝脏脂代谢和氧化还原状态的影响,为FCPs功能的开发和利用提供实验依据和理论支持。
1 材料与方法
1.1 动物、材料与试剂
4 周龄清洁级C57BL/6雄性小鼠54 只(18~20 g)饲养于江南大学动物实验中心,购自南京大学生物医药研究院。实验动物合格证号:SCXK(苏)2015-0001。
FCPs(食品级,纯度99%,分子质量150~2 000 Da) 韩国Geltech公司;总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(reduced glutathione,GSH)、氧化型谷胱甘肽(oxidized glutathione,GSSG)、游离脂肪酸(free fatty acid,FFA)、苏木精-伊红(hematoxylin and eosin,HE)、油红O试剂盒 南京建成生物工程研究所;甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)试剂盒 上海丰汇医学科技有限公司;TRIzol裂解液 美国Biomiga公司;M-MLV逆转录酶、5×逆转录缓冲液 美国Promega公司;dNTPs 碧云天生物技术公司;Oligo(dT)、基因引物 上海捷瑞生物工程公司;SYBR Green Master Mix 南京诺唯赞生物科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
5804R台式高速冷冻离心机 德国Eppendorf公司;Epoch微孔板分光光度计 美国BioTek公司;组织切片机、包埋机、脱水机 德国Leica公司;光学显微镜 日本Olympus公司;ETC811 聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 东胜兴业科学仪器有限公司;900HT Fast实时荧光定量PCR(quantitative real-time PCR,qPCR)仪 美国ABI公司;立式超低温冷冻冰箱 日本Sanyo公司。
1.3 方法
1.3.1 实验动物饲喂与分组
饲养条件:SPF级动物房,所有小鼠共处一室,每组6 笼,一笼3 只,自由摄食和饮水,环境温度(23f2)℃,相对湿度(50f10)%,12 h/12 h昼夜循环光照。
小鼠以正常饲料适应性饲喂一周后,按体质量随机分为3 组,每组18 只:正常膳食组(CON组,含4%(质量分数,下同)脂肪);高脂膳食组(HF组,含20%脂肪);FCPs干预高脂膳食组(PHF组,含20%脂肪+1%FCPs)。各组饲料参考AIN93纯合氨基酸日粮标准和Hasek等[19]的配方进行配制,PHF组的纯合氨基酸添加量扣除所加FCPs中各种氨基酸的量。其中添加的脂肪均为猪油,正常饲料的供能总量为16.20 kJ/g,脂肪供能比为11.63%;HF组和PHF组饲料的供能总量为19.55 kJ/g,脂肪供能比为38.54%。
1.3.2 组织样品的采集
所有小鼠每周称质量并记录体质量,每组按体质量随机分为两批各9 只,分别于11、22 周后禁食12 h,摘眼球取血于肝素钠抗凝管中(4 ℃、3 000 r/min离心10 min后取血浆-80 ℃保存备测),断颈处死。
冰浴条件下迅速摘取肝脏,称质量记录后取部分肝脏组织按1∶9(m/V)加入4 ℃预冷的生理盐水制备质量分数10%组织匀浆,4 ℃、3 000 r/min离心10 min取上清液-80 ℃保存备测;取相同部位和大小的两块肝脏组织分别放入体积分数4%多聚甲醛固定液和冷冻固定液中备用;再取100 mg左右肝脏组织于TRIzol中剪碎,液氮速冻后-80 ℃保存备用。其余肝脏样品直接-80 ℃保存。1.3.3 体质量增长率、采食量和表观脂肪消化率的测定
将小鼠称质量后放入提前消毒好的代谢笼中适应3 d,开始实验后,收集每只小鼠72 h的粪便待测。整个实验流程中所有小鼠均自由采食和饮水。
记录饲料投入量和投入时间,每24 h称量并记录食槽中剩余饲料质量以及漏入代谢笼内的饲料质量。连续监测3 d计算平均数。小鼠体质量增长率及采食量分别按式(1)、(2)计算。

分别将每只小鼠的粪便样品和饲料磨碎后各取1 g,精确称质量,分别包入滤纸后在铝盒中105 ℃烘干至恒质量,记录质量,将滤纸包放入索氏抽提器中进行脂肪抽提4 h以上,至回流液滴在滤纸上挥发后没有油印为终点。再次将滤纸包烘至恒质量后记录质量,前后两次恒质量后的质量差即为粪便和饲料中的粗脂肪质量。表观脂肪消化率根据式(3)计算。

1.3.4 肝脏脂质水平的测定
按照试剂盒说明书进行TC、TG和FFA水平的测定。
1.3.5 肝脏组织切片观察
按照试剂盒说明书对固定液中的肝脏组织样品进行切片和染色,镜检,用Image-Pro图像软件对切片进行分析,计算肝脏脂肪空泡和脂肪浸润面积的比例。
1.3.6 肝脏脂代谢相关基因表达水平的测定
采用TRIzol法提取肝脏总RNA,甲醛变性电泳鉴定RNA质量,测定浓度后反转录得到cDNA,qPCR测定乙酰辅酶A羧化酶1(acety1 CoA-carboxylase 1,ACC1)、脂肪酸合成酶(fatty acid synthase ,FAS)、固醇调节元件结合蛋白1c(sterol regulatory element-binding protein 1c,SREBP1c)、胆固醇7α-羟化酶1(cholesterol 7α-hydroxylase 1,CYP7A1)、过氧化物激活受体α(peroxisome proliferator activated receptor α,PPARα)和肉毒碱棕榈酰基转移酶1(carnitine palmity1 transferase 1,CPT1)的mRNA表达水平,以β-actin为内参,引物序列见表1。最终结果以目的基因相比内参基因的相对表达量来表示。

表1 qPCR引物序列Table1 Sequences of the primers used in qPCR
1.3.7 氧化还原指标的测定
活性氧自由基(reactive oxygen species,ROS)水平的测定采用Lumino电化学发光法[20];T-AOC水平、MDA水平、GSH-Px活力和还原型/氧化型谷胱甘肽(ratio of reduced and oxidized glutathione,GSH/GSSG)水平的测定按照试剂盒说明书操作。
1.4 数据统计分析
数据结果以fs表示,采用IBM SPSS Statistics 22.0软件对实验数据进行统计学分析。各组间的比较采用单因素方差分析(One-way ANOVA),对满足方差齐性的结果用Duncan检验进行多重比较,方差不齐时采用Tamhane检验。P<0.05时认为差异具有统计学意义。
2 结果与分析
2.1 FCPs对HFD小鼠体质量的影响

图1 FCPs对HFD小鼠体质量和体质量增长率的影响(n=9)Fig.1 Effect of FCPs on body mass and mass gain rate in mice fed with HFD (n = 9)
在整个饲喂周期中,各组小鼠的体质量从初始时没有差异(P>0.05),到第11周时为快速增长的阶段,随后进入体质量增长相对平缓的时期(图1A)。HF组小鼠的体质量增长从高脂饲喂开始后一直高于CON组,第11、22周时均有显著差异,并且结果有统计学意义(P<0.05);与HF组相比,PHF组的体质量和体质量增长率没有出现统计学差异(P>0.05)(图1B)。
2.2 FCPs对HFD小鼠采食量和日均采食总能量的影响
第7周时,HF组的采食量相比CON组有减少趋势,而PHF组则有所增加,但均未出现统计学差异(P>0.05)。至第14周,与CON相比,HF组的采食量显著减少(P<0.05);与HF组相比,PHF组的采食量增加,且差异有统计学意义(P<0.05)。到21 周终末,HF组的采食量相比CON组仍保持显著减少(P<0.05);而PHF的采食量相比HF组明显增加(P<0.05)(图2A)。
由于各组饲料配方的不同,同质量的正常饲料与高脂饲料所提供的能量并不相同,因此在采食量的基础上又统计分析了各组小鼠的日均采食总能量。可见HF组的日均采食总能量与CON组相比在第7、14周均有增加趋势,但没有统计学差异(P>0.05);与HF组相比,PHF组的日均采食总能量均有增加趋势,第7周时无统计学差异(P>0.05),而第14、21周均显著增加(P<0.05)(图2B)。
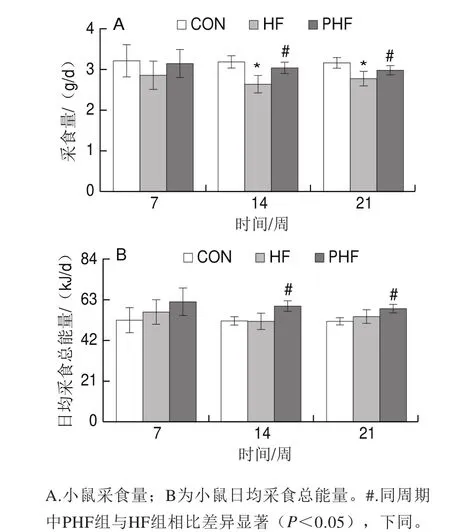
图2 FCPs对HFD小鼠采食量和日均采食总能量的影响(n=9)Fig.2 Effect of FCPs on daily food intake and total energy intake in mice fed with HFD (n = 9)
2.3 FCPs对HFD小鼠脂肪消化吸收的影响
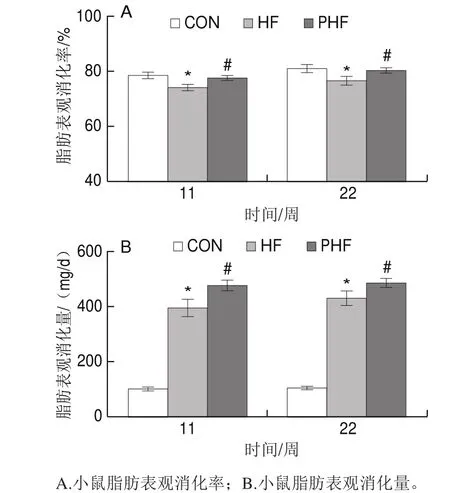
图3 FCPs对HFD小鼠脂肪消化吸收的影响(n=9)Fig.3 Effects of FCPs on fat digestibility in mice fed with HFD (n = 9)
第11、22周时,与CON组相比,HF组的脂肪表观消化率显著降低(P<0.05);相比HF组,PHF组的脂肪表观消化率显著升高(P<0.05)(图3A)。
用脂肪表观消化率和采食量相乘,计算并统计了各组小鼠的日均脂肪表观消化量。第11和22周时,相比CON组,HF组的日均脂肪表观消化量显著降低(P<0.05);与HF组相比,PHF组的脂肪表观消化率在第11、22周时均显著增加(P<0.05)(图3B)。
2.4 FCPs对HFD小鼠肝脏质量和组织形态的影响
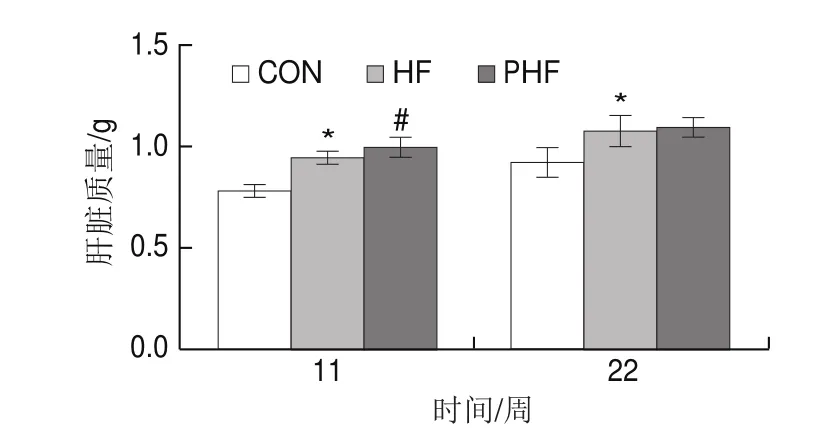
图4 FCPs对HFD小鼠肝脏质量的影响(n=9)Fig.4 Effect of FCPs on liver mass of mice fed with HFD (n = 9)
由图4可见,在第11、22周时,相比CON组,HF组的肝脏质量显著增加(P<0.05);与HF组相比,PHF组的肝脏质量在第11周时显著增加(P<0.05),至22周时两者差异没有统计学意义(P>0.05)。

图5 FCPs对HFD小鼠肝脏组织形态的影响Fig.5 Effect of FCPs on hepatic morphology in mice fed with HFD
对HE染色的肝脏石蜡切片进行镜检,相比CON组,可见第11、22周时HF组小鼠的肝细胞均出现大量脂肪空泡,细胞形状和排列出现紊乱,空泡面积随饲喂时间的增长有明显变大的趋势;与HF组相比,第11周时,PHF组也出现了较多的脂肪空泡和肝细胞形态紊乱,但空泡较小,第22周时,PHF组的空泡大小和数量都比HF组有明显改善(图5A)。
通过油红O染色小鼠肝脏冰冻切片,其中的脂肪被染为红色,可以观察到,相比CON组,HF组小鼠的肝脏脂肪浸润程度在第11、22周时都明显增加;与HF组相比,PHF组的肝脏脂肪浸润程度在第22周时明显降低(图5B)。

图6 FCPs对HFD小鼠肝脏脂肪蓄积的影响(n=4)Fig.6 Effect of FCPs on fat accumulation in liver of mice fed with HFD (n = 4)
由图6可见,分别统计HE染色切片中的脂肪空泡面积和油红O切片中的脂肪浸润面积占视野总面积的比例,来衡量肝脏脂肪蓄积的程度。相比CON组,第11、22周时,HF组小鼠的肝脏脂肪空泡面积比和脂肪浸润面积比均显著增加(P<0.05);与HF组相比,PHF组小鼠在第11、22周时的脂肪空泡面积比显著降低(P<0.05),脂肪浸润面积比在第11周时没有显著差异(P>0.05),第22周时显著降低(P<0.05)。
2.5 FCPs对HFD小鼠肝脏脂肪含量的影响
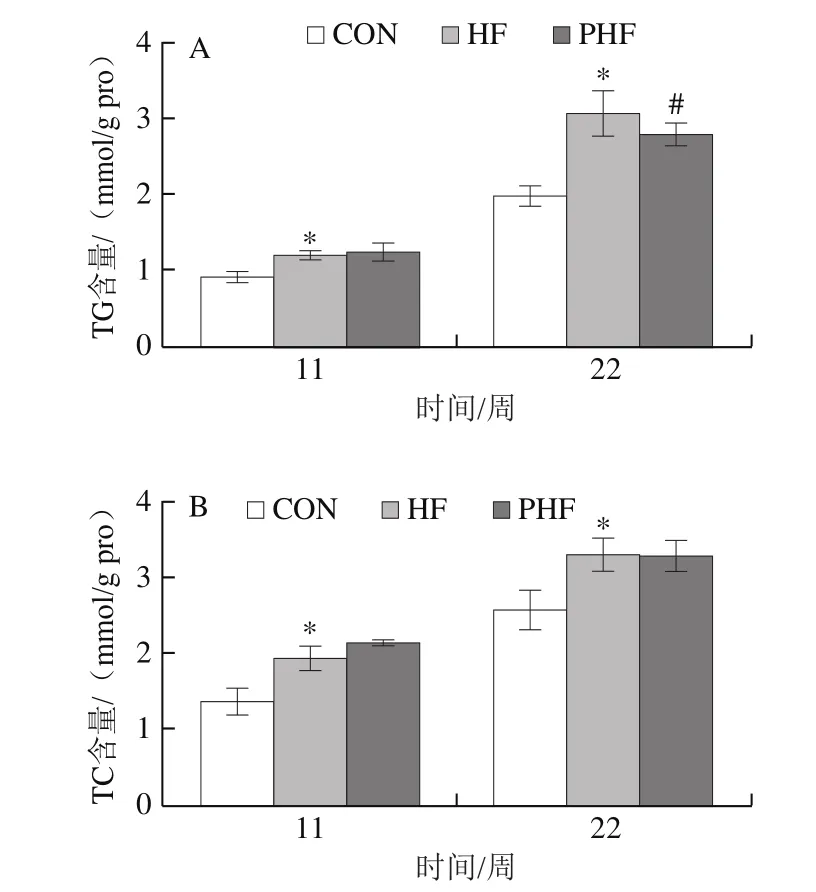

图7 FCPs对HFD小鼠肝脏脂肪含量的影响(n=9)Fig.7 Effect of FCPs on lipid pro fi les in liver of mice fed with HFD (n = 9)
由图7可见,与CON组相比,HF组第11、22周时TG、TC和FFA水平均显著升高(P<0.05);与HF组相比,PHF组在第11周时TG、TC和FFA水平均无统计学差异(P>0.05),至第22周时,PHF组TG和FFA水平显著下降(P<0.05),TC水平仍无统计学差异(P>0.05)。
2.6 FCPs对HFD小鼠肝脏脂肪合成相关基因表达的影响
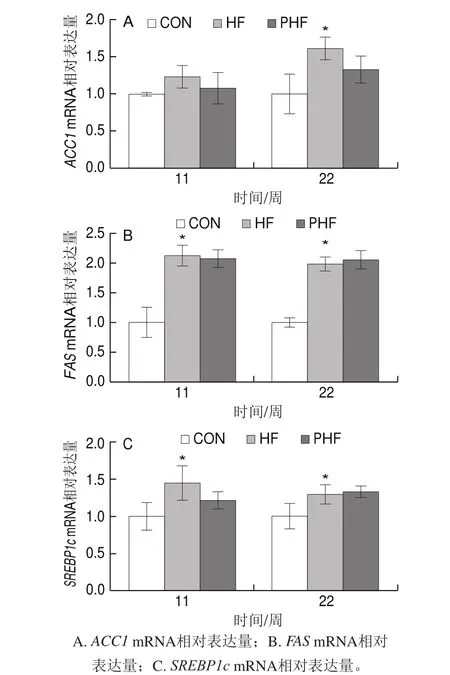
图8 FCPs对HFD小鼠肝脏脂肪合成相关基因表达的影响(n=9)Fig.8 Effect of FCPs on gene expression related to hepatic lipogenesis in mice fed with HFD (n = 9)
由图8可见,与CON相比,第11周时HF组的肝脏脂肪合成关键基因表达均有上调的趋势,其中ACC1 mRNA水平没有统计学差异(P>0.05),FAS和SREBP1c mRNA水平均显著上调(P<0.05),至第22周时,三者均有显著上调(P<0.05);相比HF组,PHF组两个周期中的ACC1 mRNA水平和第11周时的SREBP1c mRNA水平均有下调趋势,但没有统计学差异(P>0.05),其他周期中的各脂肪合成关键基因表达均没有明显变化(P>0.05)。
2.7 FCPs对HFD小鼠肝脏脂肪分解相关基因表达的影响
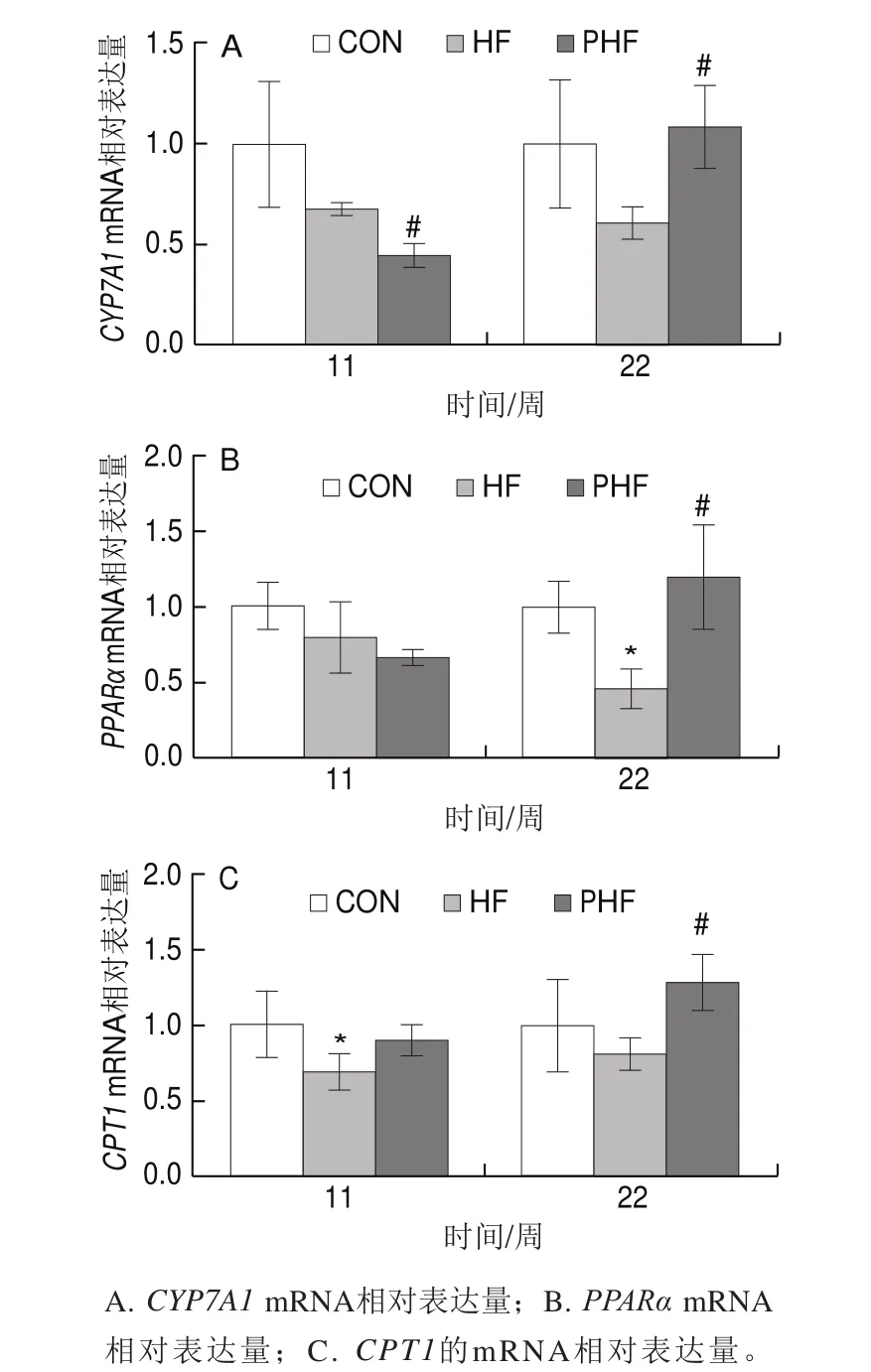
图9 FCPs对HFD小鼠肝脏脂肪分解相关基因表达的影响(n=9)Fig.9 Effect of FCPs on gene expression related to hepatic lipolysis in mice fed with HFD (n = 9)
由图9可见,与CON组相比,HF组各周期的脂肪分解关键基因表达均有下调的趋势,其中第11周时的CPT1 mRNA水平和第22周时的PPARα mRNA水平显著下调(P<0.05),其他周期中的各基因表达没有统计学差异(P>0.05);相比HF组,第11周时PHF组的CYP7A1 mRNA水平显著下调(P<0.05),PPARα mRNA水平有下调趋势但差异没有统计学意义(P>0.05),CPT1 mRNA水平有上调趋势但也没有统计学差异(P>0.05),第22周终末,PHF组的CYP7A1、CPT1和PPARα的mRNA水平均显著上调(P<0.05)。
2.8 FCPs对HFD小鼠肝脏氧化还原状态的影响
由图10可见,与CON组相比,HF组的ROS水平在两个周期中均显著增加(P<0.05);相比HF组,PHF组的ROS水平表现出减少趋势,其中第11周时差异没有统计学意义(P>0.05),第22周时显著减少(P<0.05)。

图10 FCPs对HFD小鼠肝脏ROS水平的影响(n=9)Fig.10 Effect of FCPs on the level of liver ROS in mice fed with HFD (n = 9)

图11 FCPs对HFD小鼠肝脏氧化还原状态的影响(n=9)Fig.11 Effect of FCPs on liver redox state in mice fed with HFD (n = 9)
由图11可见,第11周时,与CON组相比,HF组的肝脏MDA水平显著增加(P<0.05)、GSH-Px活力和GSH/GSSG比值显著降低(P<0.05),T-AOC水平没有统计学差异(P>0.05);相比HF组,PHF组的MDA水平有减少趋势,但没有统计学差异(P>0.05),GSH-Px活力和GSH/GSSG比值均显著升高(P<0.05),T-AOC水平没有统计学差异(P>0.05)。至第22周终末,与CON组相比,HF组的T-AOC水平、GSH-Px活力和GSH/GSSG比值显著降低(P<0.05),MDA水平显著增加(P<0.05);相比HF组,PHF组的T-AOC水平和GSH-Px活力显著升高(P<0.05),MDA水平和GSH/GSSG比值均有改善,但没有统计学差异(P>0.05)。
3 讨 论
本研究显示,在HFD中添加质量分数1% FCPs并没有抑制小鼠体质量的增加,而李亚欣、朱琳玲等采用2%猪骨胶原蛋白肽干预则观察到了小鼠体质量增长的抑制[14,16],这与胶原蛋白肽的来源、添加量和模型的不同有一定的关系。一般饲料中油脂质量分数超过3%时就会由于胆汁酸分泌量的限制影响禽畜对饲料中脂肪的吸收,而通常HFD饲料中的脂肪含量高达20%,势必造成其中脂肪不会完全吸收。本研究在FCPs干预后观察到,在自由摄食、饮水和运动的情况下,PHF组小鼠的采食量、脂肪摄入和能量摄入相比HF组显著增加,这可能与FCPs作为两亲性物质参与了脂肪的乳化吸收有关。动物摄入脂肪和能量的增加势必会引起其体质量的增加,然而在本研究中PHF组相比HF组体质量并没有统计学差异,提示FCPs可能通过增加了机体对脂肪的利用来改善HFD造成体内脂肪积蓄和脂代谢紊乱。
HFD导致的肥胖,造成脂代谢紊乱通常表现为体内脂肪水平的失衡,特别是肝脏的异常增大和脂肪积累,已有研究表明胶原蛋白肽可以显著改善机体的血脂水平[16-17]。本研究表明,FCPs干预可以显著改善HFD导致的肝脏脂肪空泡增多、脂肪浸润面积增大、以及甘油三酯和游离脂肪酸水平的升高,通过减少肝脏的脂肪蓄积对脂代谢紊乱进行调节。
ACC1是催化脂肪酸合成第一步反应的限速酶[21];FAS是脂肪酸合成反应的另一个限速酶,在肝脏组织中的表达较高[22];SREBP1c则是作为转录因子选择性激活脂质合成相关酶的表达,以此来调控肝脏脂质代谢[23]。从实验结果来看,除FAS mRNA水平外,相比HF组,PHF组FCPs干预对肝脏脂肪合成关键调节物ACC1和SREBP1c的mRNA表达均有一定的下调,但是都没有统计学差异,说明FCPs主要作用途径可能不是通过抑制脂肪合成实现的。
CYP7A1是胆汁酸合成的限速酶,其上调可以减少肠道对胆汁酸的重吸收并增加机体排出胆固醇[24];PPARα是过氧化物酶体增殖物激活受体的一个亚型,可以改善机体对脂肪酸的转运和利用[25];CPT1是脂肪酸β氧化的限速酶[26]。本研究表明,与HF组相比,PHF组在FCPs干预11 周时,会显著下调CYP7A1的mRNA表达,PPARα的mRNA表达水平也有下调趋势,说明虽然在FCPs的干预下,由于PHF组在中短期内摄入比HF组更多的脂肪和能量,HFD对PHF组小鼠脂肪分解代谢的干扰更为明显,这与肝脏脂肪水平的结果也是一致的;但到第22周时,FCPs显著上调了三者的mRNA表达水平。因此,尽管PHF组小鼠的脂肪摄入量和能量摄入量在整个饲喂周期中都显著高于HF组,并导致中短期饲喂(11 周)时PHF组的CYP7A1和PPARα的基因表达水平下降,但长期饲喂(22 周)时的相关结果说明FCPs对HFD小鼠肝脏脂代谢紊乱的调节,可能与长期饲喂时其促进脂肪分解代谢密切相关。
已有大量研究表明功能因子对HFD导致肥胖的影响与其抗氧化作用密切相关[8-9,17]。长期HFD使机体脂肪摄入处于过量状态,肝脏作为能量代谢的重要器官,代谢水平持续增高,导致肝细胞需氧量增加,进而诱发更多ROS的生成,引起肝脏中生物大分子的氧化损伤,肝细胞失去完整性影响肝脏功能[27],这是肝脏脂代谢失衡的重要原因。
由于胶原蛋白肽是酶解蛋白得到的混合物,可分离纯化得到的具有抗氧化活性的单体肽数量甚多[28-29],所以其抗氧化机制也相对复杂,目前已经报道的有直接淬灭自由基、金属离子螯合以及提供还原力等多种抗氧化途径[30]。有研究表明胶原蛋白酶解产物的自由基清除能力与其疏水性氨基酸和亚氨基酸含量有关,而还原力更依赖于羟脯氨酸的含量,也有研究报道羟脯氨酸的游离羟基具有清除超氧阴离子自由基和羟自由基的能力[31-32]。
从本研究的结果来看,FCPs干预HFD小鼠11 周时,相比HF组,PHF组显著提高了肝脏GSH-Px活力和GSH/GSSG比值,对肝脏MDA水平也有降低的趋势;第22周后,可以观察到PHF组肝脏T-AOC水平、MDA水平和GSH-Px活力相比HF组的显著改善,同时对GSH/GSSG比值也有改善的趋势,但没有统计学差异。提示FCPs可能首先通过调节肝脏氧化还原状态,继而调节了HFD小鼠肝脏的脂肪分解代谢,但是其中具体的作用机制还需要进一步的研究和验证。
综上,质量分数1%的FCPs能够减少HFD小鼠肝脏中ROS的产生,改善肝脏的抗氧化能力,促进肝脏脂肪分解代谢,减少肝脏中脂肪的蓄积。因此饮食中添加1%FCPs具有改善机体氧化还原状态和脂代谢紊乱的作用。本研究为FCPs的开发利用提供了更进一步的理论依据,具有一定的研究意义。

