葫芦[8]脲主客体包合物特性及对金属离子键合常数测定
马 军, 张雄志, 刘思敏
(武汉科技大学化学与化工学院,湖北武汉 430081)
葫芦[n]脲(CB[n],图1)是一类具有电负性羰基端口和疏水空腔的大环主体。这类南瓜形状分子由2n个亚甲基桥联n个甘脲单元组成[1 - 3]。通过疏水效应、离子偶极和氢键等相互作用,葫芦[n]脲可以与各种客体分子形成稳定的主客体包合物[4]。由于葫芦[6]脲的结构最早被建立[5],所以关于葫芦[6]脲的主客体结合研究开展的较多较早。2000年后,随着更多的葫芦[n]脲(n=5,7,8,10,13~15)家族成员逐渐被发现[1,3,6 - 8],这类主体的主客体化学性质的研究也被拓展。不同的葫芦[n]脲由于其所含甘脲单元数目的不同,空腔体积差别较大,导致客体分子与不同的葫芦[n]脲的键合常数存在差异[4,9]空腔体积较小的葫芦[6]脲对质子化的直链烷胺类客体具有较好的亲和性。空腔体积较大的葫芦[7]脲、葫芦[8]脲对金刚烷胺、二茂铁衍生物等较大的带正电荷的分子亲和作用强。葫芦[10]脲是目前已知的自由状态下具有最大空腔体积的葫芦[n]脲成员,其空腔可容纳包括杯[4]芳烃、金属卟啉以及环番blue box等较大尺寸客体分子[10]。
葫芦[n]脲具有电负性的羰基端口,易与阳离子发生结合,因此当客体分子带正电荷时,与葫芦[n]脲的结合往往较为牢固。不同的金属离子对同一种葫芦[n]脲显示出不同的亲和力,环境因素、溶剂、阴离子等对葫芦[n]脲与金属离子的配位也有一定的影响。Tao等人[11]对葫芦[n]脲与金属离子的配位识别进行了详尽的综述介绍。Fenn等人[12]研究了葫芦[6]脲与4-甲基苄胺的包合模式,并以4-甲基苄胺做指示剂测定了金属离子与葫芦[6]脲的键合常数。
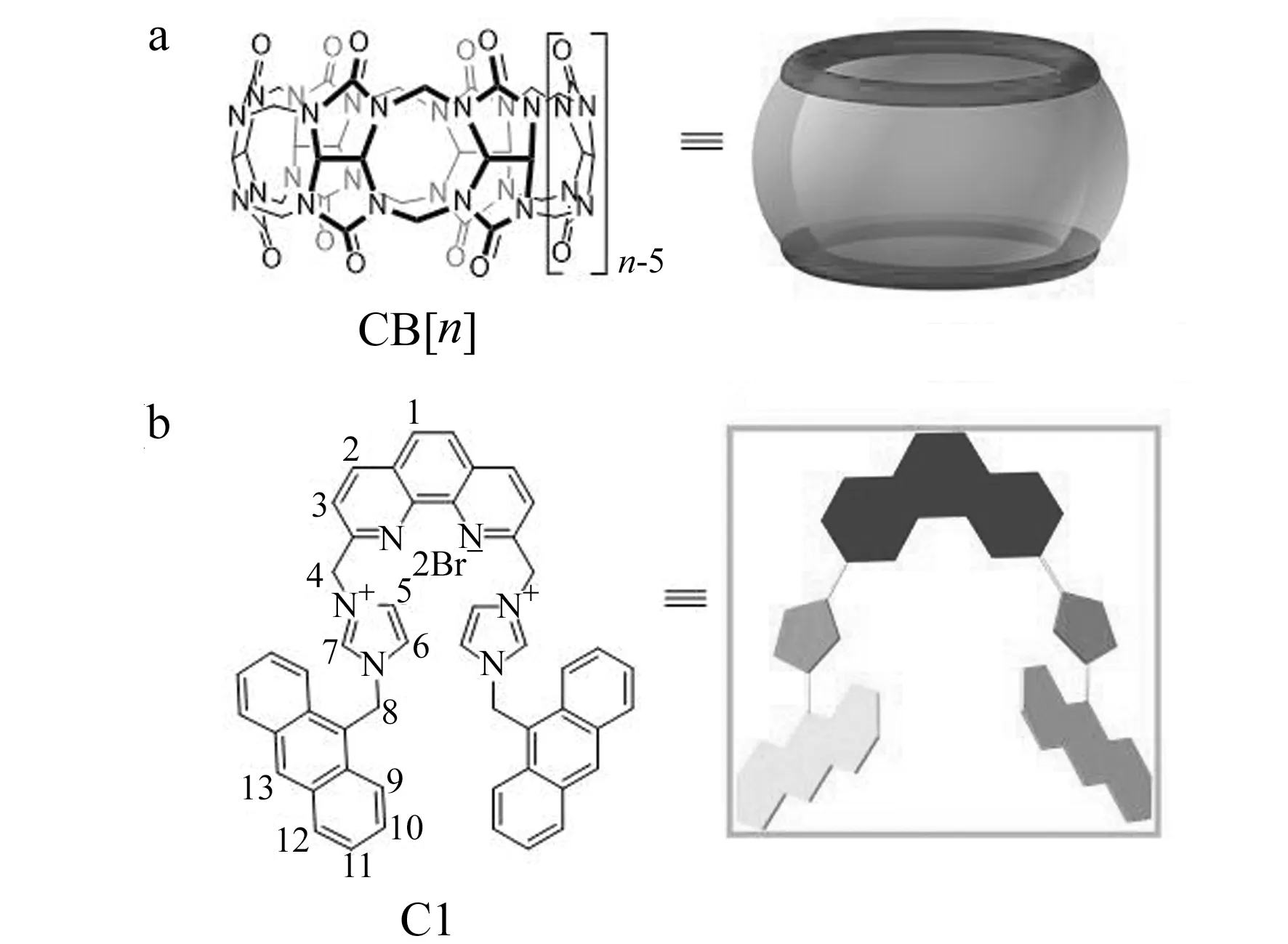
图1 葫芦脲和双咪唑盐C1的结构Fig.1 Structures of CB[n] host and bisimidazolium salts C1 guest
近些年,咪唑鎓盐类引起了广大科研人员的兴趣[13 - 15]。为了扩展葫芦[n]脲超分子化学中咪唑盐作为客体分子的范围,我们合成了一种新铜试剂连接的双咪唑盐(C1,图1b),并通过核磁共振、紫外-可见光谱、荧光发射光谱等研究了C1和葫芦[8]脲的包合模式。结果显示葫芦[8]脲与C1形成3∶1(3葫芦[8]脲·C1)的包合物。进一步的研究发现该包合物在水溶液中对金属离子具有响应性,金属离子与C1竞争结合葫芦[8]脲。以C1为荧光指示剂我们测定了葫芦[8]脲与几种金属离子的键合能力。
1 实验部分
1.1 仪器与试剂
Agilent 600MHz核磁共振仪(美国,安捷伦科技公司);UV-3600紫外-可见光谱仪(日本,岛津公司);LS-55荧光光谱仪(美国,PerkinElmer公司);FiveEsay 20 pH计(美国,梅特勒公司)。
甘脲、9-氯甲基蒽、新铜试剂、N,N-二异丙基乙胺、亚磷酸二乙酰(分析纯,安耐吉化学);多聚甲醛、N-溴代丁二酰亚胺、过氧化苯甲酰(分析纯,国药集团);HCl(36.0%~38.0%,上海沪试);甲酸、乙酸、甲醇、乙腈、四氢呋喃、石油醚、乙酸乙酯、Na2SO4、K2SO4、CuSO4、MgSO4、CaCl2、CdCl2、MnCl2、FeCl3(分析纯,国药集团)。实验用水为超纯水。
1.2 双咪唑盐C1的合成
双咪唑盐C1根据文献方法[16 - 17]进行合成,合成路线如图2所示,得到棕黄色粉末。
1H NMR(DMSO-d6)δ(ppm):9.18(s,2H),8.79(s,2H),8.55(d,2H),8.46(d,4H),8.17(d,4H),8.02(s,2H),7.93(s,2H),7.85(s,2H),7.56(m,10H),6.43(s,4H),5.66(s,4H)。
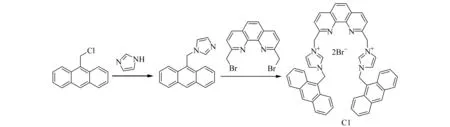
图2 双咪唑盐C1的合成Fig.2 Synthesis of bisimidazole salt C1
1.3 葫芦[8]脲的合成
葫芦[n]脲根据Kim等的报道[1]合成。粗品葫芦[8]脲用浓HCl重结晶后,在水中搅拌以除去其中的HCl。之后过滤、真空干燥即可得到纯葫芦[8]脲。
1.4 核磁表征及滴定
核磁共振氢谱均采用直径为5 mm的标准核磁管,测试温度为298 K,自动或手动匀场及调谐。一般数据收集参数为:扫描次数为64次,弛豫时间为2 s;对于需要得到准确积分的样品扫描次数为64次,弛豫时间为20 s。数据收集后用MestReNova核磁数据处理软件处理并作图,将水峰位置定位4.60 ppm。
C1样品的制备:称取2~3 mg的固体样品溶于相应的溶剂中,超声或加热使其完全溶解后进行核磁表征。葫芦[8]脲-C1包合物样品的制备:向配制好的客体溶液中加入过量的葫芦[8]脲固体,超声5 min后离心,取上层澄清溶液进行核磁表征。
C1与葫芦[8]脲的核磁滴定:在D2O中配制浓度为1.0 mmol/L高浓度C1溶液,均分成两份。向其中一份加入过量葫芦[8]脲,超声5 min后离心除去未溶解的葫芦[8]脲。上述两溶液用D2O稀释成浓度为0.1 mmol/L的低浓度溶液。按一定的体积比将两种溶液进行混合可调节葫芦[8]脲与客体C1的摩尔浓度比例。
1.5 光谱测试
1.5.1溶液的配制双咪唑盐C1溶液:配制浓度为1.0 mmol/L C1溶液,再稀释至适合紫外和荧光光谱测试的浓度。葫芦[8]脲-C1溶液:向浓度为1.0 mmol/L C1溶液中加入过量葫芦[8]脲,超声5 min 后离心除去未溶解的葫芦[8]脲。稀释至适合紫外和荧光光谱测试的浓度。金属离子溶液:将金属盐溶于葫芦[8]脲-C1溶液中,配制浓度为10.0 mmol/L的溶液。
1.5.2C1与葫芦[8]脲的紫外滴定紫外-可见光谱采用10 mm光程、容积为1.2 mL的微量比色皿。C1溶液和葫芦[8]脲-C1溶液浓度均为100 μmol/L。向比色皿中加入0.8 mL的C1溶液,通过计算,取出部分溶液再加入同样体积的葫芦[8]脲-C1溶液,调节葫芦[8]脲与客体C1的摩尔浓度比例。测量200~600 nm 波长范围的吸收光谱。
1.5.3C1与葫芦[8]脲的荧光滴定荧光发射光谱采用10 mm光程、容积为4.0 mL的常量比色皿。C1溶液和葫芦[8]脲-C1溶液浓度均为20 μmol/L。向比色皿中加入3.0 mL的C1溶液,通过计算,取出部分溶液再加入同样体积的葫芦[8]脲-C1溶液,调节葫芦[8]脲与客体C1的摩尔浓度比例。测定350~650 nm 波长范围的发射光谱。
1.5.4葫芦[8]脲-C1与金属离子的荧光滴定葫芦[8]脲-C1溶液浓度为20 μmol/L,金属离子溶液浓度为10 mmol/L,采用10 mm光程,容积为4.0 mL的常量比色皿。加入2.5 mL葫芦[8]脲-C1溶液,用移液枪由低倍到高倍逐步加入金属离子溶液。
2 结果与讨论
2.1 C1临界堆积浓度的测定
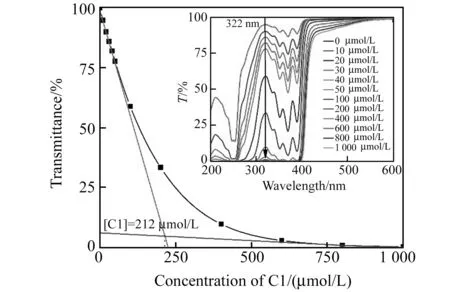
图3 不同浓度C1的紫外-可见(UV-Vis)透过率测定Fig.3 UV-Vis transmittance of C1 with different concentrations [C1](a-l):0 - 1.0 mmol/L.
为了确定后续的实验中C1可使用的浓度范围,我们测定了C1在水相体系下的临界堆积浓度。将配制的浓度为1.0 mmol/L的C1溶液稀释成不同的浓度,配制出浓度在10 μmol/L~1.0 mmol/L范围内的溶液。在相同的测试条件下,我们检测了不同浓度溶液的紫外-可见透过率,从图3中可以看出,随着溶液中C1浓度的增加,其紫外-可见透过率逐渐降低。以波长322 nm处的紫外透过数据为纵坐标,C1浓度为横坐标作图(图3),在低浓度下,化合物C1并未发生π-π堆积,此时溶液透过率与未发生堆积的C1的浓度成一次线性相关,我们在这一段区间内求出了其相关函数,并在图中绘制出函数图像;当C1的浓度较高时,大部分C1分子已经发生堆积,此时溶液透过率与发生堆积的C1的浓度成一次线性相关,同样,我们绘制出此时的函数图像。根据文献报道的处理方法[18],这两个函数图像的交点的横坐标即为C1的临界堆积浓度。因此得到C1的临界堆积浓度为212 μmol/L。
2.2 C1与葫芦[8]脲的核磁滴定
通过核磁积分,我们确定了核磁样品中C1∶葫芦[8]脲=1∶4。由于葫芦[8]脲在纯水中有一定的溶解度,给我们确定C1与葫芦[8]脲的结合比例带来一定的误差。为排除这一误差,通过内标法我们测定了葫芦[8]脲在纯水中的饱和浓度约为150 μmol/L。排除葫芦[8]脲自身在水中的溶解度,可认为C1与葫芦[8]脲的结合比为1∶3。从核磁滴定图谱中可以看出,加入葫芦[8]脲之后C1的活泼氢(咪唑基团7号位上的氢)在化学位移为8.8 ppm处显示出来。通常以重水作溶剂进行核磁检测时,由于活泼氢和重水中的氘存在H/D交换,活泼氢的质子信号不强或不被显示出来。Wang等人[19 - 20]曾报道过葫芦[n]脲的加入可以抑制咪唑阳离子活泼氢与重水间的H/D交换,我们观测到的现象与Wang等人的报道一致。
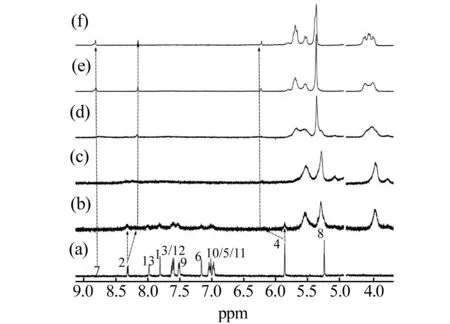
图4 C1(100 μmol/L)与不同比例葫芦[8]脲(葫芦[8]脲:C1)(a)0;b)0.8;c)1.6;d)2.4;e)3.2;f)4.0)的核磁滴定Fig.4 1H NMR spectra (D2O, 298 K) of 100 μmol/L C1 with addition of molar equivalents of CB[8]a:0;b:0.8;c:1.6;d:2.4;e:3.2;f:4.0.
比较图4中的曲线a和b,C1化学位移为8.3处H2(新铜试剂部分)上的质子峰出现分裂,一部分向高场移动,说明葫芦[8]脲先结合了C1新铜试剂部分;仍然有一部分未移动,说明此结合是一个核磁时间尺度的慢交换过程。化学位移为5.8 ppm处的H4亚甲基上的质子,信号向低场移动,说明此处的亚甲基位于葫芦[n]脲的端口附近。C1的大部分峰在加入葫芦[8]脲之后已无法观测到,不能做更细致的分析。对比图4曲线b、曲线c,我们可以看出葫芦[8]脲与C1的摩尔浓度比例从0.8增加到1.6时,5.60 ppm处葫芦[8]脲亚甲基上朝向空腔内部的质子的双峰出现分裂,说明葫芦[8]脲与C1的摩尔浓度比例为1.6时葫芦[8]脲结合了C1的两个不同的基团,我们推测此时葫芦[8]脲开始结合C1的蒽基团。从曲线c到曲线f,新出现的这个双峰积分逐渐变大,说明越来越多的葫芦[8]脲结合到蒽基团上,而且葫芦[8]脲与新铜试剂基团键合常数大于葫芦[8]脲与蒽基团的键合常数,可能是因为新铜试剂部分基团两端带正电荷,利于与葫芦[8]脲两端的羰基氧结合。通过核磁滴定,初步确定C1与葫芦[8]脲的包合模式。
2.3 C1与葫芦[8]脲的紫外滴定
C1的紫外-可见吸光光谱在352、370和390 nm波长处有三个吸收峰。由于加入葫芦[8]脲后三个峰的变化趋势相同(图5A),我们选择以为370 nm处的主峰进行分析。结果显示,葫芦[8]脲与C1的摩尔浓度比例为未达到1.0时,随着葫芦[8]脲浓度的增加,C1的紫外吸收强度降低。但葫芦[8]脲与C1的摩尔浓度比例为1.2时,在377 nm处出现一新的吸收峰,而且吸收峰的强度随葫芦[8]脲浓度的增加而增强;当葫芦[8]脲与C1的摩尔浓度比例达到3.0后,紫外吸收强度几乎不再变化。这符合我们之前得出的葫芦[8]脲优先结合C1中间新铜试剂部分的结论。
2.4 C1与葫芦[8]脲的荧光滴定
随着葫芦[8]脲摩尔浓度的增加C1荧光强度增强,说明葫芦[8]脲的加入对C1的荧光有增强作用(图5(B))[21 - 22]。此处我们选择370 nm作为激发波长,这个波长是蒽基团的吸收区间。荧光增强的主要原因是,蒽基团在水相体系中容易发生堆积,而葫芦[8]脲对蒽基团的包裹破坏了这种堆积,导致其荧光发射强度增大。葫芦[8]脲与C1的摩尔浓度比例达到4.0后,荧光增强的幅度达到了约5倍。
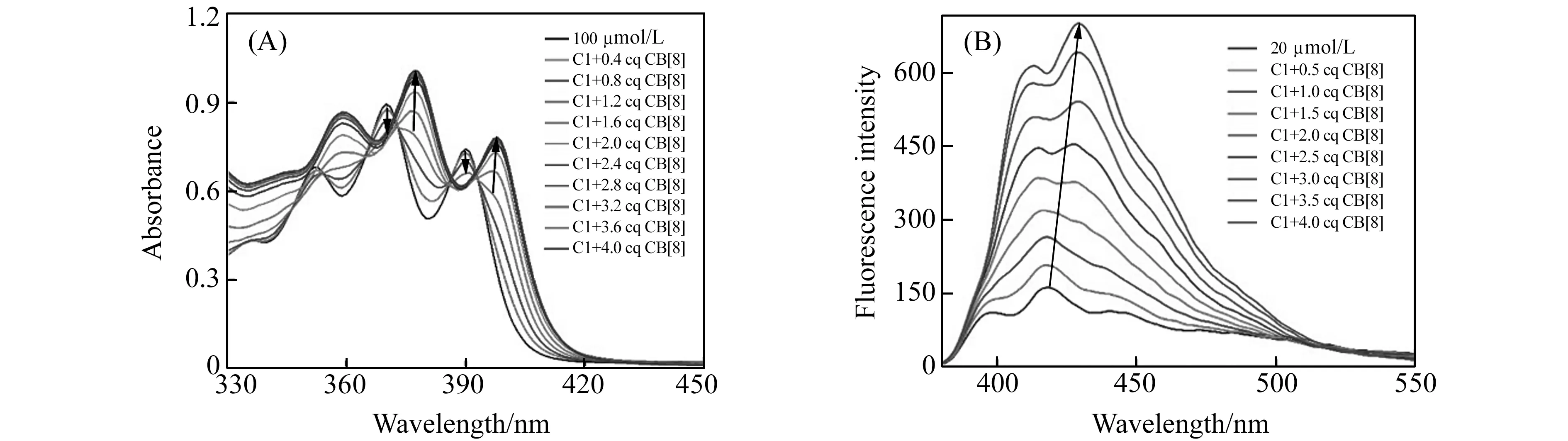
图5 (A)C1与葫芦[8]脲的紫外滴定、荧光滴定Fig.5 (A) UV-Vis absorption spectra of C1 titrated with CB[8] from 0 to 4.0 equivalent;(B) Fluorescence emission spectra of C1 titrated with CB[8] from 0 to 4.0 equivalent (excitation:370 nm)
2.5 葫芦[8]脲-C1与金属离子的荧光滴定
向葫芦[8]脲-C1溶液中加入金属阳离子时,其荧光强度降低,说明葫芦[8]脲-C1对于金属阳离子具有响应性。根据已有的报道,金属离子加入到葫芦[n]脲主客体包合物溶液中,往往可以改变主客体包合物的结合模式,或者由于金属离子与客体分子竞争结合葫芦[n]脲,可将客体分子从葫芦[n]脲的空腔中释放[23 - 24]。通过荧光滴定绘制Job’s plot,我们得到葫芦[8]脲与阳离子的结合模式[25]有1∶1和1∶2 两种(图6)。
在确定了金属阳离子与葫芦[8]脲的结合比例后,我们通过荧光滴定的方法求出了不同的金属离子与葫芦[8]脲的键合常数。以Fe3+为例,随着Fe3+浓度的增加,葫芦[8]脲-C1的荧光强度逐渐降低,Fe3+浓度达到C1的10倍后,继续加入Fe3+引起的C1荧光强度降低幅度越来越小,最终趋近于未加葫芦[8]脲时的C1的荧光强度(图7),说明金属阳离子加入引起的荧光强度降低是因为C1的蒽基团被从葫芦[8]脲的空腔中释放。取430 nm处的荧光数据进行作图拟合,拟合时按照1∶1和1∶2共存的模式,可以求出葫芦[8]脲与金属离子的键合常数。Fe3+与葫芦[8]脲的键合常数为4.3×108(mol/L)-2。按照同样的方法,我们对其它几种金属离子分别进行测定。所选的金属离子加入后,都引发葫芦[8]脲-C1溶液的荧光强度降低,不同的金属离子造成的降低幅度并不相同。金属离子与葫芦[8]脲的键合常数(K=K1×K2)见表1。
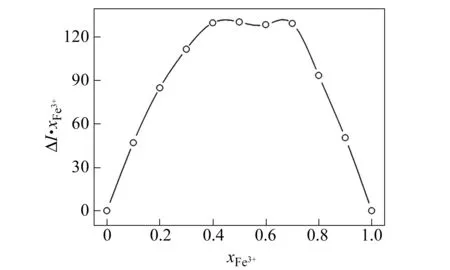
图6 葫芦[8]脲-C1与金属离子Job’s plot紫外滴定Fig.6 Job’s plot obtained for the CB[8]-C1 and metal ions systems
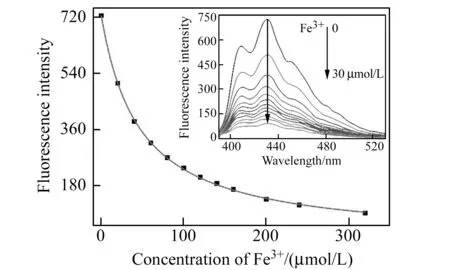
图7 Fe3+与葫芦[8]脲-C1的荧光滴定光谱Fig.7 Fluorescence spectra of CB[8]-C1 in H2O titrated with FeCl3
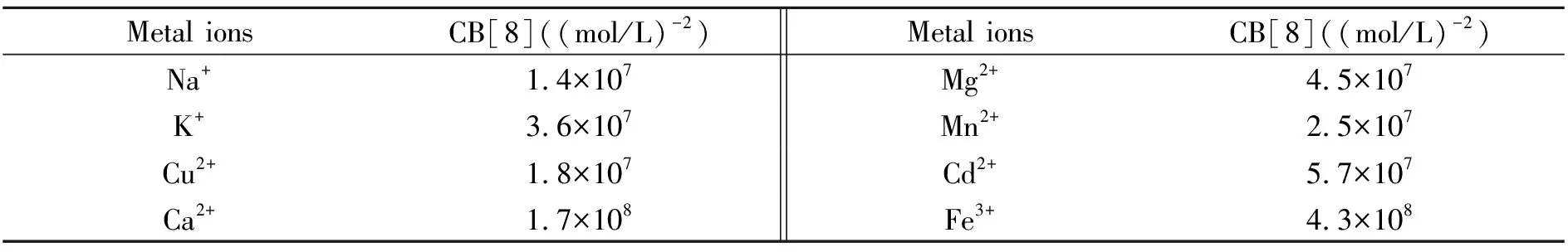
表1 葫芦[8]脲与几种金属离子的键合常数
3 结论
研究了含新铜试剂基团的双咪唑盐C1与葫芦[8]脲的包合模式,发现葫芦[8]脲与C1可形成3∶1的包合物,同时葫芦[8]脲的存在可以显著增强C1的荧光强度。进一步研究表明葫芦[8]脲-C1包合物对金属离子具有响应性。因此,将C1用作荧光指示剂,通过金属离子与C1竞争结合葫芦[8]脲,从而引发C1的发射光谱的变化,葫芦[8]脲对诸多金属离子的高亲和性表明其具有用于移除废水中金属离子的潜力。同时,葫芦[8]脲与金属离子的这种配位作用可被用于超分子器件的组装与调控中。

