非标记液晶生物传感器检测人类β防御素-2
苏秀霞, 霍文静, 栾崇林, 张 姣, 徐 佳
(1.陕西科技大学化学与化工学院,教育部轻化工助剂化学与技术重点实验室,陕西西安 710021; 2.深圳职业技术学院应用化学与生物技术学院,广东深圳 518088)
液晶(LCs)兼具液体的流动性和晶体的光学各向异性[1]。液晶分子的取向会因表面微小的形貌和化学结构变化而变化[2],从而呈现出不同的光学信号。此外,液晶具有一定的光学信号放大作用[3],当局部的液晶分子取向发生改变时,周围液晶分子的取向也会受到影响。因此,利用液晶具有双折射特性构建的液晶生物传感器,具有构造简单、成本低、无需标记,响应快速、所呈现的光学信号肉眼可观等优点,在生物检测方面具有潜在应用价值,目前液晶生物传感器在生物分子的分析检测领域已有涉及[4 - 8]。
防御素(Defensins)是广泛存在于动植物体内的一类富含半胱氨酸的碱性阳离子多肽[9],它能够有效抑杀革兰氏阴性菌、分枝杆菌、真菌等,具有广谱抗菌活性,在哺乳动物的先天免疫中起着重要作用[10]。人类β防御素-2(HBD -2)是一种肿瘤坏死因子在人嗜中性粒细胞中的特异性化学诱导物[11],它可以与体内病毒粒子共质化,形成寡聚体,从而降低艾滋病病毒(HIV)的感染性[12]。防御素在解决细菌耐药问题方面有独特的优势,是一种具有广泛应用前景的抗菌肽,故继续对防御素家族的检测方法进行研究具有重大意义。目前人类防御素的检测方法主要有狭缝印记测定法[13]、灰度分析法[14]、放射免疫检测法[15]、ELISA法[16,17]。然而,以上方法存在样品预处理繁琐,有的需要对抗原抗体进行标记,耗时长、成本高,且对操作人员要求高等问题。因此,寻求易操作、灵敏性较高、非标记、低成本的检测防御素的方法迫在眉睫。
本文结合液晶生物传感器无需标记等优点,利用直接免疫反应原理,提出了一种检测HBD -2的新方法。首先在自组装膜修饰的基底表面固定HBD -2抗体,通过免疫反应将HBD -2结合至传感器基底表面,从而使基底表面形貌发生变化,引起液晶分子的排列取向的变化,导致光学信号发生变化,以此实现对HBD -2的检测。
1 实验部分
1.1 仪器与试剂
XPL3230型透反两用数码偏光显微镜(上海光学仪器一厂);SPI3800N/SPA400型原子力显微镜(日本,精工有限公司);OCA20视频光学接触角(德国,Dataphysics公司);载玻片(江苏飞舟玻塑有限公司);Mylar聚酯片(广州市斯朗特电子科技有限公司)。
N,N-二甲基十八烷基(3-(三甲氧基硅丙基))氯化铵)(DMOAP)、3-氨丙基三乙氧基硅烷(APTES)均购自美国Sigma-Aldrich公司;HBD -2、HBD -2抗体均购自英国Abcam公司;4-氰基-4-戊基联苯(5CB)购自美国Instec公司;戊二醛(GA)购自国药集团化学试剂有限公司;其余试剂均为分析纯。水为超纯水。
1.2 实验方法
1.2.1载玻片预处理将载玻片切割为2.5×2 cm,用新配制的Piranha溶液(H2O2∶H2SO4=3∶7)于温度80 ℃浸泡2 h,依次用超纯水、无水乙醇冲洗,以洗净残余酸液,N2吹干,110 ℃干燥3 h,防尘备用。
1.2.2上、下载玻片的自组装上载玻片的DMOAP组装:将预处理后的玻片浸入0.5%(V/V)的DMOAP水溶液中,常温下静置30 min,超纯水冲洗干净,N2吹干,110 ℃干燥1 h,防尘备用。下玻片的APTES/DMOAP混合组装:将预处理后的玻片浸入3%(V/V)APTES和1%(V/V)DMOAP的乙醇溶液中,80 ℃恒温2 h,取出后依次用无水乙醇、超纯水冲洗干净,N2吹干,110 ℃干燥1 h,防尘备用。玻片醛基化处理:将经过混合组装的下玻片浸入2%(V/V)的GA的0.01 mol/L磷酸盐缓冲溶液(PBS,pH=7.2)中,于摇床中37 ℃恒温反应1 h,取出后依次用PBS(pH=7.2)、超纯水冲洗干净,以除去物理吸附的GA,N2吹干,4 ℃下保存,备用。
1.2.3HBD-2抗体的固定将HBD -2抗体溶解于0.01 mol/L的PBS(pH=7.2,含NaBH3CN)中,配制成不同浓度的HBD -2抗体溶液。取50 μL不同浓度的HBD -2抗体溶液滴加至醛基化的下玻片表面,37 ℃反应2 h,依次用0.01 mol/L PBS(pH=7.2)、超纯水冲洗,除去未固定的HBD -2抗体分子,N2吹干,4 ℃下保存,备用。
1.2.4直接免疫反应将固定有HBD -2抗体的玻片浸入80 mmoL/L甘氨酸溶液中,37 ℃反应30 min,以封闭未反应完的醛基。然后取50 μL不同浓度的HBD -2溶液滴加至固定有HBD -2抗体的玻片上,于温度37 ℃反应1 h,抗原抗体即可实现免疫反应,依次用0.01 mol/L PBS(pH=7.2)、超纯水冲洗,除去非特异性吸附物质,N2吹干,4 ℃下保存,备用。
1.2.5液晶生物传感器的性能分析液晶生物传感器的特异性检测:用甘氨酸溶液封闭未反应完的醛基后,将相同浓度的HBD -2、HBD -1(人类β防御素-1)、HBD -3(人类β防御素-3)、HNP -2(人类α防御素-2)分别滴加至固定有HBD -2抗体的玻片上,37 ℃反应1 h,依次用0.01 mol/L PBS(pH=7.2)、超纯水冲洗,N2吹干,4 ℃下保存备用。液晶生物传感器的可行性:用甘氨酸溶液封闭未反应完的醛基后,将HBD -2、HBD -1、HBD -3、HNP -2混合(混合试样样1,HBD -2的最终浓度为25 ng/mL)与HBD -1、HBD -3、HNP -2混合(混合试样2)各取50 μL分别滴加至固定有HBD -2抗体的玻片上,37 ℃反应1 h,依次用0.01 mol/L PBS(pH=7.2)、超纯水冲洗,N2吹干,4 ℃下保存,备用。
1.2.6液晶池的制作将处理后的上玻片与下玻片面对面组装,两片玻片之间用开凸型空腔的Mylar聚酯片隔开,小夹子固定除开孔方向外的其他三边。将液晶5CB于40 ℃恒温箱中加热,当其变澄清透亮后,从开孔处注入,毛细管作用会使液晶充满整个凸型空腔,自然冷却至室温(25 ℃)后,通过偏光显微镜观察液晶膜亮度的变化。
2 结果与讨论
2.1 液晶生物传感器的检测原理
实验的检测原理如图1所示,先在经过醛基化处理的玻片表面固定HBD -2抗体,然后滴加不同浓度的HBD -2,HBD -2与HBD -2抗体特异性结合后,扰乱了液晶的取向(图1F),导致光学信号发生变化。当未加入HBD -2时,由于组装的HBD -2抗体体积较小,不足以扰乱液晶的垂直取向(图1E),从而出现全黑的偏光显微图像。而当存在HBD -2时,它能够与固定在基底表面的HBD -2抗体特异性结合,当达到一定的量时会扰乱液晶分子的有序排列,造成光学信号的改变,从而实现对HBD -2的快速无标记检测。
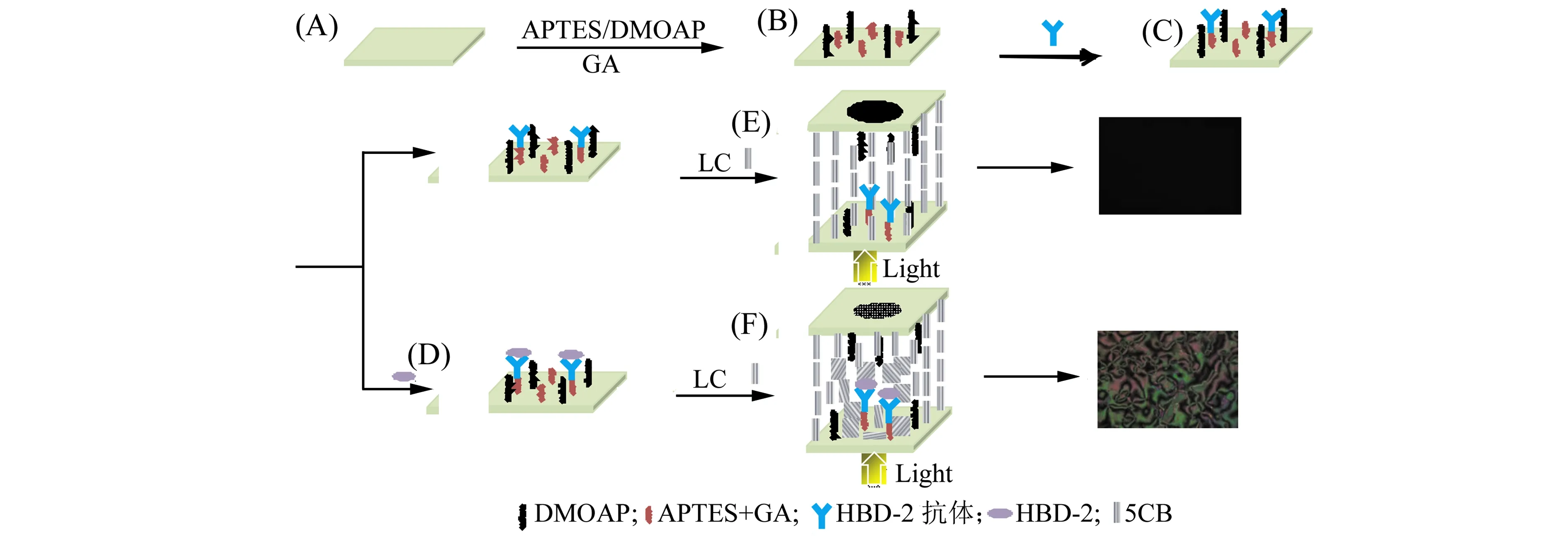
图1 液晶生物传感器检测HBD -2示意图及液晶池的组装过程Fig.1 The stepwise assembly of liquid crystal(LC) biosensor stubstrate(A) cleaned glass;(B) mixed self-assembled DMOAP/APTES/GA;(C)anti-HBD -2 immobilized;(D) the specific binding of anti-HBD -2 antibody and HBD -2;(E) Liquid crystal 5CB molecules are arranged vertically without adding HBD -2;(F) Specific binding of HBD -2 antibody to HBD -2 disrupts the vertical orientation of liquid crystal 5CB molecules.
2.2 基底表面APTES/DMOAP/GA自组装膜比例优化
如图2所示,当APTES/DMOAP比例较高时(25∶1,图2A),由于玻片上固定的DMOAP的量相对较少,不能有效诱导液晶分子垂直排列,光学信号呈现的图像出现亮斑大且多;当APTES/DMOAP比例减小时,光学信号的成像中亮斑也逐渐减少,当两者比等于或小于5∶1时(图D、E、F),光学信号的成像均为均一黑色背景。为了使基底既能诱导液晶垂直排列又能提供足够的氨基键合戊二醛,继而固定生物分子,选择APTES/DMOAP比例为5∶1和3∶1进一步探讨戊二醛的比例。
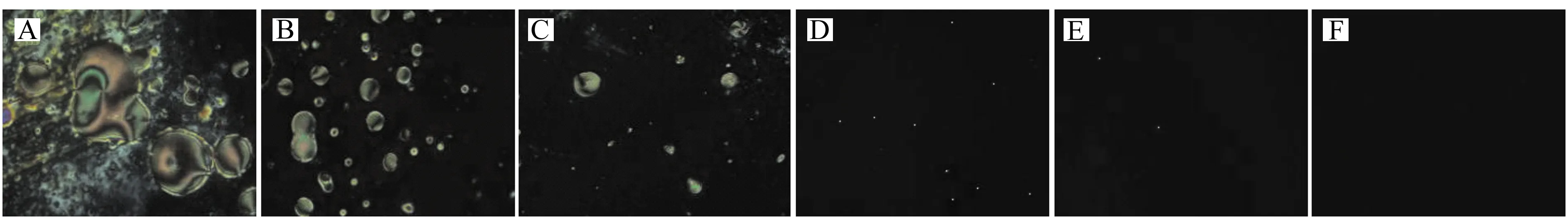
图2 不同体积比的APTES/DMOAP基底自组装膜制备的液晶池光学成像Fig.2 Optical images under crossed polarizers of LC cells with 5CB sandwiched between a DMOAP-coated glass slide and an APTES/DMOAP-decorated glass slidethe APTES/DMOAP ratios(V/V) are(A)25∶1;(B)20∶1;(C)10∶1;(D)5∶1;(E)3∶1;(F)1∶1.
戊二醛分子两端均为醛基(-CHO),其一端与基底表面裸露的氨基发生键合反应,另一端用于链接生物分子。如图3所示,当APTES/DMOAP比例为5∶1,GA含量为3%时,光学成像中呈现较大彩色亮斑(图3A)。当GA含量减少到2%时,图像中亮斑减少(图3B);当GA含量减少到1%时,图案呈现全黑背景(图3C)。当APTES/DMOAP比例为3∶1,GA含量为3%时,光学成像中出现较大的彩色亮斑(图3D)。当GA含量减少到2%时,图案呈现全黑背景不干扰生物分子检测(图3E)。为了不产生干扰背景,且有足够的醛基固定更多的HBD -2,选择APTES/DMOAP比例为3∶1,GA含量2%(V/V)。
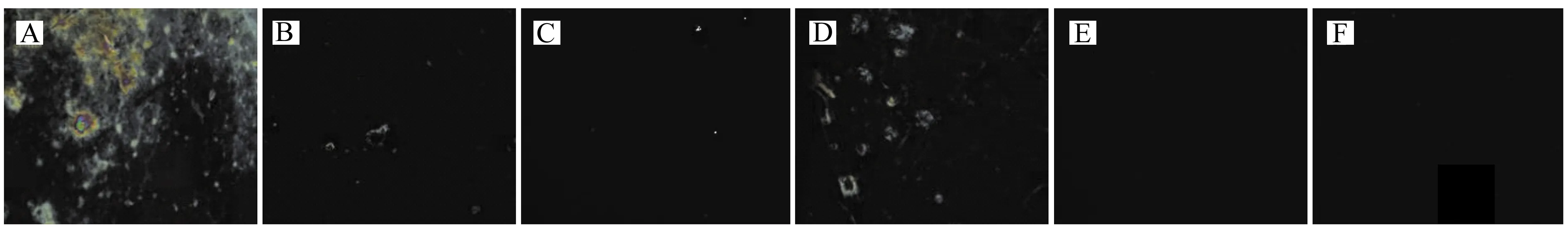
图3 GA含量对液晶池光学成像的影响Fig.3 Effect of GA content on optical imaging of liquid crystalthe APTES/DMOAP ratios(V/V)are 5∶1,the GA ratios(V/V) were 3%(A);2%(B);1%(C);the APTES/DMOAP ratios(V/V)are 3∶1,the GA ratios(V/V) were 3%(D);2%(E);1%(F).
通过测量基底的水接触角大小可以进一步确定组装膜的性能。图4为组装了不同硅烷化试剂后基底表面的水接触角示意图。从图中可以看出,酸处理后的玻片表面由于产生大量羟基,亲水性增强,水滴在其基底表面几乎完全铺展;当基底表面组装DMOAP后,由于DMOAP的长链会使基底表面能降低,所以疏水性明显增强,水滴在其表面几乎成球形,接触角为89.6°(图4B);当玻片基底组装APTES后,基底膜表面含有大量氨基,疏水性较DMOAP会有所降低,接触角为61.2°(图4C);当APTES/DMOAP(3∶1)组装后基底表面的水接触角为72°(图4D),疏水性介于用DMOAP和APTES单独组装之间。采用APTES/DMOAP(3∶1)/2%GA组装后基底表面的水接触角为80.4°(图4E)。文献报道[18]当基底膜的水接触角低于64°时,其表面液晶分子会从垂直取向变为倾斜或平行排列。因此,水接触角实验也证明了采用APTES/DMOAP(3∶1)/2%GA比例组装的玻璃基底能有效诱导液晶分子垂直排列。

图4 玻璃基底及其组装后的水接触角示意图Fig.4 Water contact angles on different materials coated glass slides(A)Bare glass slide(Acid-treated bare glass);(B)DMOAP;(C)APTES;(D)APTES/DMOAP(3∶1);(E)APTES/DMOAP(3∶1)/2%GA.
2.3 固定化HBD -2抗体浓度的优化
如图5所示,随着固定化HBD -2抗体浓度的减小,对液晶取向扰乱减小,液晶池光学成像逐渐变暗。当固定化HBD -2抗体浓度为低0.5 μg/mL时,光学成像几乎为全黑(图5D、5E)。由于需要足够的抗体与抗原反应,因此选择能够使光学成像背景保持黑暗的最高固定化HBD -2抗体浓度0.5 μg/mL固定于基底表面。
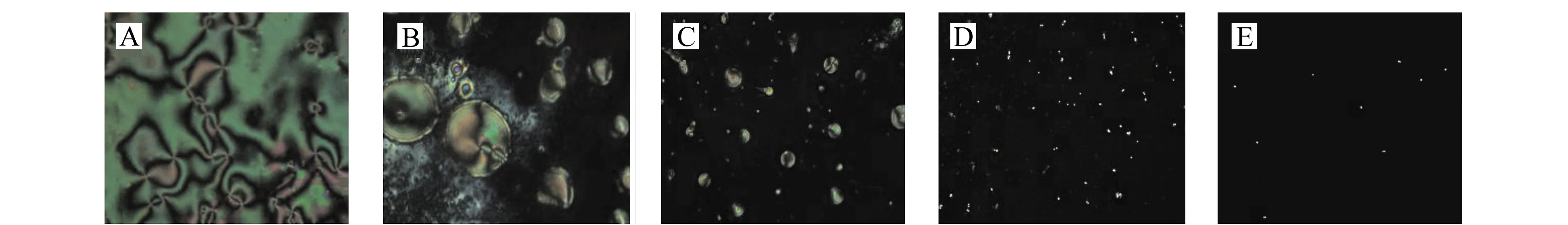
图5 不同浓度的固定HBD -2体制备的液晶池光学成像Fig.5 Optical images under crossed polarizers of LC cells with 5CB sandwiched between a DMOAP-coated glass slide and an APTES/DMOAP/GA-decorated glass slide with anti-HBD -2 immobilizedThe concentrations of anti-HBD -2 are(A)5.0;(B)2.0;(C)1.0;(D)0.5;(E)0.2 μg/mL.respectively.
2.4 HBD -2的检测
HBD -2与HBD -2抗体特异性结合之后被固定于传感基底表面,随着HBD -2浓度的增加,液晶池光学成像逐渐变亮。如图6所示,当HBD -2浓度为1.0 ng/mL时,光学信号呈现的图像几乎为全黑色(图6F),此时不能够诱导液晶的取向改变。HBD -2浓度高于5.0 ng/mL(图6A、B、C、D),可观测到明显的光学图像变化,显示了良好的检测灵敏度。
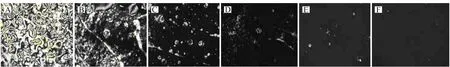
图6 不同浓度的固定化HBD -2制备的液晶池光学成像Fig.6 Optical images under crossed polarizers of LC cells with 5CB sandwiched between a DMOAP-coated glass slide and an APTES/DMOAP/GA-decorated glass slide with HBD -2 immobilizedThe concentrations of HBD -2 are(A)300;(B)100;(C)50;(D)10;(E)5;(F)1 ng/mL,respectively.
2.5 液晶生物传感器的特异性测定
为了检验本方法的特异性,分别考察了液晶对HBD -1、HBD -3、HNP -2的偏光信号变化(浓度均为100 ng/mL)。结果如图7所示,HBD -2抗体与HBD -2结合后的光学图像呈现明显亮斑,而对照组中HBD -1(图7B)、HBD -3(图7C)、HNP -2(图7D)的光学图像中则仅有少数亮点。实验表明,基于HBD -2抗体的液晶生物传感器能够特异性结合HBD -2,从而实现对HBD -2的检测。

图7 固定相同浓度的不同抗菌肽所制备的液晶池光学成像Fig.7 Optical images under crossed polarizers of LC cells with 5CB sandwiched between a DMOAP-coated glass slide and an APTES/DMOAP/GA-decorated glass slide with different antimicrobial proteinsThese proteins are(A)HBD -2;(B)HBD -1;(C)HBD -3;(D)HNP -2 100 ng/mL respectively.
2.6 液晶生物传感方法的可行性
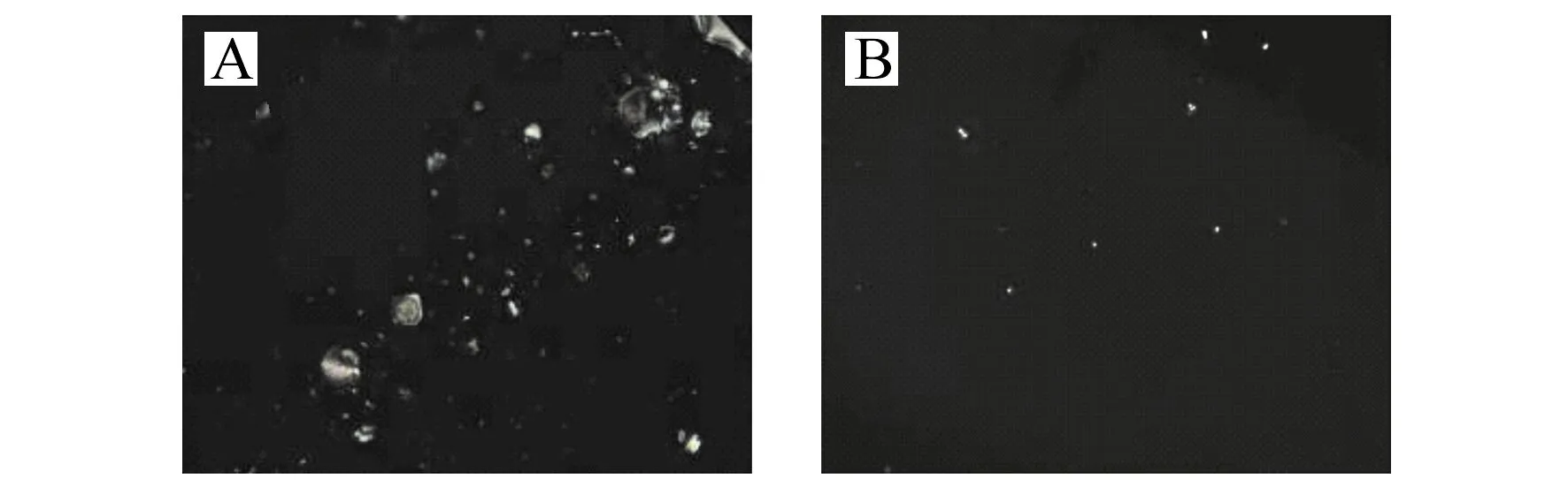
图8 不同混合试样所制备的液晶池光学成像Fig.8 Optical images under crossed polarizers of LC cells with 5CB sandwiched between a DMOAP-coated glass slide and an APTES/DMOAP/GA-decorated glass slide with different mixed samples(A)Mixed sample 1 consists of HBD -2,HBD -1,HBD -3,HNP -2;(B) Mixed sample 2 consists of HBD -1,HBD -3,HNP -2.
为了检验本方法的实际可行性,分别考察了将HBD -2、HBD -1、HBD -3、HNP -2混合(混合试样样1,HBD -2的最终浓度为25 ng/mL)与HBD -1、HBD -3、HNP -2混合(混合试样2)后传感器的偏光信号变化。结果如图8所示,当传感器基底固定的HBD -2抗体与含有HBD -2的混合试样1反应后光学图像中出较明显的亮斑(图8A),而混合试样2的光学图像中仅有少数亮点(图8B)。实验表明,基于HBD -2抗体的液晶生物传感能够检测混合试样中的HBD -2,方法具有一定的实际可行性。
3 结论
本文利用液晶的双折射特性,采用直接免疫反应原理,建立了一种检测人类β防御素-2的非标记型液晶生物传感器。当人类β防御素-2的含量高于5.0 ng/mL时,可观测到明显的光学图像变化。本方法无需标记,易于操作,灵敏度较高,特异性好,有望用于多种类型抗菌肽的检测中。

