BCAR3、SCEL及LIFR mRNA在帕金森病患者血清胞外囊泡中异常表达
刘 郁,张静静,吕荣祥,王文盛
帕金森病(Parkinson’s disease,PD)是一种神经退行性疾病,主要表现为运动功能进行性减退,其发病机制与脑黑质或大脑基底神经节细胞死亡或功能异常有关[1],且多数PD患者表现为神经元病理性蛋白质累积[2]。尽管如此,PD发生发展的分子机制仍未完全阐明,深入开展PD相关的分子标志物研究对于该病的早期诊断以及治疗研究至关重要。越来越多的证据表明,血清来源的胞外囊泡(extracellular vesicles,EVs)可通过其携带的蛋白质、核酸、脂类等来调节受体细胞的生物学活性,因其稳定性好、不易降解、取材方便,可为疾病诊断、治疗及基础研究提供大量有价值的信息,已经成为多种疾病研究的热点[3],但其在PD中的研究却十分有限。
本研究通过表达谱芯片分析了PD患者与健康个体血清EVs中mRNA表达差异,探索存在于PD患者血清EVs中新的异常表达基因,为PD相关的诊断和神经保护研究提供理论基础。
1 资料与方法
1.1 研究对象 收集2016年1月~2017年11月于我院神经内科确诊的PD患者22例,健康对照个体16例。PD患者纳入标准:(1)符合2015年国际运动障碍协会的帕金森病诊断标准[4];(2)无严重基础性疾病和其他内科合并症;(3)无精神类疾病,能够配合研究。排除标准:(1)由于药物、创伤或其他脑血管疾病等已知原因引起的继发性PD;(2)近期接受过药物治疗的PD患者;(3)早发性帕金森患者(起病年龄≤50岁)。本研究经宁波市第六医院伦理委员会批准,所有受试者均已签署知情同意书。
1.2 血清胞外囊泡提取、鉴定及RNA提取 收集受试者外周血5 ml,待血液凝固后3000 rpm离心10 min,小心将上清吸出备用。血清EVs及其RNA提取采用exoRNeasy Serum/Plasma Maxi Kit试剂盒(QIAGEN),具体方法参照生产商说明书。为观察血清EVs形态,将Buffer XE洗脱下来的外泌体滴加在载样铜网上,待其干燥后用1%的乙酸双氧铀负染,负染后用透射电子显微镜观察EVs结构。
1.3 mRNA表达谱芯片分析 PD患者及健康个体血清EVs来源的RNA经定量后,采用Affymetrix GeneChip®Human Genome U133 Plus 2.0芯片(Thermo Fisher Scientific)进行mRNA差异表达分析,每个RNA样品上样量为300 ng,具体操作方法参见生产商提供的说明书及早期报道[5]。R软件对PD患者及健康个体血清EVs mRNA表达水平进行差异分析,log2Fold Change(FC)>2或<-2,且P<0.01时,认为差异基因具有统计学意义。
1.4 实时定量PCR反应 实时定量PCR反应(qRT-PCR)用于差异表达基因验证。引物序列经Primer premier 5.0和Oligo 6.0软件设计后,由Invitrogen公司(Thermo Fisher Scientific)合成。M-MuLV第一链cDNA合成试剂盒(上海生工生物工程公司)用于RNA反转录,产物cDNA作为RT-PCR模板用于基因表达分析。使用MaximaTMSYBR Green qPCR Master Mix(Applied Biosystems,Foster City,CA,USA)试剂,以cDNA为模板,采用ABI 7500实时PCR检测系统(Applied Biosystems)进行实时定量PCR,GAPDH作为内对照,以2-△△CT进行相对定量分析,所有实验独立重复3次,以确定EVs中mRNA相对水平。
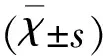
2 结 果
2.1 受试者一般资料比较 健康对照个体中,男9例(56.3%),女7例(43.8%),平均年龄(58.26±3.23)岁;PD患者中,男10例(45.5%),女12例(54.5%),平均年龄(57.51±2.19)岁。两组受试者性别(χ2=0.432,P=0.511)及年龄(t=0.5847,P=0.575)间无统计学差异(P>0.05),两组间具有可比性。
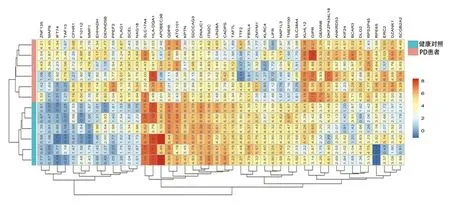
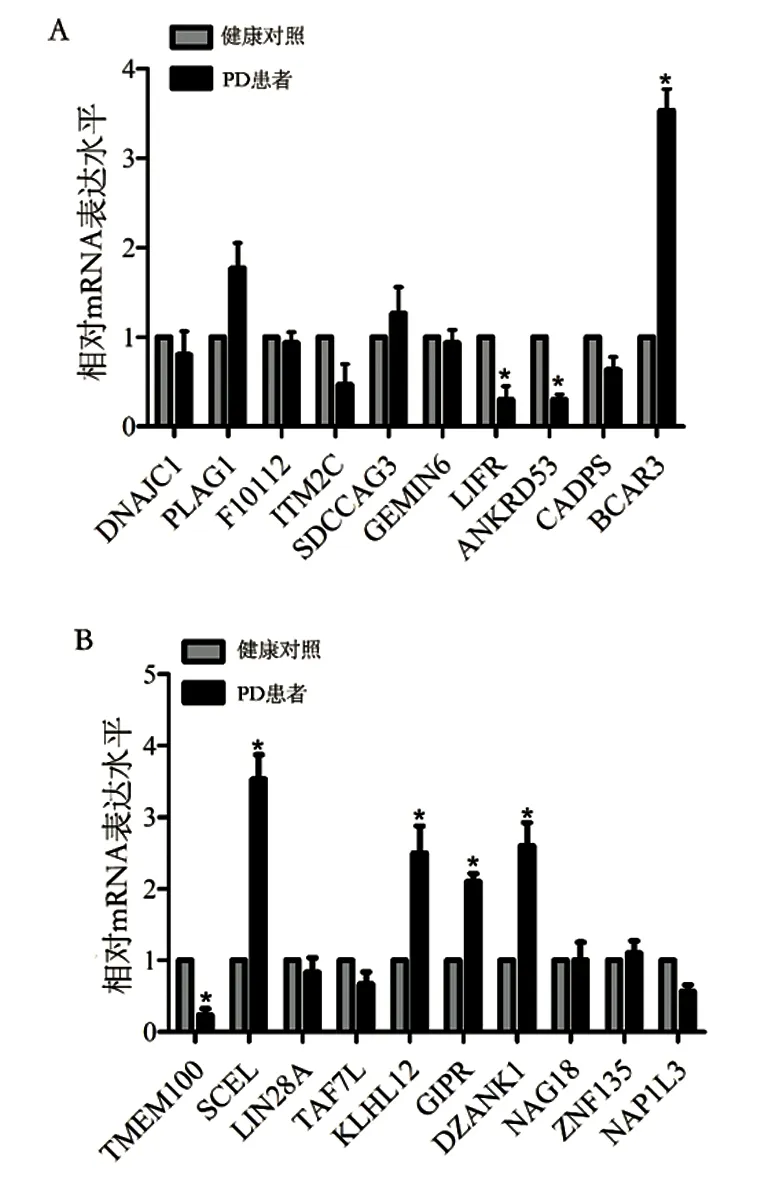
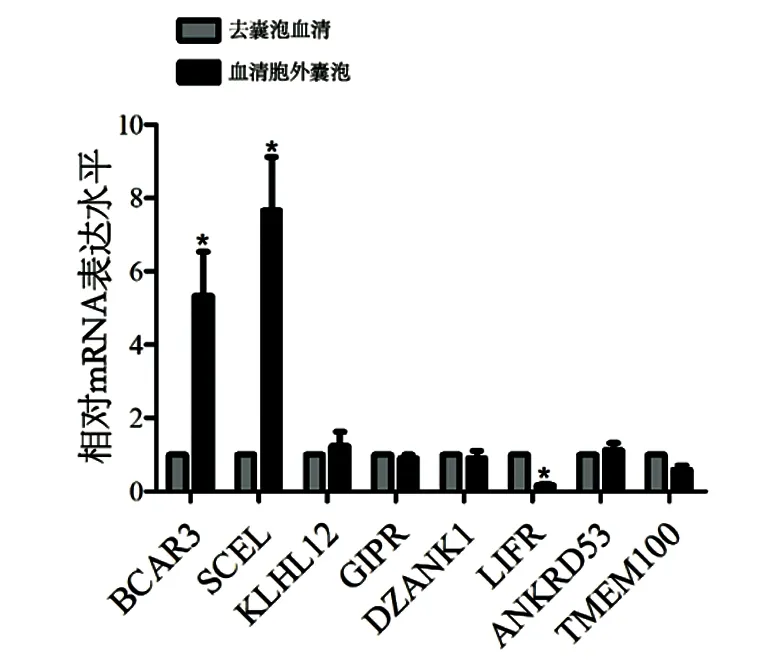
2.2 PD患者血清EVs中46个mRNA异常表达 EVs洗脱液经负染后,可在透射电子显微镜下观察到直径约30~100 nm的小囊泡,结果证实已从受试者血清中提取到EVs(见图1)。经表达谱芯片分析发现,与健康对照个体(n=6)相比,PD患者(n=6)血清EVs中有46个mRNA表达水平存在显著差异,其中26个mRNA显著上调,20个mRNA显著下调(2 2.3 PD患者血清EVs中8个mRNA持续异常表达 qRT-PCR进一步验证上述差异mRNA在健康对照个体(n=16)和PD患者(n=22)血清EVs中的表达。结果发现,与健康对照个体相比,BCAR3(t=10.58,P=0.0005)、SCEL(t=7.517,P=0.0017)、KLHK12(t=3.988,P=0.0163)、GIPR(t=9.601,P=0.0007)、DZANK1(t=5.008,P=0.0074)在PD患者血清EVs中持续上调;而LIFR(t=4.514,P=0.0107)、ANKRD53(t=11.89,P=0.0003)和TMEM100(t=8.561,P=0.0010)在PD患者血清EVs中持续下调(见图3A、B)。 2.4 BCAR3、SCEL及LIFR特异性存在于PD患者血清EVs中 为明确持续差异表达的8个mRNA是否特异存在于PD患者血清EVs中,qRT-PCR分别检测了这些mRNA在PD患者血清EVs和去EVs血清中的相对水平。结果发现,与去EVs的血清相比,BCAR3和SCEL在PD患者血清EVs中表达水平显著上调(t=3.614,P=0.0225;t=4.595,P=0.0101),LIFR在PD患者血清EVs中表达水平显著下调(t=24.34,P<0.0001)(见图4)。ANKRD53、TMEM100、GIRP、DZANK1及KLHL12在PD患者血清EVs和去EVs的血清间表达水平无统计学差异(P>0.05)。以上结果证实,BCAR3、SCEL及LIFR特异性存在于PD患者血清EVs中。 表1 PD患者血清EVs中显著差异表达的前20个基因 基因名变化倍数(log2FC)平均表达量t值P值DNAJC1PLAG1F10112ITM2CSDCCAG3GEMIN6LIFRANKRD53CADPSBCAR3TMEM100SCELLIN28ATAF7LKLHL12GIPRDZANK1NAG18ZNF135-2.0601923582.6293150593.130124828-2.026310693-2.2186852652.448153441-2.5354686642.121684895-2.2376487792.583387417-2.291713332.085607137-2.024172141-2.0037439472.2145528842.2811482122.3717337032.1880041642.0953708325.0851773.0699282.6108355.0974374.6403064.1965573.1601443.8547644.5678183.6105753.4621092.8638324.3621084.3032115.3507085.2638763.8532283.0692441.897475-9.086648.2640596.147836-5.90764-5.292725.175882-5.075074.759949-4.738454.68193-4.653554.535008-4.30904-4.287284.2441354.1740124.1245424.0281073.8648326.48E-071.84E-063.88E-055.69E-050.0001580.0001920.0002290.0003970.0004130.0004560.000480.0005940.0008940.0009310.0010070.0011460.0012550.00150.002034 图1 典型的血清EVs电镜图 图2 健康个体及PD患者血清EVs中差异基因热图 图3 qRT-PCR验证健康个体及PD患者血清EVs中差异mRNA的表达*P<0.05 图4 持续差异mRNA在PD患者血清EVs及去EVs血清中的表达*P<0.05 本研究采用表达谱芯片对比分析了PD患者和健康个体血清EVs中差异表达的mRNA,实时定量PCR对差异表达基因进行验证。结果发现,BCAR3、SCEL、KLHK12、GIPR、DZANK1在PD患者血清EVs中表达水平持续上调,LIFR、ANKRD53和TMEM 100表达水平持续下调。其中,BCAR3、SCEL及LIFR在PD患者血清EVs和去EVs的血清中存在显著差异。本研究结果首次证实,BCAR3、SCEL及LIFR在PD患者血清EVs中表达水平异常改变,且特异存在于PD患者的EVs中。 随着精准医学的快速发展,探索与PD发生发展相关的分子靶标可以增强我们对疾病的认识[6]。近年来,研究发现血清EVs可以递送大量的生物活性物质到受体细胞,参与多种疾病的发生发展。这些生物活性物质包括miRNA、lncRNA、mRNA、DNA、蛋白质及脂质等,其中以miRNA含量最多,研究最为广泛[7]。越来越多的与PD发生发展相关的EVs内容物逐渐被发现[8]。例如,PD患者尿液EVs中Ser(P)-1292 LRRK2水平升高,并与患者的意识障碍程度和自理能力密切相关[9]。Cao等人研究发现PD患者血清EVs中miR-19b表达水平下调,miR-195和miR-24表达水平上调,它们在血清中的表达水平可能有助于PD诊断[10]。此外,研究还发现PD患者脑脊液EVs中含有高水平的α-突触核蛋白,被受体细胞吸收后可引起细胞毒性[11,12]。然而,有关PD患者血清EVs中mRNA差异表达的研究则十分有限。本研究首次通过表达谱芯片分析了PD患者血清EVs中差异表达的mRNA,经PCR验证后发现,BCAR3、SCEL、KLHK12、GIPR、DZANK1在PD患者血清EVs中表达水平上调,LIFR、ANKRD53和TMEM 100表达水平下调。 体液EVs RNA已经成为多种疾病诊断及预后研究的热点,特别是血清EVs中的RNA因其具有较好的稳定性且取材方便,已具备较好的临床应用前景[13]。然而,以往报道的血清标志物主要以游离于血清中的分子为主,本研究则重点关注了PD和正常对照个体血清EVs中差异表达的mRNA。为了进一步证实这些差异表达的mRNA是否特异地存在于血清EVs中,我们分别检测了这些差异基因在PD患者血清EVs以及去除EVs后血清中的表达。结果发现,乳腺癌抗雌激素药物耐药性基因3(Breast cancer anti-estrogen resistance gene 3,BCAR3)和Sciellin蛋白(SCEL)在PD患者血清EVs中的表达水平显著高于去除EVs的血清,而白血病抑制因子受体(LIF receptor alpha,LIFR)在PD患者血清EVs中的表达水平则显著低于去EVs的血清。由此证实,BCAR3、SCEL及LIFR是特异性地存在于PD患者血清EVs中的差异表达基因。 由于PD的发生发展与大脑神经元损伤密切相关[14],而血清EVs又非常容易穿过血脑屏障将分子特异性地递送到中枢神经系统[15],因此EVs中异常表达的分子很可能通过不同的信号转导途径参与PD进展。然而,目前有关BCAR3、SCEL及LIFR在PD发生发展中作用机制的研究十分有限。LIFR主要参与细胞分化、增殖和存活,其信号转导途径在神经系统发育中起关键作用,并在PD患者海马和扣带回部位表达水平显著上调[16],但其影响PD进展的可能机制尚未报道。本研究发现,LIFR表达水平在PD患者血清EVs中显著下调,但其功能仍有待于进一步研究。BCAR3可导致乳腺癌细胞雌激素非依赖性增殖,与乳腺癌发生发展密切相关[17,18]。同样,有研究发现SCEL低表达与结直肠癌的迁移及侵袭能力增强有关[19]。然而,BCAR3和SCEL与PD发生发展间的关系目前尚未被报道。 总之,本研究首次发现BCAR3、SCEL、KLHK12、GIPR、DZANK1在PD患者血清EVs中表达水平上调,LIFR、ANKRD53和TMEM 100表达水平下调。其中,BCAR3、SCEL及LIFR是特异存在于PD患者血清EVs中的差异表达基因。本研究也存在一定的局限性,例如缺少机制研究,尚不能进一步明确上述差异表达的mRNA在PD发生发展中的具体作用,今后仍需在临床水平、动物水平及细胞分子水平进一步探讨其可能的机制。然而,目前的结果可以明确血清EVs中BCAR3、SCEL及LIFR在PD患者中异常表达,可能与PD发生发展密切相关,本研究结果将为EVs相关PD早期诊断以及神经保护研究提供了初步的理论依据。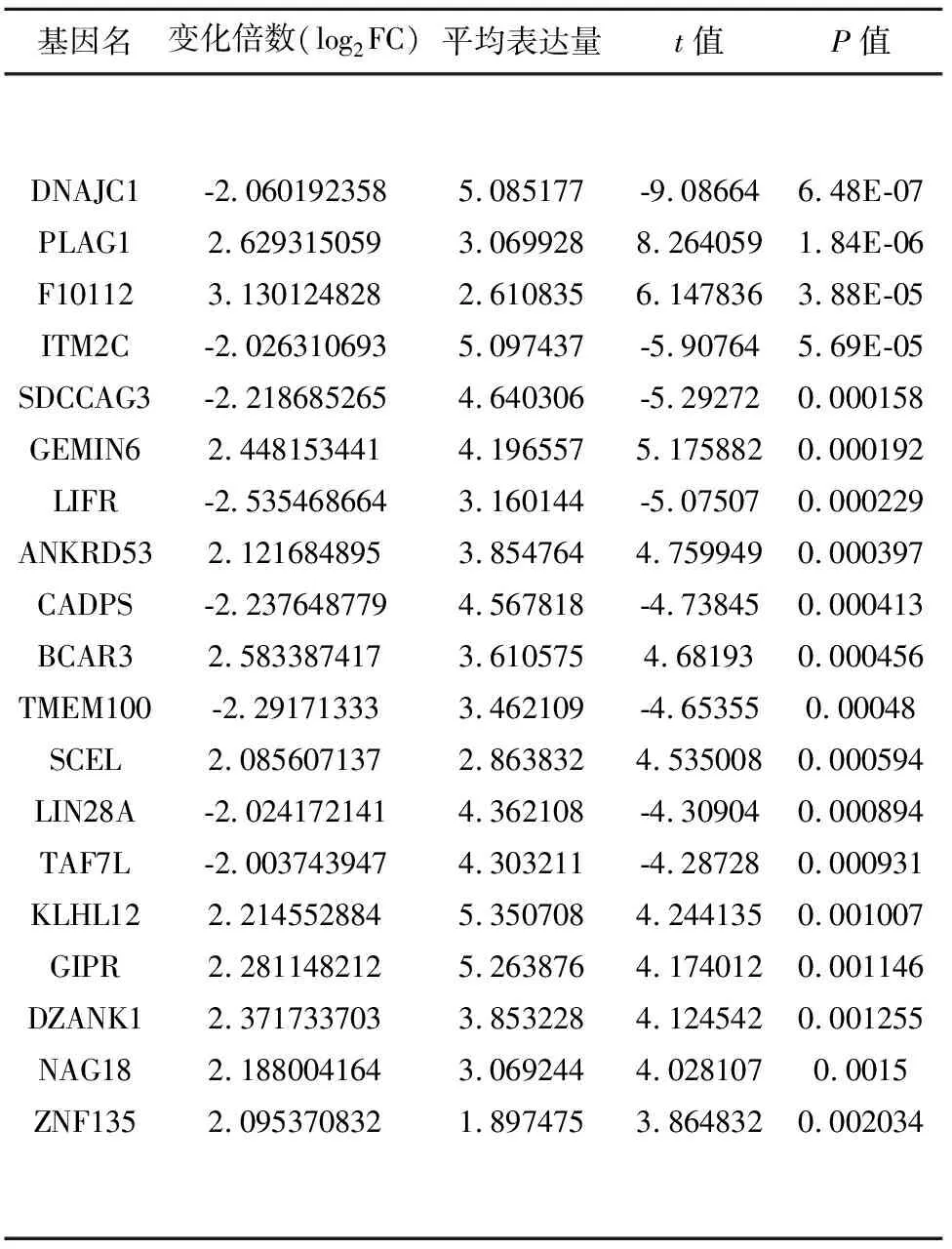

3 讨 论

