基于环糊精自组装的纳米药物与基因载体研究进展
郑姣妮,廖荣强,,杨 波
(1. 重庆市急救医疗中心 重庆大学附属中心医院 重庆市第四人民医院药剂科,重庆 400014)(2. 昆明理工大学生命科学与技术学院,云南 昆明 650500)
1 前 言
2016年诺贝尔化学奖授予了Jean-Pierre Sauvage,J Fraser Stoddart以及Bernard L Feringa,以表彰3位科学家对“纳米分子机器的设计与合成”做出的卓越贡献[1]。从长远的眼光看,随着精准医学的开展,分子机器很有可能会在纳米医学领域大显身手,并同时有望把肿瘤等相关疾病的治疗带入一个全新的维度。近年来,在构筑“纳米分子机器”技术方面取得了一系列的创新性突破,利用这些技术可以更加快捷、方便、灵活地构建各种纳米药物与基因载体。超分子非共价键自组装技术长期以来一直是纳米生物技术的研究热点之一。利用非共价键自组装的特点可以构筑出具有新型结构与功能的超分子组装体,这对于探索和设计具有新型功能的纳米药物与基因载体具有重要意义。
自组装(self-assembly)是指无序分子之间在无需外力干预和控制下,能自发聚集、组织成有序结构的现象[2]。小分子通过自组装可以成功构建为纳米结构材料[3]。利用自组装方法构筑高度有序与低缺陷的纳米结构材料是一种极具应用前景的制造技术,已被广泛应用于形貌各异的纳米结构材料的构建[4]。通过自组装形成的纳米结构材料具有独特的物理和化学性能,可应用于纳米药物与基因载体。然而,自组装通常是自发的热力学过程,难以人为干预和控制,因此该类纳米材料的尺寸与功能调控仍是一种挑战[5]。
自组装纳米结构材料的形成主要是小分子砌块在非共价键相互作用下自发组织或聚集的结果,其中的非共价键相互作用主要包括疏水相互作用、氢键以及范德华力等[6]。分子识别(molecular recognition)是自组装的前提步骤,分子与分子之间若无法完成识别过程,就无法进行下一步的自组装行为[7]。分子识别是指某一特定的受体分子选择性地接纳特定形状大小的配体分子的过程,在此过程中分子相互之间能寻找出最安定、最接近的部位,并组装出超越单个分子性能的高次结构聚集体[8]。总的来说,自组装手段可以方便、灵活、快捷地将不同功能的生物材料整合到一体,这是很难通过普通化学手段合成的。因此,通过分子识别与自组装构筑的纳米功能材料往往具有多种物理与化学性能。
环糊精(cyclodextrin, CD)是由D-吡喃葡萄糖单元通过α-1,4-糖苷键连接构成的中空的截锥状化合物,截锥表面具有亲水性,截锥内部具有疏水性,其中α-、β-和γ-CD环糊精最为常见,它们分别由6、7和8个葡萄糖单元组成,图1给出了环糊精的立体结构示意图[9]。环糊精主客体包合技术已被广泛用于制药技术领域。最近几年,通过环糊精自组装构筑的具有不同性质和形貌的纳米药物与基因载体已经大量涌现。该类载体能提高药物生物利用度、降低毒副作用。例如,Davis等[10]首次报道了通过阳离子基团耦合环糊精组建阳离子低聚物,且该低聚物能成功与siRNA组合形成非病毒基因载体,目前已在Ⅰ期临床试验中治疗人类黑色素瘤[10]。该团队还构筑了环糊精-聚乙二醇共聚物,同时在该共聚物上共价接枝了喜树碱,形成载有喜树碱的纳米药物(CRLX101),该药物目前正在进行Ⅱ期临床试验[11]。此外,环糊精还具有降低胆固醇的作用,可用于心血管疾病的治疗[12],基于环糊精的纳米药物与基因载体临床试验如表1。
本文基于作者课题组对环糊精的基础研究,总结了近年来国内外利用环糊精构筑的纳米药物与基因载体的研究进展,并对它们的潜在应用价值进行了简单讨论。

图1 环糊精的立体结构示意图[9]Fig.1 Schematic of the spatial structure of cyclodextrin[9]

DrugDiseasePhaseStatusClinical IDStart date-Last updated dateCRLX101 aSolid TumorPhaseⅠ/ⅡCompletedNCT00333502May 2006-Apr 2017Not ProvidedCompletedNCT01612546Nov 2012-Jun 2015PhaseⅡTerminatedNCT01803269Jan 2013-Jun 2016PhaseⅠ/ⅡRecruitingNCT02769962May 2016-Jun 2017CALAA-01 bSolid TumorPhaseⅠTerminatedNCT00689065May 2008- Oct 2013ObesityNot ProvidedCompletedNCT00682916May 2008-May 2017CyclodextrinsSphingolipidosisPhaseⅠCompletedNCT01747135Jan 2013-Apr 2017PhaseⅡ/ⅢRecruitingNCT02534844Sep 2015-Jan 2017Cardiovascular diseasePhaseⅡCompletedNCT01131299Mar 2010-Oct 2016
Note: a. CRLX101 consists of a sugar molecule cyclodextrin linked to a chemotherapy drug called camptothecin.b. CALAA-01 is a targeted nanocomplex that contains anti-R2 siRNA.
2 环糊精的共价偶联方案
结构决定性质,环糊精由几个葡萄糖单元串联而成,含有大量的羟基,因此具有较好亲水性能。基于这一特点,与环糊精共价偶联的药物水溶性都得到了极大提高。另外,一些疏水性结构的化合物易于进入环糊精的疏水空腔,形成自组装结构体,例如金刚烷与二茂铁等。利用这一优点,环糊精可以将不同功能的生物材料方便、灵活、快捷地整合到一体,避免了普通合成化学的繁琐步骤。自组装具有反应装置简单、反应条件平和、操作过程简便、绿色环保和易于批量制备等优势,普通合成化学手段通常反应条件苛刻复杂,并且不易纯化和批量制备。
2.1 共价偶联类药物载体
在抗肿瘤药物中,存在大量的药物由于水溶性较低而不能有效进入血液循环,使得药效大打折扣。现阶段对这类药物的改进方法主要是增加亲水基团,使其拥有较好的水溶性。环糊精具有亲水性能,疏水性抗癌药物与它共价偶联后能显著增加水溶性。另外,如果在环糊精与药物之间引入酸性敏感的化学键,可以将药物靶向释放到病灶部位。
作者课题组选用青蒿素与环糊精进行了共价偶联研究,如图2所示[13]。2015年,中国女药学家屠呦呦获得了诺贝尔生理学或医学奖,表彰她发现的青蒿素使疟疾患者的死亡率显著降低。另外有研究发现青蒿素还具有抗肿瘤的功效[14],但是青蒿素的水溶性极低,十分不利于它在抗疟疾与抗肿瘤中的应用。为了增加青蒿素的水溶性,先将环糊精修饰成胺基环糊精,然后将其与青蒿琥酯进行共价偶联,最终形成环糊精-青蒿前药[15]。实验结果显示,该前药具有较好的水溶性,同时体外抗癌效果得到了极大提高。另外,作者课题组还发现,共价偶联的青蒿素可以自动进入环糊精的空腔,这有利于保护青蒿素中的过氧桥结构,青蒿素的抗疟疾与抗肿瘤主要的药效基团就是过氧桥[13]。同时,对灯盏花乙素[16]和大黄酸[17]进行类似的实验设计,实验结果表明,它们的水溶性和药效活性都得到了极大提高。

图2 环糊精-青蒿琥酯前药的构建[13]Fig.2 Construction process of cyclodextrin-artesunate prodrug[13]
靶向药物载体是现阶段研究热点之一,因为它不但可以提高药物生物利用度,而且还能降低药物副作用。叶酸分子目前被广泛应用于靶向药物载体。前期研究发现,叶酸受体在肿瘤细胞表面通常过度表达(如结直肠癌细胞、卵巢癌细胞、乳腺癌细胞和肺癌细胞等),而在正常细胞表面几乎不表达,这是由于肿瘤的迅速分化导致其需要大量的叶酸[18]。利用这一特点,作者课题组设计了环糊精-叶酸靶向药物载体,该载体可以将一些疏水性药物靶向转运到肿瘤细胞,在肿瘤治疗方面具有较好的应用前景,如图3[19]。当然,并不是所有的药物都能被该药物载体靶向转运,前提条件是药物的立体结构与环糊精空腔需要完全匹配。

图3 环糊精-叶酸靶向药物载体的传递过程示意图[19]Fig.3 Schematic of the transport process of cyclodextrin-folate targeting drug carrier[19]
单个环糊精偶联物虽然增加了药物的水溶性,但缺点是载药量低,不能使大量药物同时到达病灶组织。针对这一缺点,Lu等[20]报道了一种由环糊精与羧甲基壳聚糖键接而成的新型水凝胶药物载体,如图4所示。该载体以羧甲基壳聚糖为主链,侧链共价修饰大量的环糊精,使其具有较高的载药能力。载体中的环糊精可以自动与前药(金刚烷-多柔比星)完成组装。这是由于金刚烷的立体结构与环糊精的疏水空腔恰好能完全匹配。实验结果显示,该药物载体在酸性条件下能使药物快速释放,同时具有较低的细胞毒性。作者课题组在聚赖氨酸的侧枝链上共价接枝了大量环糊精进行了类似的研究,该类载体同样具有较高的载药能力[21]。

图4 环糊精-壳聚糖水凝胶的药物组装与释放机制[20]Fig.4 Drug assembly and release of cyclodextrin-chitosan hydrogel [20]
2.2 共价偶联类基因载体
基因治疗是将外源核酸导入肿瘤细胞中,纠正肿瘤细胞核酸的缺陷或异常,以达到治疗的目的。基因治疗在临床上是否能成功运用,很大程度上取决于基因运载工具是否高效低毒。近年来,大量的阳离子基因载体被深入研究报道,比如聚乙烯亚胺(polyethylenimines, PEI)、聚赖氨酸(poly-lysine, PL)、聚酰胺-胺型树枝高分子(PAMAM)和壳聚糖(chitosans)等[22]。这些载体都能够同核酸形成带正电荷的纳米粒子,并且可以通过非特异性摄取机制进入细胞,然而这些载体往往都具有较高的细胞毒性。这主要是因为阳离子聚合物表面正电荷太高,它在与核酸结合的同时,同样也能与细胞内其它细胞器相结合,使其它细胞器失去相应的功能而导致细胞死亡[23]。针对这一缺点,作者课题组采用多层“沙-砖策略”设计了一种高效低毒并且具有靶向功能的基因载体,如图5所示[24]。首先构筑了3种分子砌块:乙烯亚胺-环糊精(PEI-CD)、金刚烷-聚乙二醇(PEG-AD)和金刚烷-叶酸(FA-AD)。然后利用环糊精与金刚烷的自组装作用形成纳米粒子。粒子表面的聚乙二醇具有掩蔽正电荷的作用,使其降低与其它细胞器结合的能力,同时聚乙二醇能增加载体与细胞的生物相容性。粒子表面的叶酸能使载体更容易被肿瘤细胞识别,使载体具有肿瘤靶向作用,进而提高靶向转染效率。
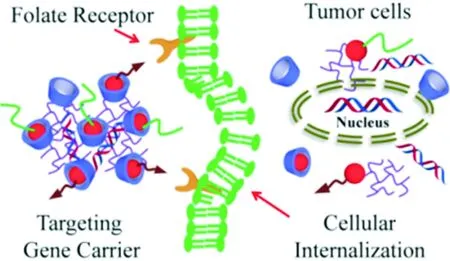
图5 阳离子聚合物/pDNA靶向传递示意图[24]Fig.5 Schematic illustration of target transfer of polycation/pDNA complexation[24]
Liu等[25]通过二硫键将阳离子链与环糊精进行偶联,使其成为非病毒基因载体的主体结构。为了使该载体具有肿瘤靶向性,他们同样将叶酸与金刚烷键接形成肿瘤靶向配体。该肿瘤靶向配体能通过自组装作用方便快捷地构筑到非病毒基因载体的主体结构上,最终形成具有肿瘤靶向作用的非病毒基因载体。生物实验表明,在具有氧化还原物质的环境中,该基因载体中的二硫键可以有效断裂,进而使基因载体的主体结构裂解,最终导致运载的基因高效释放到肿瘤细胞内。
3 环糊精的聚轮烷方案
将多个环糊精通过一条主链聚合串联在一起称为准聚轮烷。为了预防链上的环糊精脱离,在主链两端偶联上封端剂的聚合物简称为聚轮烷。聚轮烷上的环糊精由于和主链是非共价键结合在一起,结合力较弱,所以环糊精分子可以在主链上来回滑动与旋转,这样更有利于对聚轮烷上的环糊精进行化学修饰,使聚轮烷具有更多的生物化学功能。修饰通常是先将环糊精与主链自组装后再进行修饰,如果先修饰环糊精,由于修饰基团位阻太大,主链与环糊精通常就不能自组装形成聚轮烷,聚轮烷的自组装与修饰过程如图6所示。

图6 聚轮烷的自组装与修饰过程Fig.6 Self assembly and modification process of polyrotaxane
3.1 轮烷类药物载体
Li等[26]构筑了pH敏感的树枝状聚轮烷纳米药物载体,该载体可以有效地将药物靶向传递到肿瘤细胞内,纳米粒子药物释放过程如图7所示。该团队首先利用PEG和环糊精构筑准聚轮烷,然后在准聚轮烷两端使用pH敏感的腙键连接阿霉素(DOX)和超支化聚合物进行封端,最终形成聚轮烷。聚轮烷一端的DOX为疏水性,另一端的超支化聚合物为亲水性,因此该聚轮烷为两亲性聚合物。该聚合物能在水溶液中自动形成微胶粒。由于结构中引入了pH敏感的腙键,所以该微胶粒能在肿瘤的酸性环境中能自动分解,最终释放DOX抗癌药物。另外缩酮键也能用在聚轮烷的封端剂中,使聚轮烷成为pH敏感的药物载体[27]。
作者课题组在聚轮烷的基础上对环糊精进行了化学修饰,使聚轮烷成为超支化聚合物,进而拥有较高载药能力[28]。首先利用聚丙二醇与碘代环糊精自组装构筑准聚轮烷,随后利用叶酸对准聚轮烷进行封端,封端后的聚轮烷具有叶酸介导的肿瘤靶向性,然后在环糊精上修饰偶联青蒿琥酯,如图8所示。体外实验发现,封端剂在酸性条件下会自动脱离,导致聚轮烷裂解,进而释放出环糊精-青蒿琥酯前药。释放的前药同样在酸性条件下发生酯键断裂,最终释放青蒿琥酯。

图7 pH敏感的树枝状聚轮烷纳米粒子药物释放过程[26]Fig.7 Illustration on micelles selectively releasing drugs at endosomal compartments activated by acidic pH[26]

图8 青蒿琥酯-聚轮烷的构筑过程[28]Fig.8 Construction process of artesunate-polyrotaxane[28]
3.2 轮烷类基因载体
正如前文所提及,基因载体能够有效结合基因的前提条件是载体中含有阳离子聚合物。Li课题组最先将环糊精阳离子聚轮烷用于构筑非病毒基因载体:先用环糊精与聚丙二醇制备成聚轮烷,然后在环糊精上偶联阳离子链,使环糊精聚轮烷具有阳离子特征[29]。另外, Liu课题组研究发现在阳离子链上进一步偶联平面分子后,该轮烷具有更好的凝聚效果,因为平面分子可以和DNA双螺旋大沟槽结合,使基因载体与DNA结合更为紧密,如图9所示[30]。

图9 平面分子与DNA的结合示意图[30]Fig.9 Schematic of the combination of planar molecules with DNA[30]
作者课题组设计了一种新型的环糊精聚轮烷基因载体,如图10所示。首先利用环糊精与聚丙二醇制备聚轮烷,两侧封端剂为具有肿瘤靶向的叶酸分子。然后在环糊精上先偶联三乙烯四胺阳离子链形成阳离子聚轮烷,最后在阳离子末端偶联天然药物灯盏花乙素作为平面分子。实验发现,偶联了平面分子的聚轮烷,其凝聚能力明显强于未偶联平面分子的聚轮烷。其中的灯盏花乙素不但可以作为平面分子增强凝聚能力,而且还可以作为药物用于肿瘤的治疗。总之,该聚轮烷能同时传递基因与药物到靶细胞[31]。

图10 基于环糊精的聚轮烷药物载体与基因载体示意图[31]Fig.10 Schematic of drug carrier and gene vector of polyrotaxane based on cyclodextrin[31]
4 结 语
实现药物对靶标组织或器官特异性的分布是目前药物研究面临的主要瓶颈。精准医学探索的基础之一就是将药物精准投递进行个体化治疗。精准投递可以使最低剂量的药物在最低副作用下达到最高的生物利疗效。纳米药物与基因载体普遍具有高效、低毒的优势和靶向转运能力,这恰恰是精准医学的追求目标之一。但是纳米药物与基因载体结构复杂、构筑繁琐,普通合成化学手段难以成功构筑,环糊精超分子自组装的出现为构筑纳米药物与基因载体提供了方便、快捷、灵活的手段。
构筑生物安全的纳米药物与基因载体是实现精准治疗的前提与保障。正如上文所提及,纳米药物与基因载体结构复杂,往往是多种材料的组合,既要保证载体具有运载能力,又要保证载体具有生物相容性,这将是设计纳米药物与基因载体的主要挑战。此外,我们必须要充分认识到人体是个复杂的机体,内部环境因素多种多样,纳米药物与基因载体能否排除各种干扰因素,实现药物的高效、低毒靶向释放也是将要面临的主要挑战。
总之,要将这些成果转移到临床研究阶段依旧任重道远,但是科学研究本身是长期工作积累的过程,相信随着对环糊精构筑的纳米药物与基因载体的深入探索,以上挑战将会被逐一化解。

