L-苯丙氨酸制备的研究进展
韩建福,富敏霞,祝铃钰,贠军贤
(浙江工业大学化学工程学院,浙江杭州310032)
苯丙氨酸(phenylalanine,Phe),也称作2-氨基-3-苯基丙酸,它是一种手性分子,有L-苯丙氨酸(L-Phe)和D-苯丙氨酸2种存在的手性形式,结构式如图1所示。苯丙氨酸的分子式为C9H11NO2,分子量为165.19,外观为无色至白色片状晶体或结晶性粉末,苦杏仁味;室温下不溶于乙醚,微溶于乙醇,溶于水;在空气中受热、光照稳定。其中,具有生物活性的光学异构体为L-苯丙氨酸,比旋度为-35.1°,等电点pI=5.48,熔点为283 ℃。L-Phe是一种重要的氨基酸,为人体必需的8种氨基酸之一,人和动物自身无法合成,必须从外界摄取[1]。

图1 苯丙氨酸的2种对映异构体Fig.1 Two enantiomers of phenylalanine
近年来,新型甜味剂阿斯巴甜的市场需求量日益增大,L-Phe作为生产阿斯巴甜的主要原料,其需求迅速增大[2-3]。同时,L-Phe也广泛用于药物活性化合物,如抗炎药、中枢神经系统神经肽、HIV蛋白酶抑制剂和维生素B6等,在医药领域的应用越来越受到重视[4-5]。目前国内生产的L-Phe已不能满足需求,进口份额越来越大[6-7]。良好的市场需求前景,使国内外越来越多地关注光学纯L-Phe生产技术的研究。因此,本文中,笔者对化学合成法、酶促合成法和微生物发酵法获得光学纯L-Phe 的研究情况进行综述。
1 化学合成法
Phe的化学合成法大体可以分为以下几种:氰氨法、酰氨基丙二酸乙酯法、苯甲醛的缩合反应法和α-取代基脂肪酸氨化法等[8-11]。这几种方法最终得到的是苯丙氨酸的D型和L型手性混合体,要得到光学纯L-苯丙氨酸,则需要对这些产物进行拆分。根据D/L-Phe拆分的手段和原理不同,常用的拆分方法主要包括萃取拆分法[12]、膜拆分法[13]、分子印迹技术[14-15]和酶拆分法[16-17]等。这几年,很多学者重点研究了通过化学合成法直接得到手性L-Phe。吴建一等[18]以甘氨酸为起始原料,在保护氨基和羧基条件下合成苯亚甲氨基乙酸乙酯,然后经卤代烃在手性转移催化剂的催化下反应生成烃化产物,经酸性水解得到L-Phe,产率40.1%。
化学合成法制备L-Phe生产路线长,使用有毒化学试剂原料,副产物多,环境污染大,且产物为光学消旋体,需进行光学拆分,成本高,因而逐渐被淘汰。而酶促合成法和微生物发酵法制备Phe往往能得到高光学纯度的D-或L-Phe,过程更加环保,并利用葡萄糖、蔗糖、玉米浆和甘油等可再生资源[4,19-20]。近几年,国内外学者对Phe的研究已转向酶促合成法和微生物合成转化方法。
2 酶促合成法
酶促法合成L-Phe是利用微生物中的酶系高效专一地催化底物来合成L-Phe。酶法生产L-Phe主要有两种方法:一是以苯丙酮酸为底物,利用苯丙氨酸转氨酶生成L-Phe;二是以肉桂酸为底物,利用苯丙氨酸解氨酶(PAL)生成L-Phe,此法不需要昂贵的辅酶系统或者再辅酶生系统[21],因而应用较为广泛。
Anzawa等[22]利用弗氏柠檬酸杆菌的转氨酶催化苯丙酮酸生成L-苯丙氨酸,目前已培养出能够产生大量PAL的重组菌株。当以L-谷氨酸为氨基供体时,在优化的条件下肉桂酸转化率可达80%以上。而在生物转化期间,细胞中的重组PAL活性迅速下降。因此,提高重组PAL的稳定性对提高L-Phe产量是必需的。Zhang等[23]应用中心复合设计优化重组PAL稳定性关键因素的综合效应,改善大肠杆菌中重组PAL的稳定性,测试变量的最佳值为13.04 mmol甘油、1.87 mmol/L蔗糖、4.09 mmol/L二硫苏糖醇和69 mmol/L Mg2+,在3次连续的生物转化循环后,PAL最大活性保持为67.73 U/g;与最初的PAL活性相比,PAL活性的损失仅为22%;与对照实验相比,PAL活性增强约23%(不含任何稳定剂或添加剂)。在连续的生物转化期间,PAL稳定性显著改善,可有助于工业规模的L-Phe生产。此外,Yue等[24]研究发现一定量的β-环糊精有利于提高PAL的活性,进而提高L-Phe的生产率。
酶促合成法生产工艺简单、产品光学纯度高、纯化步骤简便且生产能力较强,是目前工业化生产L-Phe的主要方法之一。然而,近年来,由于底物和酶等主要原料成本高、来源有限以及反应过程中酶稳定性差等缺点,酶促合成法生产L-Phe的规模也受到了很大制约。
3 微生物发酵法
微生物具有生长繁殖迅速可控、原料廉价易得、反应条件温和、环境污染小及生产周期短等优点,成为L-Phe合成的研究热点。微生物利用碳源和氮源进行发酵,可以大量生产L-Phe。用于合成苯丙氨酸的微生物菌株有:枯草芽孢杆菌、粘红酵母菌、短杆菌、假单胞菌、大肠杆菌、谷氨酸棒杆菌以及一些工程菌等[25-30],目前工业上发酵生产L-苯丙氨酸的菌株主要为大肠杆菌。
3.1 发酵法合成机制
微生物中,L-Phe的合成代谢途径是从葡萄糖开始,包括以下3个途径[28,30-32]:中心碳源代谢途径、莽草酸途径和分支酸途径。葡萄糖经糖酵解途径和磷酸戊糖途径生成磷酸烯醇式丙酮酸(PEP)和四磷酸赤糖(E4P)2个前体物质,它们首先在3-脱氧-D-阿拉伯庚酮糖酸7-磷酸合成酶(DAHPS)催化下缩合成3-脱氧-D阿拉伯庚酮酸糖-7磷酸(DAHP)进入莽草酸途径,在经过一系列的酶促反应到达L-Phe合成途径的分支点——分支酸。一方面分支酸在邻氨基苯甲酸合酶作用下进入L-色氨酸(L-Trp)合成途径。另一方面分支酸经分支酸变位酶(CM)生成预苯酸,预苯酸经预苯酸脱水酶(PDT)作用生成L-苯丙酮酸,再经氨基转移酶(AT)作用生成L-Phe;或预苯酸经预苯酸脱氢酶和氨基转移酶进入L-酪氨酸(L-Tyr)合成途径。谷氨酸棒杆菌中DAHPS调控机制要比大肠杆菌复杂得多,DAHPS分别由aroF和aroG这2个基因编码,其中,aroF基因编码的AroF酶主要受到L-Tyr反馈抑制,aroG基因编码AroG酶会受到L-Phe的反馈抑制,同时在CM酶的存在下,受到预苯酸和分支酸的协同反馈抑制[33-34]。在谷氨酸棒杆菌中,由csm和pheA2个基因编码CM、PDT的2个酶分别催化分支酸生成预苯酸,进而生成苯丙酮酸[35],PDT酶受到产物L-Phe的反馈抑制[36-37]。大肠杆菌L-Phe的合成途径如图2所示。

图2 大肠杆菌和谷氨酸棒杆菌中L-Phe合成代谢途径Fig.2 L-phenylalanine biosynthesis pathway in E.coli (a) and C. glutamicum (b)
由图2可知:L-Phe合成途径内存在3个节点[38-39]:①2个前体物质合成DAHP节点,在大肠杆菌调控机制中,DAHP由中心碳源途径过渡到莽草酸途径,它的量决定了所有下游代谢产物的流量;②分支酸向L-Trp合成节点,在此节点抑制分支酸向L-Trp方向流动,即可促进分支酸向L-Tyr和L-Phe方向流动;③预苯酸向L-Tyr和L-Phe分支节点,在此节点通过抑制预苯酸向L-Tyr方向移动,即可促进L-Phe合成。作用于这几个节点的酶和基因(表1),便是整个芳香族氨基酸合成途径中的重要调控位点。DAHPS由3个同工酶AroH、AroF和AroG构成,分别由aroH、aroF和aroG3个基因编码,这3个基因决定了其活性,并受L-Trp、L-Tyr和L-Phe的反馈抑制[30,40]。大肠杆菌中另外2个节点受到由pheA基因编码的双功能酶分支酸变位酶——预苯酸脱水酶(CM-PDT)影响,并受到产物L-Phe反馈抑制[41]。
3.2 发酵法合成应用
L-Phe的合成代谢途径比较复杂,涉及的酶类较多(表1),可对途径内的几个分支点进行代谢流的优化和调控,加强重要前体物质DAHP的合成,同时也可对途径间的竞争抑制进行消除,或消除途径内的反馈抑制,是目前获得高产量L-Phe的研究热点。近几年,微生物发酵法生产L-Phe的主要关注点包括:通过基因工程技术构建重组菌体提高或抑制关键酶表达,优化发酵过程[26,42-44],寻找新的工程菌株等。

表1 大肠杆菌中L-Phe合成代谢关键酶及控制基因[40]
3.2.1 构建重组菌株
在正常条件下,在野生型菌株中只有少量的中心代谢物转化为L-Phe。由L-Phe合成代谢机制可知,促进微生物合成L-Phe的方法有:促进前体物质DAHP的合成,抑制L-Trp、L-Tyr与L-Phe合成途径间的竞争,解除合成途径内的反馈抑制。由于编码L-Phe生物合成的基因在大肠杆菌和其他微生物中有很好的表达,因此理论上可通过关键酶基因的克隆和过量表达以增加关键酶合成,进而提高微生物中L-Phe的生产能力。目前,关键酶的筛选及其在L-Phe发酵法生产中得到了深入研究和广泛应用,极大地促进了微生物发酵法生产L-Phe的工业化进程。Ding等[45]通过蛋白质组学方法和体外酶滴定实验确定参与莽草酸途径的6种酶(AroK、AroL、AroA、AroC、PheA和TyrB)的绝对浓度,实现了这6种酶的体外反应体系的重建,并测试了它们对L-Phe生产的影响,结果发现,当莽草酸激酶和5-烯醇丙酮酸莽草酸-3-磷酸合酶浓度增加2.5倍时,L-Phe的产量分别增加3.0倍和2.1倍。
在大肠杆菌中,目前主要通过基因工程促进PEP、E4P的合成和DAHPS酶的过表达提高DAHP的流量,进而提高L-Phe产量。在大肠杆菌中,PpsA通过转磷酸化反应催化丙酮酸合成PEP,而TktA催化合成E4P[46]。PpsA和PckA分别由ppsA和pckA基因编码。因此可通过过度表达ppsA和pckA基因来提高DAHP合成基质PEP和E4P的产量。目前已经成功构建了一系列具有不同变体的重组大肠杆菌菌株用于L-Phe的高水平生产。研究表明ppsA基因在大肠杆菌中的过度表达将DAHP水平提高了1.9倍[47]。在大肠杆菌细胞中,PckA过表达将L-Phe产生的摩尔转化产率增加了20%[48]。
AroG和AroF同工酶都被约0.1 mmol/L的相应氨基酸完全抑制,但AroH仅被L-Trp部分抑制,增强DAHPS活性是过量生产L-Phe及其前体莽草酸的重要方法。消除L-Phe对关键酶的反馈抑制和tyrA基因的缺失可以提高L-Phe生物合成的产量。此外在L-Phe生产过程中,通常使用L-Tyr营养缺陷型生产菌株来避免不需要的碳流入L-Tyr合成途径。
2017年,Liu等[49]开发了一种转录因子(TF)驱动的能特异性地感知细胞内L-Phe,并将该信号转化为可观察的类型。通过这种策略,建立了高灵敏度和宽动态范围的HTS平台,以促进高L-Phe产量的新型生产商的表征、鉴定和分离。这种方法使研究者能够在短时间内从突变文库中获得大量新的感兴趣的表型,并提供对大肠杆菌中L-Phe生物合成途径复杂调控的深入了解。基于TF的生物传感器的超敏性和特异性,各种基因设备已被用于优化合成途径并预测目标代谢产物的潜在瓶颈[50-52]。此外,通过从随机诱变文库中筛选L-Phe高产表型来研究该生物传感器的适用性,结果表明,这种新型L-Phe反应装置可用作改善大肠杆菌中L-Phe产生的有效筛选工具。部分大肠杆菌中L-Phe合成代谢特征及文献总结见表2。
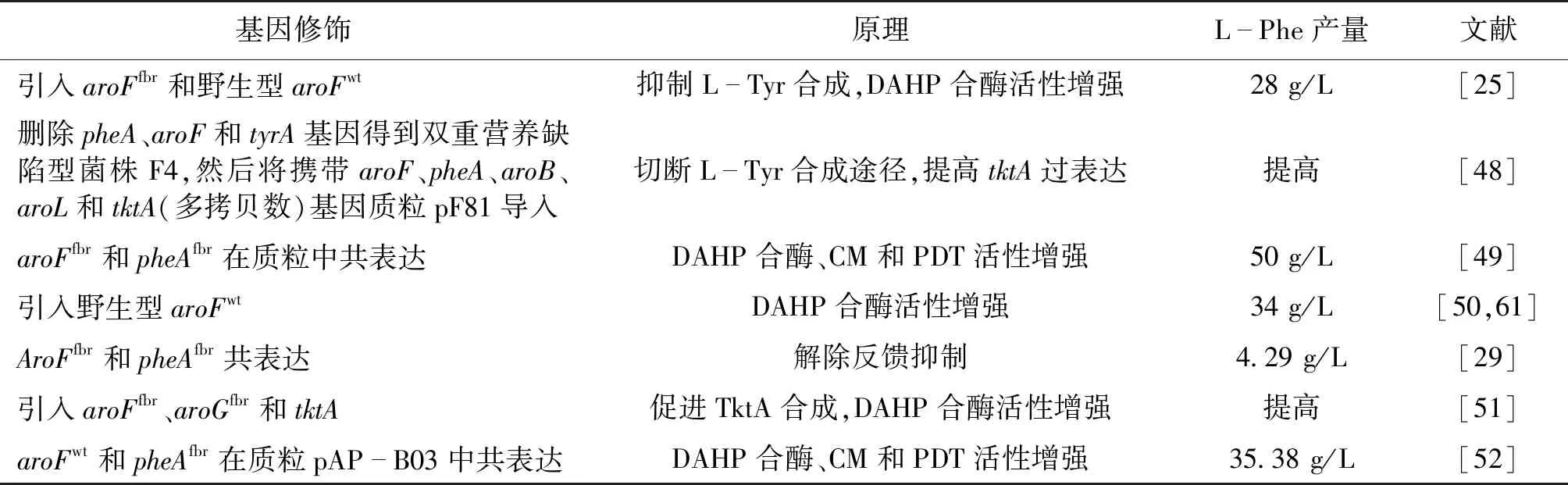
表2 大肠杆菌中L-Phe的合成代谢
3.2.2 优化发酵过程
为了制备经济上可行的产品,在实验室规模开发和测试的过程必须适应工业上更大的生产量,但通常由于放大效应而导致生产性能显著下降[53]。因此,为防止大肠杆菌放大过程中由发酵参数异质性引起的生理变化,优化发酵过程就很有必要。各种发酵方法和技术已被开发用于改进L-Phe的生产[54],例如培养基优化、底物进料速率控制、O2供应速率控制和过程设计等。
在过去几年中,甘油已成为高效生产L-Phe的主要碳源。与葡萄糖相比,低成本及更高碳转化率的甘油能够有效降低工业生产成本。在大肠杆菌中,甘油通过扩散穿过细胞质膜,随后通过甘油激酶(GlpK)将细胞内甘油转化为甘油3-磷酸(G3P),然后细胞内G3P通过G3P脱氢酶的作用氧化形成磷酸二羟丙酮(DHAP),后者又异构化成甘油醛-3-磷酸(GA3P)。DHAP和GA3P在糖酵解途径、戊糖磷酸途径和芳香族氨基酸生物合成途径中进一步代谢。由于L-苯丙氨酸脱氢酶活性参与了大肠杆菌L-Phe合成的最后一步,Thongchuang等[55]将来自耐热芽孢杆菌迟缓芽孢杆菌的苯丙氨酸脱氢酶基因(phedh)、编码芳香族氨基酸出口的yddG基因和编码甘油转运促进子的glpF基因克隆到质粒中并在大肠杆菌中共表达。在甘油培养基中,克隆pPY(phedh和yddG)和pPYF(phedh、yddG和glpF基因)的工程菌,L-Phe最大产率分别比pPheDH克隆的高1.4倍和1.8倍。
补料分批培养是工业生产L-Phe的常用方法,因为它能增加细胞密度,严格控制底物浓度和溶氧以防止发酵途径的激活[56]。Weiner等[57]以甘油为碳源,在分批补料条件下,研究了大肠杆菌 FUS4代谢生成L-Phe的过程,发酵76 h后L-Phe产量达到22.8 g/L。Wu等[58]使用温度敏感性质粒,过量共表达抗反馈抑制突变体pheAfbr以及野生型aroF和透明颤菌血红蛋白基因,研究了溶氧条件对其发酵产物的影响,结果表明,高溶氧浓度下L-Phe产量达44.21 g/L。2011年,Zhou等[44]在大肠杆菌BR-42发酵罐中进行发酵优化,研究恒速给料、线性递减给料和指数给料对L-Phe产生的影响,结果表明L-Phe的最终产量高达57.63 g/L。2015年,Yuan等[21]采用分阶段指数型进料L-Tyr,与指数进料相比,最终L-Phe产量增加15.33%,L-Tyr补充量降低45.38%。此外补料分批策略可以在一定程度上解决副产物醋酸带来的问题。
通常利用大肠杆菌工程菌株生产L-Phe需要较高的供氧率。在实际生产中,常通过增加曝气速度和搅拌速度以及纯O2补充来增加O2供应。但是高O2供应可能会导致功耗过大和整体工艺成本增加。Wu等[58]研究发现,由tac启动子驱动的透明颤菌血红蛋白基因(vgb)与aroF和pheAfbr基因的共表达,能够提高产率并减少大肠杆菌CICC10245曝气的需求。当vgb、aroF和pheAfbr一起表达时导致L-Phe生产显著增加,最高可增加4.13倍。另外,在限氧条件下,大肠杆菌CICC10245产生L-Phe的量明显少于高通气条件下的结果。大肠杆菌菌株PAPV在高通气条件下产生约6.23 g/L的L-Phe,而在低通气条件下产生约5.82 g/L的L-Phe。
最后,生物过程设计也是L-Phe生产的重要因素。L-Phe的生物合成是最复杂的氨基酸合成途径之一。2014年,Liu等[59]探究了L-Phe系统级工程化生产:①通过失活crr来减少葡萄糖特异性磷酸烯醇丙酮酸-碳水化合物磷酸转移酶(PTS)系统,以减少葡萄糖摄取率以减少溢出代谢;②开启或关闭phefbr、aroG15、ydiB、aroK和tyrB基因的表达以增加前体的供应;③采用tyrA突变株来减少碳转移并导致非生长细胞;④通过过量表达yddG来增加L-Phe的外排,使平衡向L-Phe合成移动进行反馈调节。首先比较PTS中的突变体并首先筛选crr突变体,表达yddG的菌株以较高的速率向培养基中分泌L-Phe,并且只有较少L-Phe在细胞内积累。通过系统工程,L-Phe产量高达47.0 g/L,这是非优化发酵条件下最高的。2018年,Liu等[60]研究发现,在未优化的发酵条件下,通过系统级工程5 L发酵罐中Xllp21菌株的L-Phe产量达到72.9 g/L,是原始菌株Xllp01的1.62倍。
3.2.3 寻找新菌株
尽管可以产生较高浓度的L-Phe,但大肠杆菌工程菌在工业化生产L-Phe时遇到了许多问题,特别是噬菌体感染致使发酵终止[61]。因而需要寻找稳定的替代工程菌株,如谷氨酸棒杆菌。谷氨酸棒杆菌具有生长速度快、缺乏内毒素、分离过程简单等优点,同时随着现代分子生物学技术的发展,谷氨酸棒杆菌基因测序已完成,基因操作工具也已成熟[62-63],代谢工程谷氨酸棒杆菌生产L-Phe取得了显著效果[64]。
谷氨酸棒杆菌的研究主要集中在表达解除反馈抑制的关键酶。为了改善谷氨酸棒状杆菌中L-Phe的积累,Zhang等[23]在谷氨酸棒杆菌ATCC 13032中异源表达大肠杆菌来源的DAHPS和CM-PDT,最终获得L-Phe产量为4.64 g/L,是出发菌的29倍,说明过量表达这2个关键酶能显著提高L-Phe的积累量。同时,使用正交试验设计及响应面优化法,分别对种子培养基及发酵培养基进行优化,确定了重组谷氨酸棒杆菌发酵L-Phe的最佳种子培养基及最佳发酵培养基,最终在最佳培养基条件下L-Phe产量高达9.14 g/L,比优化前的7.46 g/L提高了22.5%[31]。Zhang等[23]分析了谷氨酸棒状杆菌ATCC13032中莽草酸和分支酸途径的关键酶,发现通过突变的pheA和野生型aroH基因的共表达,L-Phe增加了13.6倍。Liu 等[64]将aroG-pheA整合到谷氨酸棒杆菌染色体中由于生物合成途径中关键酶活性的改善,也有利于L-Phe的合成。这两个因素使得L-Phe生物合成产量增加了30%。
4 结论与展望
对近年来国内外L-苯丙氨酸制备的研究进展进行了综述,主要结论如下:
1)L-Phe制备方法有多种,但微生物发酵法由于具有原料廉价易得、环境污染较小、产物纯度高等优点,是目前国内外工业化生产L-Phe的主要方法。
2)根据L-Phe代谢机制,对途径内的几个分支点进行代谢流的优化和控制,是微生物发酵获得高浓度L-Phe的有效方法。
3)谷氨酸棒杆菌具有速度快、缺乏内毒素、分离过程简单等优点,在一定程度上可以克服大肠杆菌工程菌株的一些局限,是L-Phe微生物发酵合成的潜在菌种,成为当前研究的主要方向之一。
目前,微生物发酵合成L-Phe已经实现了工业化,但仍存在亟待解决的问题。因此,下一步需要进一步开展研究,例如进行菌种的筛选和高产工程菌株的构建,以获得性能更加优良的生产菌株;同时,对发酵工艺和过程进行优化,来提高L-Phe的产量;对于L-Phe的代谢流调控和代谢机制进行更加深入详细的研究等。随着深入研究,L-Phe的应用会不断扩大,在不同工业领域将有更广阔的前景。

