27-羟基胆固醇对神经细胞和星形胶质细胞溶酶体胆固醇转运相关因子表达的影响
陈 思 周 催 余辉艳 陶领伟 王玉珊 肖 荣
(首都医科大学公共卫生学院营养与食品卫生学系 环境毒理学北京市重点实验室,北京 100069)
由于外周循环中的胆固醇无法直接通过血-脑脊液屏障(blood brain barrier,BBB)进入脑内,脑内的胆固醇主要由星形胶质细胞合成并与胆固醇载脂蛋白E(apolipoprotein E, ApoE)结合形成胆固醇-ApoE复合物[1]。胆固醇-ApoE复合物被运送到神经细胞溶酶体中,由尼曼匹克蛋白质(Niemann-Pick C protein,NPC)实现胆固醇在溶酶体中的转运。NPC2蛋白质首先与胆固醇的烷基侧链部分进行结合, 之后NPC1蛋白质与胆固醇继续结合,把胆固醇运送到溶酶体膜上[2],并与突触结合蛋白VII(Syt7)合作将胆固醇转运到下游细胞器进行利用,这一系列过程对维持神经细胞的功能具有重要作用。研究[3-6]显示,NPC基因缺陷可导致胆固醇堆积在细胞溶酶体内不能正常转运,并且神经退行性疾病的发生、发展与神经细胞溶酶体内NPC蛋白质的基因下调有关。
27-羟基胆固醇(27-hydroxycholesterol,27-OHC)是外周胆固醇的氧化产物之一,可以自由通过血-脑脊液屏障,也是脑中最丰富的氧化固醇[7]。许多研究[8-9]显示,阿尔茨海默症(Alzheimer’s disease, AD)患者血清及脑脊液(cerebrospinal fluid, CSF)中的27-OHC浓度升高与AD患者脑内神经细胞的萎缩程度以及活性的丧失有关[10-11],这些研究表明27-OHC在神经细胞变性中起着关键作用。本课题组前期动物及细胞研究[12-13]显示,27-OHC可引起SD大鼠神经细胞溶酶体功能异常,且27-OHC对细胞产生毒性作用,并对脑内神经细胞发育及星形胶质细胞胆固醇合成与转运产生影响;提示27-OHC可能通过干扰溶酶体结构和功能引起脑内神经细胞发育及星形胶质细胞胆固醇转运的异常,但是27-OHC在神经细胞溶酶体中的作用及具体机制尚不明确。
本研究通过神经细胞-星形胶质细胞共培养体系模拟神经系统自然状态,研究27-OHC对神经细胞以及星形胶质细胞胆固醇浓度及溶酶体NPC基因表达的影响,为深入研究氧化固醇对退行性神经疾病中的细胞机制提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞
选用SH-SY5Y细胞系(人神经母细胞瘤细胞)和C6细胞系(大鼠星形胶质瘤细胞)作为研究对象,分别购自北京协和细胞资源中心(CRC/PUMC)和中国科学院上海细胞库。将细胞生长于含10%(体积分数)胎牛血清和10 U/L 青链霉素的DMEM中,于37 ℃、5.0%(体积分数)CO2的细胞培养箱中培养。
1.1.2 主要仪器与试剂
主要仪器:恒温培养箱(Sanyo公司,日本)、酶标仪(Tecan公司,瑞士)、反转录仪(Bio-Rad公司,美国)、Real-Time PCR分析仪(Bio-Rad公司,美国)、分子成像系统(Vilber公司,法国)。
试剂:27-羟基胆固醇购于美国Santa Cruz公司;二甲基亚砜(DMSO)购于美国Sigma公司;细胞总胆固醇测试盒购于南京建成生物工程研究所;BCA蛋白定量试剂盒购于北京鼎国昌盛生物技术有限责任公司;Real-time PCR引物购于生工生物工程(上海)股份有限公司;Anti-Niemann Pick C1和Anti-Niemann Pick C2抗体购于美国Abcam公司;Anti-Niemann Pick C1和Anti-Niemann Pick C2 引物购于生工生物工程(上海)股份有限公司。
主要试剂配制:27-羟基胆固醇10 mg完全溶于适量乙醇,配置成1 000 μmol/L储备液分装在1.5 mL离心管中,每管1 mL储备液用氮吹仪吹干,于-80 ℃保存。临用时,每离心管中加入200 μL DMSO用于溶解27-OHC,并加入800 μL DMEM配制成1 000 μmol/L的储备液,之后配成工作液(5、10、20 μmol/L)。
1.2 方法
1.2.1 建立细胞共培养体系
模拟神经系统内环境,SH-SY5Y细胞和C6细胞在Trans-well系统中共培养。SH-SY5Y细胞(1.0×106/mL)接种于6孔板上,C6细胞(1.0×106/mL)接种于上室的聚碳酸酯膜上(孔径0.4 μm,直径30 mm)。上下两室分别加入DMEM完全培养基进行单独培养,4 h后将插入式培养皿接种于6孔板中,对照组加无血清DMEM,处理组进行27-OHC+无血清DMEM干预。
1.2.2 细胞分组与处理
接种细胞浓度为1.0×106/mL,当细胞生长密度达到80%~90%时,对细胞进行分组处理:对照组、27-OHC(低、中、高剂量)处理组(分别采用5、10和20 μmol/L 27-OHC处理),继续培养24h,收集细胞,待测。
1.2.3 细胞内总胆固醇浓度检测
细胞接种密度1.0×106/mL,按照试剂盒说明书收集各组细胞,用预冷的磷酸盐缓冲盐水(PBS)漂洗细胞1次,1 000 r/min离心10 min,弃上清,留细胞沉淀,细胞沉淀内加入100 μL裂解液裂解40 min。之后按照总胆固醇定量试剂盒说明书提供的操作流程检测细胞内的总胆固醇浓度,进行3次独立实验。
1.2.4 Real-time PCR检测
收集细胞进行RNA提取以及反转录之后,使用Real-time PCR仪检测NPC1和NPC2的mRNA表达水平。Real-time PCR系统包含8.2 μL 无核水,10 μL MasterMix(SYBR),1 μL cDNA和0.8 μL 引物,达到每个反应体系的总量为20 μL。进行3次独立实验。PCR引物,详见表1。

表1 PCR引物序列Tab. 1 Primers used for Real-time PCR
1.2.5 Western blotting检测
细胞经过24h不同剂量27-OHC处理后,使用预冷的PBS洗涤细胞,并将0.1 mL细胞裂解缓冲液加入Trans-well小室以及六孔板中对细胞进行裂解。在4 ℃ 13 000g离心15 min收集细胞提取物。BCA蛋白质测定试剂盒用于测量蛋白质浓度。将等量的蛋白质(20 μg)加入到8%或10%(质量分数)SDS-丙烯酰胺凝胶上以通过电泳分离,然后转移到PVDF膜上。用5%(质量分数)脱脂牛奶封闭1 h后,加入β-Actin(1∶1 000)、NPC1(1∶10 000)、NPC2(1∶2 000) 一抗,孵育过夜。TBST洗涤3次后,加入山羊抗兔的二抗(1∶2 000),室温孵育1h后,TBST洗涤3次,发光剂显色发光,Vilber Lourmat Fusion SL6成像分析仪检测分析,最后通过Image J软件分析灰度值,进行3次独立实验。
1.3 统计学方法
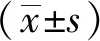
2 结果
2.1 SH-SY5Y和C6细胞内胆固醇浓度
图1结果显示,在中剂量和高剂量27-OHC处理组中,SH-SY5Y细胞内总胆固醇浓度均高于对照组(P=0.000),且呈现升高趋势。而C6细胞内总胆固醇浓度呈降低趋势,27-OHC 10 μmol/L处理组和20 μmol/L组总胆固醇浓度均低于对照组(P<0.05)。

图1 在5、10和20 μmol/L 27-OHC处理下,SH-SY5Y细胞和C6细胞内总胆固醇浓度的变化Fig.1 Total cholesterol of cellular protein in SH-SY5Y cells and C6 cells treated with 5, 10 and 20 μmol/L 27-OHC
All data were presented as the means±SD.*P<0.05,**P<0.01vscontrol group;27-OHC:27-hydroxycholesterol.
2.2 27-OHC对神经细胞及星形胶质细胞溶酶体胆固醇转运相关因子mRNA水平的影响
与对照组相比,SH-SY5Y细胞内溶酶体NPC1基因表达下调,其中27-OHC 5 μmol/L处理组、10 μmol/L处理组及20 μmol/L处理组与对照组相比差异均有统计学意义(P<0.05);与对照组相比,C6细胞溶酶体NPC1基因表达上调,其中27-OHC 20 μmol/L处理组与对照组相比,差异有统计学意义(P<0.05)(图2A,3A)。
与对照组相比,SH-SY5Y细胞内溶酶体NPC2基因表达下调,其中27-OHC 10 μmol/L处理组及20 μmol/L处理组与对照组相比差异有统计学意义(P<0.05);与对照组相比,C6细胞溶酶体NPC2基因表达上调,其中27-OHC 10 μmol/L处理组及20 μmol/L处理组与对照组相比,差异有统计学意义(P<0.05)(图2B、3B)。

图2 在5、10和20 μmol/L 27-OHC处理下,SH-SY5Y细胞和C6细胞溶酶体NPC基因Real-time PCR溶解曲线Fig.2 Real-time PCR solubility curve of NPC1(A)and NPC2 (B) in SH-SY5Y cells and C6 cells treated with 5, 10 and 20 μmol/L 27-OHCNPC:Niemann-Pick C protein;27-OHC:27-hydroxycholesterol.

图3 在5、10和20 μmol/L 27-OHC处理下,SH-SY5Y细胞和C6细胞溶酶体NPC1和NPC2基因表达变化Fig.3 mRNA expression of NPC1(A) and NPC2(B) in SH-SY5Y cells and C6 cells treated with 5, 10 and 20 μmol/L 27-OHC*P<0.05,**P<0.01,***P<0.001 vs control group; NPC:Niemann-Pick C protein;27-OHC:27-hydroxycholesterol.
2.3 27-OHC对神经细胞及星形胶质细胞溶酶体胆固醇转运相关蛋白质表达的影响
27-OHC对SH-SY5Y和C6细胞NPC1和NPC2蛋白质表达的影响如图4A所示,27-OHC下调了SH-SY5Y细胞NPC蛋白质表达,上调了C6细胞NPC蛋白质表达。
图4B显示,与对照组相比,SH-SY5Y细胞内溶酶体NPC1蛋白质表达下调,其中27-OHC 10 μmol/L处理组及20 μmol/L处理组与对照组相比,差异有统计学意义(P<0.01);C6细胞与对照组相比,溶酶体NPC1蛋白质表达上调,其中27-OHC 10 μmol/L处理组及20 μmol/L处理组与对照组相比,差异有统计学意义(P<0.05)。
图4C结果显示,与对照组比较,SH-SY5Y细胞内溶酶体NPC2蛋白质表达下调,其中27-OHC 10 μmol/L处理组及20 μmol/L处理组与对照组相比,差异有统计学意义(P<0.01);C6细胞溶酶体NPC2蛋白质与对照组相比,蛋白质表达呈上调趋势,差异无统计学意义(P>0.05)。

图4 在5、10和20 μmol/L 27-OHC处理下,SH-SY5Y细胞和C6细胞溶酶体NPC1和NPC2 蛋白质表达变化Fig.4 Protein levels of NPC1 (B) and NPC2 (C) in SH-SY5Y cells and C6 cells treated with 5, 10 and 20 μmol/L 27-OHC
The results of Western blotting (A). All data were presented as the means±SD.*P<0.05,**P<0.01,***P<0.001vscontrol group;NPC:Niemann-Pick C protein;27-OHC:27-hydroxycholesterol.
3 讨论
越来越多的研究[14-15]显示,27-OHC对脑内胆固醇转运具有调节作用,脑内胆固醇转运障碍可能与27-OHC浓度的异常升高有关。本研究为更好的模拟神经系统内环境,选取神经细胞(SH-SY5Y)[16]、星形胶质细胞(C6细胞)采用Trans-well小室共培养[17],通过检测神经细胞和星形胶质细胞内的胆固醇浓度以及溶酶体转运胆固醇的特异性蛋白质NPC1和NPC2的基因蛋白质表达情况,探讨27-OHC对脑细胞溶酶体内胆固醇稳态的影响。本研究对共培养状态下的SH-SY5Y和C6细胞进行5、10、20 μmol/L 27-OHC(高于典型生理浓度[13]处理,以模拟脑中胆固醇由星形胶质细胞转运到神经细胞的过程以及27-OHC向脑内流入的机制。
本研究结果显示,27-OHC处理导致SH-SY5Y细胞内总胆固醇浓度特异性升高,C6细胞内总胆固醇浓度特异性降低,这说明27-OHC处理破坏了SH-SY5Y及C6细胞内的胆固醇转运平衡。本课题组前期研究[18]显示,27-OHC处理的SD大鼠脑胆固醇浓度升高;C6细胞作为胆固醇合成的主要细胞,27-OHC处理可以影响C6细胞胆固醇转运,并通过增强ABCA1和ApoE的表达促进星形胶质细胞中的胆固醇外流[19], Ali等[20]研究发现27-OHC是脑中胆固醇合成的生理抑制剂,这些结果均与本研究得到的结果一致,但是胆固醇转运障碍是否与细胞溶酶体内胆固醇储存以及转运功能有联系尚未进行研究。NPC1和NPC2是溶酶体内胆固醇储存和转运的特异性蛋白质[21],本研究显示,通过27-OHC处理可导致SH-SY5Y细胞溶酶体蛋白质NPC1和NPC2基因及蛋白质水平下调;在C6细胞中,27-OHC处理可导致NPC1基因及蛋白质水平上调。相关研究[22]显示,在NPC1基因缺陷小鼠的神经细胞中有胆固醇积累,神经轴突发生异常肿胀,最终导致神经细胞死亡;神经细胞溶酶体中NPC1和NPC2基因表达缺陷会导致胆固醇在溶酶体中蓄集,从而导致神经细胞膜修复、神经轴突生长和突触可塑性所需的胆固醇浓度低下[23-24]。以上表明,NPC1和NPC2蛋白质异常表达会影响胆固醇在神经细胞内的转运,从而造成神经细胞损伤。本研究通过对SH-SY5Y人神经母细胞瘤细胞中总胆固醇浓度以及溶酶体NPC蛋白质进行研究,推测27-OHC处理可引起溶酶体胆固醇转运障碍从而导致胆固醇蓄积。本课题组前期研究[19]显示,27-OHC可促进C6细胞内胆固醇的转运,本研究中C6细胞内溶酶体NPC蛋白质的表达升高会促进溶酶体中的胆固醇外流,以上研究结果有可能为星形胶质细胞中胆固醇浓度的降低提供证据。
综上,27-OHC可通过下调神经细胞中尼曼匹克蛋白质(NPC)的表达水平引起胆固醇转运功能异常,使胆固醇在神经细胞溶酶体内蓄积,最终导致神经细胞胆固醇转运障碍。关于27-OHC对神经细胞和星形胶质细胞共培养体系中细胞溶酶体功能的影响作用机制,还有待于进一步研究。

