地西他滨序贯或同时联合“3+7”方案在45例初发急性髓系白血病中治疗效果分析
彭晓娟 张睿娟 王梅芳 张耀方 覃艳红 杨林花
(山西医科大学第二医院血液科,太原 030001)
急性髓系白血病(acute myeloid leukemia,AML)为起源于髓系造血干/祖细胞的一组基因型、表型、临床特征及预后都具有高度异质性的恶性克隆性疾病,发病病因与机制复杂,预后不同[1]。随着表观遗传学研究,基因甲基化改变在AML发病机制中起重要作用,去甲基化治疗可改善患者预后。地西他滨(decitabine,DAC)作为一种去甲基化药物,通过抑制DNA甲基转移酶,改善抑癌基因过度甲基化,抑制肿瘤细胞增生,提高骨髓增生异常综合征(myelodysplastic syndrome,MDS)及AML患者治疗效果[2]。但地西他滨在AML患者中用药时间点的选择、疗程等问题,国内外尚无统一观点。本研究分析地西他滨序贯或同时联合“3+7”方案治疗AML的治疗效果及不良反应,为临床提供依据。
1 资料与方法
1.1 病例资料
回顾性分析2014年1月至2018年3月笔者医院血液科诊治45例接受DAC联合“3+7”方案治疗初发AML患者,其中男性27例,女性18例,中位年龄56(16~78)岁。所有患者的诊断均符合2016 世界卫生组织(World Health Organization,WHO)分型诊断标准[3]。其中AML伴t(8;21)(q22;q22.1)1例,AML-MO1例,AML-M22例,AML-M418例,AML-M54例,AML伴骨髓增生异常相关改变19例。根据患者发病时细胞遗传学和分子学的改变[1,4]进行AML 预后危险度分层。
1.2 治疗方案
DAC:20 mg·m-2·d-1×(3~5) d;“3+7”方案即[柔红霉素(daunorubicin,DNR)+阿糖胞苷(cytarabine,Ara-C)]或[去甲氧柔红霉素(idarubicin,IDA ) +Ara-C]方案(DNR:45~60 mg·m-2·d-1×3 d);Ara-C:100~200 mg·m-2·d-1×7 d;IDA:10~12 mg·m-2·d-1×3 d);根据DAC的用药时间分为两组,序贯组为DAC用药结束或用药第4天时予以“3+7”方案,同时用药组为两者同时用药。治疗结束时,若出现粒细胞缺乏(中性粒细胞<0.5×109/L),则予以重组人粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)刺激造血,血小板<20×109/L、血红蛋白<70 g/L,给予成分血输注等治疗。
1.3 治疗效果及不良反应评价标准
AML治疗效果判定依据参照国际工作组提出的AML治疗效果标准[5],总反应率(overall response rate,ORR)为完全缓解(complete response,CR)、形态学CR伴不全血象恢复(CR with incomplete hematological recovery,CRi)、部分缓解(partial response,PR)之和。无复发生存(relapse-free survival,RFS)为达CR后至疾病复发或随访结束或死亡;总生存期(overall survival,OS)指患者发病时至随访结束或死亡。以患者治疗期间达到的最佳疗效来进行疗效评价。不良反应分级根据美国国立肿瘤研究所[4]常见毒性标准(Version 4.0)进行判定。定义绝对中性粒细胞计数(absolute neutrophils count,ANC)<0.5×109/L为粒细胞缺乏(粒缺),ANC<0.1×109/L为严重粒细胞缺乏。
1.4 随访
随访时间从疾病确诊之日起,至2018年6月30日止。随访资料来源于患者的门诊、住院病历资料及电话随访记录。对随访期间死亡的病例,依病历记录或电话联系加以确认。
1.5 统计学方法
用SPSS 20.0 软件包进行数据分析。计量资料描述为中位数(范围),首先进行正态性检验,符合正态性则采用独立样本t检验,不符合正态性,采用Mann-WhitneyU检验进行组间比较;率的比较采用卡方检验或Fisher精确概率法。采用log-rank检验对生存率进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
45例AML患者中,29例接受DAC序贯诱导方案治疗,男性19例,女性10例,中位年龄55(16~78)岁,中位疗程数4(1~9)个疗程;DAC与诱导方案同时用药组16例患者,男性8例,女性8例,年龄49(24~78)岁,疗程数3(1~7)个疗程。两组患者的年龄、治疗前血象、中位疗程数、WHO诊断分型、预后分组差异均无统计学意义(P值均>0.05)。两组患者的临床特征及预后分组比较详见表1。
2.2 治疗和生存分析
序贯组29例患者中,获得CR/CRi 17例,PR 5例,NR 7例,ORR为75.9%;同时用药组16例患者中,CR/CRi 8例,PR 4例,NR 4例,ORR为75.0%;两组之间的缓解率差异无统计学意义(χ2=0.595,P=0.842)(图1)。对两组患者进行生存分析,序贯组中位随访时间8.5(1~26)个月,其中19例死亡,7例存活,3例失访,生存时间为(7.25±4.61)个月;同时用药组随访时间为7.4(1~16)个月,其中11例死亡,2例存活,3例失访,生存时间为(8.48±5.42)个月,两组OS比较,差异无统计学意义(P=0.447);对两组获得CR的患者进行RFS生存分析,序贯组与同时用药组的RFS比较为差异无统计学意义[(7.41±5.46)个月vs(7.25±4.27)个月],差异无统计学意义(P=0.942);两组中共24例患者用药≥4个疗程,其中序贯组17例,同时用药组7例,两组患者比较[(11.43±3.60)个月vs(11.71±4.71)个月],差异无统计学意义(P=0.891)。两组患者的OS、RFS生存分析见图2,3。

表1 AML患者的临床基线特征Tab. 1 Clinical baseline characteristics of AML patients [n(%),M(P25-P75)]
AML:acute myeloid leukemia;CBC:complete blood count;WBC:white blood count;ANC:absolute neutrophils count;HGB:hemoglobin;PLT:platelet;MDS:myelodysplastic syndrome.

图1 DAC序贯或同时联合标准诱导方案治疗AML缓解率比较Fig.1 Remission rate of sequential group and simultaneous group
DAC:decitabine;AML:acute myeloid leukemia;ORR:overall response rate;PR:partial response;CR:complete response.
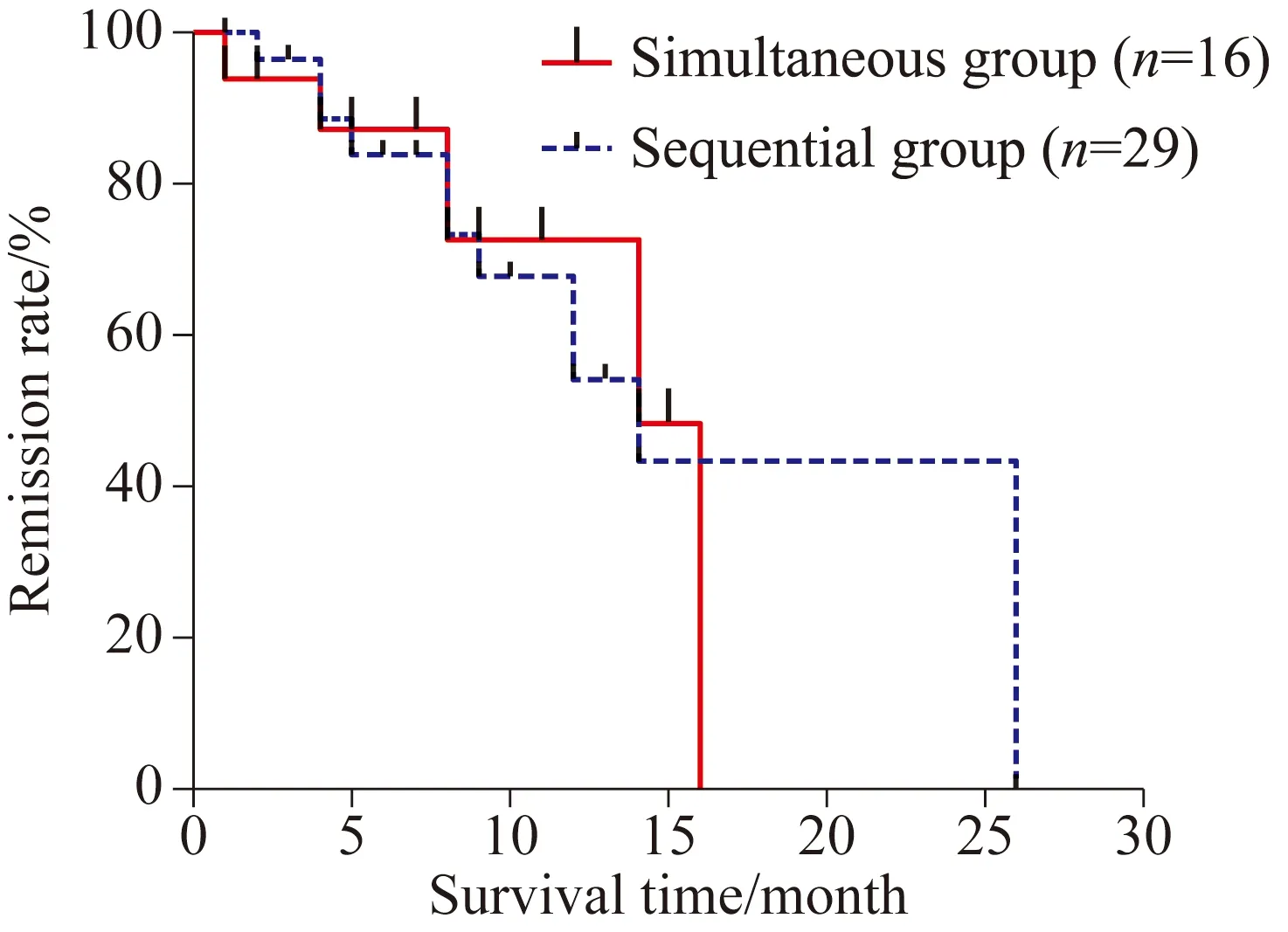
图2 DAC序贯或同时联合标准诱导方案治疗AML总生存比较Fig.2 Overall survival of sequential groupand simultaneous group

图3 DAC序贯或同时联合标准诱导方案治疗AML无复发生存比较Fig.3 Relapse-free survival rate of sequential group and simultaneous group
2.3 不良反应
血细胞减少与感染为主要不良反应,首次诱导治疗结束后45例患者均合并3/4级骨髓抑制。序贯组粒缺持续时间明显高于同时用药组[15.0(0.0~38.0)dvs8.5(0.0~40.0)d],差异有统计学意义(z=3.363,P<0.001);序贯组3/4级贫血持续时间较同时用药组延长;红细胞和血小板输注量也高于同时用药组[红细胞输注量:8.0(0.0~18.0)Uvs4.0(0.0~12.0)U,z=1.644,P=0.100;血小板输注量:5.0(0.0~10.0)Uvs3.5(0.0~13.0)U,z=0.670,P=0.503],但两组之间差异无统计学意义(表2)。首次诱导化学药物治疗结束后两组患者均伴不同程度感染,感染部位主要为呼吸道、胃肠道、泌尿系、皮肤软组织及血液,以呼吸道感染最为常见,达50%以上(图4);序贯组与同时用药组各部位感染发生情况未见明显差异,但序贯组胃肠道、皮肤软组感染发生率较高;经积极抗感染治疗后大部分病情可得到有效控制。

图4 DAC序贯或同时联合标准方案治疗AML感染发生比较Fig.4 Incidence of infection for sequential group and simultaneous group
DAC:decitabine;AML:acute myeloid leukemia.

表2 两组骨髓抑制时间比较Tab. 2 Time of myelosuppression for sequential
3 讨论
急性髓系白血病是起源于骨髓造血干/祖细胞的遗传异质性恶性克隆性疾病。随着二代测序的应用和分子生物学机制的深入研究,DNA相关甲基化基因突变在AML患者发病机制中起着重要作用,并在疾病诊断、预后分层和生物学靶向治疗的方面均具有关键意义[6-8]。目前对于AML患者,临床上标准的诱导方案即“3+7”方案仍为主要治疗方案;对既往有MDS病史,或伴DNA高甲基化相关基因突变患者,可加入去甲基化药物以提高治疗效果。DAC是一种5-氮杂-2′-脱氧胞嘧啶类似物,通过抑制DNA甲基转移酶DMNT而达到去甲基化的作用,从而激活沉默失活的抑癌基因,促进细胞分化或凋亡,发挥抗肿瘤效应[9]。目前,地西他滨在MDS治疗中疗效确定,但其在AML患者中临床研究相对较少,地西他滨单药治疗AML缓解率较低,有效率不足30%[10-13],因此地西他滨联合化学药物治疗在AML患者的治疗效果,以及DAC时间点的选择,尚需临床大样本研究。
Leonard等[14]在小鼠模型中发现与单用Ara-C相比,DAC序贯Ara-C可明显降低肿瘤负荷。Scandura等[15]Ⅰ 期临床研究结果显示地西他滨序贯标准“DA3+7方案”治疗AML患者,CR率达57%,PR率为33%且不良反应可耐受。Kongfei等[16]发现DAC序贯IDA抑制AML细胞增生效应最佳,主要机制为通过抑制Wnt/β-catenin 信号,协同抑制AML细胞增生并诱导其凋亡,发挥抗白血病效应。国内有研究[17]显示DAC同时联合IA方案或CAG方案治疗老年AML患者,总有效率分别为64.7%、56.7%,两组间的中位缓解时间、中位生存期及骨髓抑制均差异无统计学意义。郝杰等[18]对DAC序贯DAG方案、CAG方案和“3+7”标准方案治疗复发/难治急性髓系白血病的疗效进行了比较分析,发现3组的ORR分别为47.4%、37.6%、18.2%,地西他滨序贯DAG方案组显著优于“3+7”标准方案组(P<0.05),地西他滨联合DAG组患者的生存时间明显长于“3+7”组(P<0.05),分别为7.5、4.0和3.0个月。
本研究中,DAC联合“3+7”方案治疗AML的CR率达到42.2%,总有效率为75.56%,高于其他文献[16-17]报道结果,可能与本组初发患者以预后中等AML为主有关。根据地西他滨用药时间点不同,分为序贯组和同时用药组,两组患者在临床特征、预后分组及前期有无MDS病史比较,差异均无统计学意义(P>0.05);29例序贯组患者ORR为75.9%,OS为(7.25±4.61)个月,16例同时用药组ORR为75.0%,OS为(8.48±5.42)个月,差异无统计学意义(P>0.05),表明DAC不同时间点联合“3+7”方案治疗AML患者的治疗效果无差异。地西他滨主要不良反应为骨髓抑制。本研究中,两组患者最常见的不良反应也为骨髓抑制,主要为3/4级骨髓抑制,以中性粒细胞、血小板减少及贫血较常见,中位骨髓抑制时间13.0(0.0~40.0)d;大多数患者在化学药物治疗后期或结束治疗时即出现骨髓抑制;序贯组粒缺时间较同时用药组明显延长,增加感染风险,主要表现为胃肠道、肛周及皮肤软组织感染发生率相对较高;可能与序贯组用药时间长、药物代谢周期等有关;提示同时用药组更适用于以血细胞减少发病的、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分2分以上的患者。但因样本量较少,且为单中心研究,须纳入更多患者进行深入的研究。
综上所述,地西他滨联合“3+7”方案治疗初治AML患者的疗效与两者间的用药时间无明显相关性,但序贯用药时骨髓抑制期延长,主要表现在粒细胞缺乏持续时间上的延长,增加感染风险,因此对于发病时白细胞较低、耐受性差的患者应注意用药时间的选择,同时积极预防感染的发生。

