H10亚型和N8亚型禽流感病毒三重RT-PCR检测方法的建立
罗思思,谢芝勋,谢志勤,谢丽基,邓显文,范 晴,黄娇玲,张艳芳,王 盛,曾婷婷,张民秀
(广西壮族自治区兽医研究所,广西兽医生物技术重点实验室, 南宁 530001)
禽流感病毒(Avian influenza virus, AIV)根据表面糖蛋白(hemagglutinin, HA)和神经氨酸酶(neuraminidase, NA)抗原性差异分为不同的亚型,目前已发现有18种HA亚型(H1-H18)和11种NA亚型(N1-N11)[1-2]。2013年12月6日,江西省南昌市一名73岁女子罹患H10N8甲型禽流感,因呼吸衰竭、休克死亡,全球首次发现人类感染H10N8亚型AIV可导致死亡。截至2014年2月15日,在江西共确诊3人感染H10N8亚型AIV,其中2人死亡[3-4]。H10和N8亚型AIV在家禽和野鸟散发,主要是H10N7和H3N8[5]。H10N8亚型AIV感染人虽散发,但是否存在后续的感染,或是否存在H10亚型和其他N亚型、其他H亚型和N8亚型的感染,均需监测H10和N8亚型AIV的感染情况,因此,十分有必要建立一种同时鉴定H10亚型和N8亚型AIV的检测方法,为这两个亚型的检测提供有效方法和技术储备。
目前,诊断H10亚型和N8亚型AIV的方法主要是病毒分离鉴定,作为诊断的金标准,结果准确可靠,但存在检测周期长的缺点;免疫荧光和酶联免疫吸附试验均需特定的阳性血清,在实际应用中有一定的局限性。多重RT-PCR是在普通RT-PCR基础上发展而来的,已成功应用于很多病原体的检测[6-8]。H10亚型和N8亚型的分子生物学检测方法十分欠缺,本研究旨在建立一种同时检测H10亚型、N8亚型和所有亚型AIV的三重RT-PCR方法,同时对3个目的基因进行扩增,以节约检测试剂,简化反应程序。
1 材料与方法
1.1 毒株和主要试剂 AIV毒株(H3N8、H6N8、H1N1、H3N2、H4N6、H6N1、H9N2和H11)、新城疫病毒(NDV)、传染性支气管炎病毒(IBV)、传染性喉气管炎病毒(ILTV)和传染性法氏囊病毒(IBDV)由广西兽医研究所分离鉴定保存;AIV毒株(H2N3、H8N4、H10N3、H12N5)由香港大学惠赠;AIV毒株(H10N7、H5N1、H7N2、H13N6、H14N5、H15N9和H16N3)cDNA由美国康涅狄格大学惠赠;AIV毒株(H1N7和H11N9)由美国宾夕法尼亚州立大学惠赠。Minibest viral RNA/DNA extraction kit ver.4.0和反转录试剂和PCR premix购自大连宝生物公司。
1.2 引物设计 根据基因库中H10亚型AIV 的HA基因、N8亚型AIV的NA基因和所有亚型AIV的M基因,用DNAStar软件比对序列找出保守区域,用primer 5.0软件分析引物的扩增条件,每个基因均设计了3对特异性引物,并用NCBI Blast初步验证引物的特异性。序列送至广州invitrogen公司合成。引物合成后,通过实际试验进行平行筛选,最终各自筛选出最佳的1对引物(表1),用于H10亚型、N8亚型和所有亚型AIV的检测。

表1 引物信息Tab 1 The information of primers
1.3 病毒RNA提取与RT-PCR反应条件的优化
按照Minibest viral RNA/DNA extraction试剂盒说明书抽提病毒RNA,并将RNA反转录为cDNA。PCR反应体系25 μL:2×PCR premix 12.5 μL,正、反引物终浓度在0.1~0.6 μmol/L之间调整,cDNA 2 μL,以无RNA酶的超纯水补足25 μL。反应程序如下: 94 ℃ 5min;94 ℃ 40 s, 50~57 ℃之间调整 40 s, 72 ℃ 40 s, 30个循环;72 ℃ 10 min。
1.4 标准品的制备 用HA、NA和M基因全长引物,分别以H10亚型、N8亚型AIV和任一亚型AIV的RNA为模板进行RT-PCR扩增,得到基因全长的目的片段,将这3个基因片段分别连接至pGEM T-easy载体上,将含有HA、NA和M基因片段的正确序列的重组质粒分别命名为H10、N8和M。
1.5 特异性试验 按照优化好的反应条件,用所建立H10亚型和N8亚型AIV三重RT-PCR检测方法对1.1项所列毒株的RNA/DNA进行检测,检验其特异性。
1.6 敏感性试验 将“1.4”构建好的重组质粒进行等比例混合,并将混合质粒10倍梯度稀释,按照优化好的反应条件,用所建立的方法对其进行PCR扩增,检验其敏感性。
1.7 临床样品检测 用所建立的方法对120份活禽市场棉拭子(同一只家禽的咽喉、泄殖腔拭子为一份)样品进行检测,同时将这120份样品接种10日龄SPF鸡胚增殖病毒,用血凝试验(HA)和血凝抑制试验(HI)对尿囊液进行HA亚型的鉴定,将鉴定过的HA毒株,用NA基因全长引物PCR扩增和测序,确定NA亚型。
2 结果与分析
2.1 反应条件的优化 通过引物之间浓度的优化,H10-F和H10-R引物终浓度为0.2 μmol/L,N8-F和N8-R引物终浓度为0.4 μmol/L,M-F和M-R引物终浓度为0.2 μmol/L。通过退火温度的优化,确定最佳退火温度为52 ℃。
2.2 特异性试验 该法对H10和N8亚型AIV的混合模板扩增出3条特异性条带,分别为267、464和693 bp;对H10Ny(如H10N7、H10N3,y≠8)亚型AIV扩增出2条特异性条带,片段大小为267和693 bp;对HxN8(如H6N8、H3N8,x≠10)亚型AIV扩增出2条特异性条带,片段大小为464和693 bp;对其他亚型AIV扩增出693 bp M基因通用检测的条带;而常见禽病病原体均未扩增出任何条带。所有毒株的扩增结果均与实际相符,表明该法特异性强。部分毒株的扩增结果见图1。
2.3 敏感性试验 该法对浓度为108~10拷贝/μL的H10、N8和M混合质粒进行敏感性测定,图2结果显示:浓度为108~104拷贝/μL的混合质粒均有3条明显的扩增条带出现,片段大小分别为267 bp(H10)、464 bp(N8)、693 bp(M);浓度为103拷贝/μL的混合质粒有2条明显的扩增条带出现,片段大小分别为267 bp(H10)、464 bp(N8),已检测不到693 bp M基因条带;浓度为100拷贝/μL混合质粒的检测均无扩增条带。结果表明,H10和N8亚型AIV的最低检测限为103拷贝/μL,AIV M基因引物最低检测限为104拷贝/μL。

M. 100 bp Marker; 1. H10+N8; 2. H10N7; 3. H6N8; 4. H1N1; 5. H1N7; 6. H2N3; 7. H3N2; 8. H4N6; 9. H5N1; 10. H6N1; 11. H7N2; 12. H8N4; 13. H9N2; 14. H11N9; 15. H12N5; 16. H13N6; 17. H14N5; 18. H15N9; 19. H16N3; 20. NDV;21. IBV; 22. ILTV; 23. IBDV; 24. 空白对照图1 特异性试验结果Fig 1 The results of specificity test
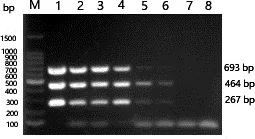
M. 100 bp Marker; 1. 108拷贝/μL; 2. 107 拷贝/μL; 3. 106 拷贝/μL; 4. 105 拷贝/μL; 5. 104 拷贝/μL; 6.103拷贝/μL; 7. 100拷贝/μL; 8.阴性对照图2 敏感性试验结果Fig 2 The results of sensitivity test
2.4 临床样品检测 用所建立的H10N8亚型AIV三重RT-PCR方法对120份活禽市场样品进行检测,结果检出2份H10Ny亚型AIV(y≠8),3份HxN8(如x≠10),与HI和测序结果一致。
3 讨论与结论
在2013年12月江西发现人类感染H10N8之前,公共资源只能查到26株H10N8的序列;H10亚型曾有感染人的报道,分别是2004年埃及H10N7和2010年澳大利亚H10N7,病人出现结膜炎和轻度呼吸道症状,N8亚型未有感染人的报道[5];我国仅有两例H10N8亚型AIV感染家禽的报道,一株是2007年从湖南洞庭湖湿地抽检的水样中分离到的[9],被命名为A/environment/Dongting Lake/Human/3-9/2007(H10N8),另一株则是于2012年1月从广东活禽市场的鸭中分离出来[10],被命名为A/Duck/Guang-dong/E1/2012(H10N8)。此次江西人类感染株与之前的H10N8不同,尤其6个内部基因均来源于H9N2。2013年爆发的H7N9毒株的6个内部基因也来源于H9N2,但H10N8的6个内部基因与H7N9不同。有报道对江西第一例H10N8亚型AIV人类感染株(A/Jiangxi-Donghu/346/2013)的受体结合特性进行了研究,结果表明对人源受体亲和力极弱,并不具备在人群中传播的能力[4]。
目前,H10N8感染人有3个病例,在人类属于散发,但已能在活禽市场中分离出鸡H10N8[11]。我们对广西活禽市场进行AIV调查,H10较多与其他亚型混合感染,尚未单独分离出H10亚型,N8亚型鉴定出的有H3N8、H4N8、H6N8,尚未分离出H10N8毒株[12]。由于样品限制,并未用H10N8毒株对该法进行验证,在特异性试验中,只用H10和N8亚型混合模板来验证该三重RT-PCR的特异性,还需更多临床样品对该法进行验证。基于我们对AIV的日常监测,发现相比以前,H10亚型和N8亚型分离率有所增加,并鉴于发生了H10N8感染人的案例,且之前就有H10亚型与其他N亚型(H10N7、H10N2、H10N1)[13-15],其他H亚型与N8亚型的报道(H3N8、H4N8、H6N8),因此本研究想建立同时鉴定H10亚型和N8亚型AIV检测方法,对这两个亚型进行追踪检测,为AIV的有效防控提供参考资料。
本研究将M基因通用检测所有亚型AIV的引物,与H10亚型、N8亚型AIV的引物混合在同一反应体系中,对样品中含有H10亚型和N8亚型的,多一道验证其确属AIV的感染,对样品中含有其他亚型AIV的,也能检测出,让我们了解到是否存在AIV的感染,为是否需要进一步确认其他亚型AIV提供参考。引物设计和浓度的优化是该法成功建立的关键。本研究针对H10、N8和M基因序列保守区域,结合primer 5.0软件的引物参数,初步筛出候选引物,再用NCBI-BLAST模拟检查引物的特异性,但引物是否真正可行,还需经过实际的试验来验证。通过优化3对引物之间的浓度,用单一模板(H10亚型、N8亚型、不同亚型AIV)、混合模板(H10和N8亚型)和常见禽病病原体作为模板对该法进行特异性的验证,用含有H10、N8和M基因的质粒标准品进行敏感性测定,结果表明所建立的H10亚型和N8亚型AIV三重RT-PCR检测方法特异性强、敏感性高,一管即可检测H10、N8和M三个目的基因,具有有效、简便、快速、省时省力的优点,为H10亚型和N8亚型AIV调查监测提供技术支持。

