人脐带间充质干细胞对1型糖尿病鼠肝脏损伤的保护作用
赵琳 张涛 迟静薇 李勇 王韵阳 吕文山 王伟 王颜刚
1型糖尿病(type 1 diabetes mellitus,T1DM)是一种由胰岛β细胞特异性免疫损伤引起的自身免疫疾病。肝脏作为长期高血糖累及的靶器官之一,近年来其导致的肝损伤也逐渐得到人们的关注,有研究报道[1],细胞因子活性可反应肝细胞损伤的程度。间充质干细胞(mesenchymal stem cells,MSCs)具有直接或间接的抗炎、抗纤维化、抑制肝细胞凋亡和刺激肝细胞再生的作用[2-3]。因此MSCs可作为糖尿病肝损伤细胞治疗的理想种子细胞。Kakinuma等[4]体外实验表明,MSCs可诱导成肝实质细胞,认为其可能具有肝脏修复功能,但是目前应用MSCs治疗糖尿病肝损伤的体内实验研究相对较少。本研究采用hUCMSCs干预非肥胖糖尿病(no obesity diabetes,NOD)小鼠,探讨其对肝脏损伤的保护作用及可能机制,为糖尿病肝脏损伤的临床治疗提供新的思路。
材料与方法
一、材料
1.实验动物:SPF级健康雌性NOD小鼠,6 ~ 8 周龄,体重 20 ~ 24 g,由南京模式动物中心提供。小鼠自由饮食饮水。
2.试剂:胎牛血清、DMEM-LG、0.05%胰酶、100× 双 抗(美 国 HyClone公 司),CD73、CD90、CD105、CD34、CD45、CD14、HLA-DR 等 流 式抗体(美国BD公司),小鼠晚期糖基化终末产物(advanced glycation end products,AGEs)ELISA 试剂盒(武汉华美生物工程有限公司);TRIzol(美国 Invitrogen公司);TRUEscript 1st Stand cDNA Synthesis Kit试剂盒、2×Sybr Green qPCR Mix 荧光定量检测试剂盒[宝生物工程(大连)有限公司]。
二、方法
1. hUCMSCs的培养与鉴定:人脐带来源于健康剖宫产产妇足月新生儿,且经产妇签署知情同意。脐带洗净剪成1 mm3,经Ⅰ型胶原酶消化后,离心洗涤,去上清液,将沉淀接种于培养皿,置于37 ℃、体积分数5%的CO2培养箱培养,待细胞融合率达80%~ 90%时,用0.05%胰酶消化,按1 : 2的比例传代。培养细胞经流式细胞仪检测符合相关细胞表型,即CD73、CD90、CD105表达为阳性,CD34、CD45、CD14和HLA-DR表达为阴性。
2.动物分组及干预:NOD小鼠进行适应性饲养1周后,连续饲养8周,其中每周称重1 次和检测随机血糖,测得的随机血糖连续2次≥16.6 mmol/ L 时诊断为T1DM小鼠。将所有糖尿病小鼠随机分组,干细胞组:发病后第3天通过尾静脉注射hUCMSCs 1×106(0.3 ml PBS混悬)治疗;糖尿病组:糖尿病发病后不采取任何干预措施。同时设正常对照组:饲养9周后均未检测到血糖升高的NOD小鼠。各组小鼠以发病当天记作第0天,其中每周检测随机血糖水平。3个月后处死小鼠,剪下整个肝脏,分别置于4%多聚甲醛和去RNA酶的EP管(至少2份)中,以备进行包埋切片和提RNA使用。
3. HE染色及肝损伤评估:4%多聚甲醛中取出小鼠肝脏组织,经脱水、透明、浸蜡、包埋、切片、贴片制成组织切片,行HE染色;脱蜡、脱水:将切片放在二甲苯中脱蜡15 min,后酒精由高浓度到低浓度各浸泡1 min后蒸馏水中;染色:切片置于苏木精溶液染色数分钟;自来水冲洗,1%盐酸乙醇分化;自来水冲洗,稀氨水反蓝;蒸馏水冲洗,伊红染色2 ~ 3 min,自来水冲洗;脱水:将染色后的切片置于高浓度(95%)乙醇里;透明:切片经二甲苯透明;封固:把树胶滴到透明的切片中,附上盖玻片并贴标志;上镜:光镜下观察皮肤组织各种结构并统计差异。
4. ELISA法检测肝脏AGEs水平:采用BC A法检测小鼠肝脏中蛋白的含量。设置标准孔和待测样本孔,每孔分别加标准品或待测样本100 μl,于37 ℃温育2 h,弃去液体,甩干。分别加入100 μl生物素标记抗体工作液,于37 ℃温育1 h。弃去液体后甩干,加入200 μl洗液,静置2 min,弃去液体后甩干,重复3次。分别向每孔加入辣根过氧化物酶标记亲和素工作液100 μl,37 ℃温育1 h,将孔内液体倒掉并甩干,洗板5次。按顺序分别加入底物溶液 90 μl,避光,放置于 37 ℃温箱,显色 15 ~ 30 min。按顺序分别加入终止液50 μl,终止反应。反应终止后,在5 min内测OD值:将酶标仪设定在450 nm波长,测量各孔的吸光度(OD值),根据标准品OD值制定标准曲线,并依次计算AGEs浓度。
5.定量 PCR 法检测肝脏 RAGE、NF-κB p65、IL-6、TNF-α mRNA 表达水平:Trizol法提取组织总RNA,反转录反应体系反转录成 cDNA,以1 μl cDNA为模板。设计定量PCR引物,并委托上海生物工程有限公司合成(表1),PCR 反应 95 ℃,5 s;60 ℃退火,30 s,40 个循环;融解 95 ℃,15 s,60 ℃,1 min。反应结束后,记录荧光曲线并分析计算出Ct 值,ΔCt为样品 Ct—内参照 Ct,取 2-Δt代表被检样品mRNA相对表达量。
三、统计学分析方法
采用SPSS 22.0统计软件进行统计学分析。小鼠不同时点血糖浓度,小鼠肝脏组织AGEs,IL-6、NF-κB p65、TNF-α 及 RAGE mRNA 表达 水 平 以x± s表示,采用单因素方差分析和SNK-q检验进行统计学分析,以P< 0.05为差异具有统计学意义。
结 果
1.小鼠一般状况:与正常对照组小鼠相比,糖尿病组小鼠对外界刺激反应迟钝,饮水、进食明确增多,精神萎靡,体型持续消瘦,而经胰岛素组和干细胞治疗后的小鼠多饮、多尿、多食、消瘦情况较轻,皮毛脱落现象较少。
2.小鼠血糖水平的改变:与正常对照组相比,糖尿病组小鼠各点血糖均升高(表2、表3,P<0.05);而胰岛素组及干细胞治疗组在治疗7 d后血糖水平开始呈现下降趋势,与糖尿病组相比差异具有统计学意义(P<0.05),且干细胞组血糖水平较胰岛素组血糖水平下降,差异具有统计学意义(P<0.05)。

表1 Real-time qPCR引物序列
表2 小鼠不同时点血糖浓度(mmol/L,± s)
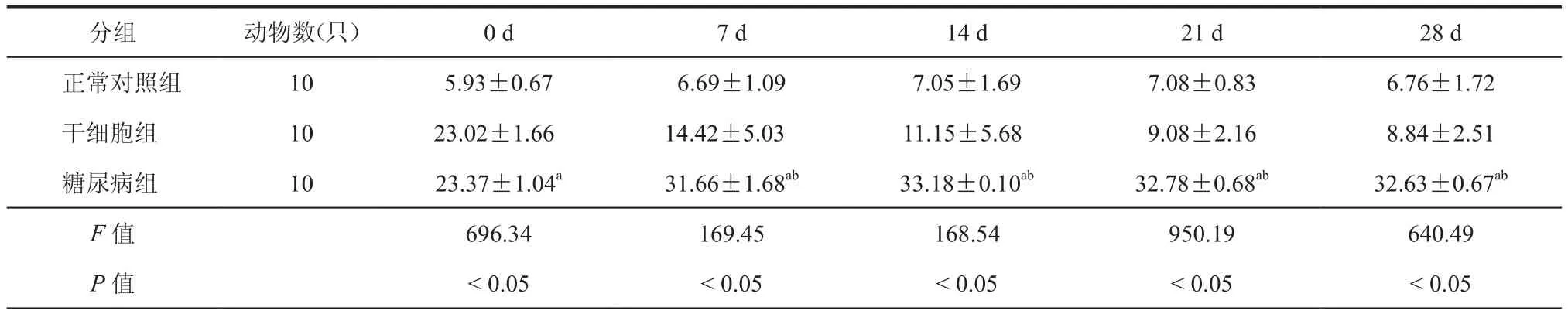
表2 小鼠不同时点血糖浓度(mmol/L,± s)
注:与对照组比较,aP < 0.05;与干细胞组比较,bP < 0.05
分组 动物数(只) 0 d 7 d 14 d 21 d 28 d正常对照组 105.93±0.676.69±1.097.05±1.697.08±0.836.76±1.72干细胞组 1023.02±1.6614.42±5.0311.15±5.689.08±2.168.84±2.51糖尿病组 1023.37±1.04a 31.66±1.68ab 33.18±0.10ab 32.78±0.68ab 32.63±0.67ab F值 696.34169.45168.54950.19640.49 P 值 < 0.05 < 0.05 < 0.05 < 0.05 < 0.05
表3 小鼠不同时点血糖浓度(mmol/L,± s)
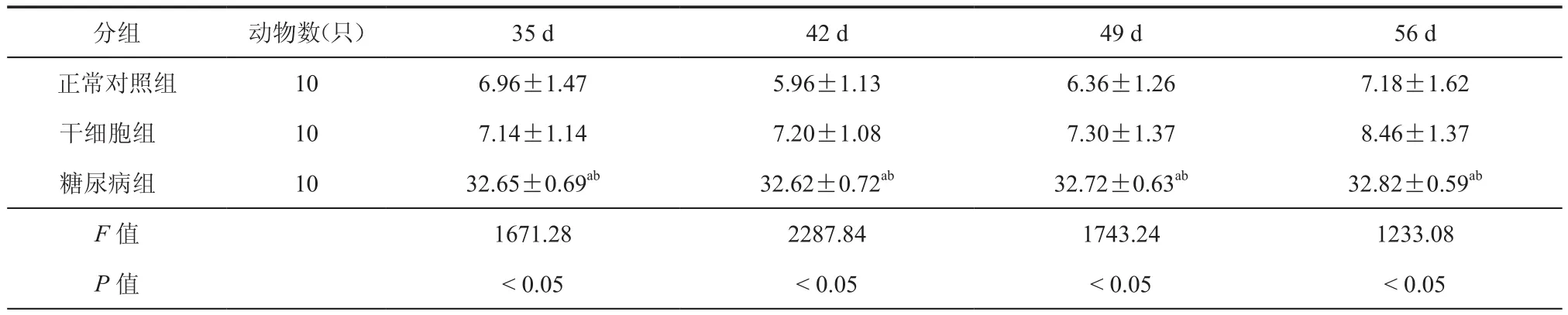
表3 小鼠不同时点血糖浓度(mmol/L,± s)
注:与对照组比较,aP < 0.05;与干细胞组比较,bP < 0.05
分组 动物数(只) 35 d 42 d 49 d 56 d正常对照组 106.96±1.475.96±1.136.36±1.267.18±1.62干细胞组 107.14±1.147.20±1.087.30±1.378.46±1.37糖尿病组 1032.65±0.69ab 32.62±0.72ab 32.72±0.63ab 32.82±0.59ab F值 1671.282287.841743.241233.08 P 值 < 0.05 < 0.05 < 0.05 < 0.05
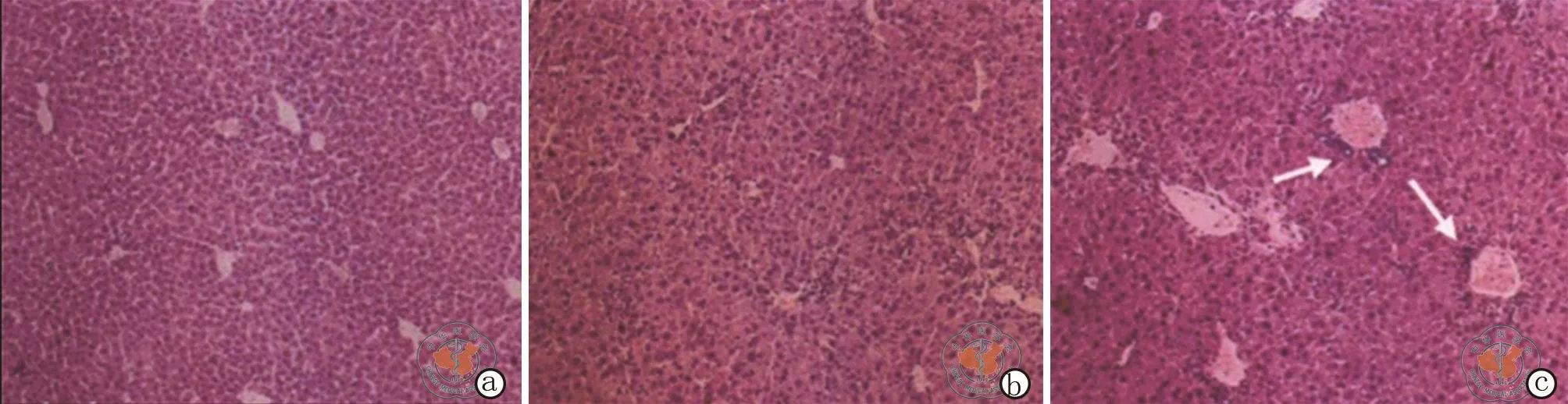
图1 光学显微镜下观察各组小鼠肝脏形态(HE染色,×200)
表4 小鼠肝脏组织 AGEs,IL-6、NF-κB p65、TNF-α 及 RAGE mRNA 表达水平(± s)

表4 小鼠肝脏组织 AGEs,IL-6、NF-κB p65、TNF-α 及 RAGE mRNA 表达水平(± s)
注:与对照组比较,aP < 0.05;与干细胞组比较,bP < 0.05
分组 动物数(只) AGEs(ug/ml) IL6(×10-2) NF-κB p65(×10-2) TNF-α(×10-2) RAGE(×10-2)正常对照组 100.50±0.116.19±0.367.05±0.207.81±0.310.95±0.16干细胞组 100.72±0.109.31±1.6710.08±1.9411.92±1.823.87±0.27糖尿病组 101.35±0.22ab 18.04±1.69ab 15.46±3.09ab 22.12±3.23ab 5.12±0.26ab F值 85.9192.82128.33141.23186.82 P 值 < 0.05 < 0.05 < 0.05 < 0.05 < 0.05
3.小鼠肝脏组织病理学改变(图1):HE染色显示,正常对照组小鼠肝组织中肝细胞形态正常,肝小叶结构清晰,肝细胞索排列整齐,偶尔可见少量炎症细胞浸润,整体为正常肝脏形态;糖尿病组小鼠肝脏HE可见肝小叶结构异常,肝细胞边界不清晰,肝细胞索排列紊乱,假小叶形成,肝细胞肿胀,间质内可见较明显的炎症细胞浸润,肝损伤较为严重;干细胞组与糖尿病组小鼠相比肝细胞形态较为正常,肝细胞肿胀、肝小叶破坏及假小叶形成情况均有较明显的改善,肝损伤程度明显降低。
4.小鼠肝脏组织AGEs水平变化:将各组小鼠肝脏提总蛋白后检测AGEs水平,结果发现正常对照组肝脏中AGEs的表达量为(0.50±0.11)pg/ml,糖尿病组小鼠肝脏中AGEs量为(1.36±0.22) pg/ ml,两组间表达差异有统计学意义(表3、P< 0.05)。干细胞组小鼠肝脏中AGEs的表达水平低于糖尿病组小鼠肝脏表达水平,差异均有统计学意义(P< 0.05)。
5.小鼠肝脏组织 RAGE、NF-κB p65、IL-6 及TNF-α mRNA表达水平(q-PCR法)改变:与正常组相比,其他两组 RAGE、p65、IL-6、TNFα mRNA 表达均上升,差异有统计学意义(表4,P< 0.05);干细胞组小鼠肝脏中以上各基因mRNA表达水平均低于糖尿病组,差异有统计学意义(P< 0.05)。
讨 论
近年来,1型糖尿病发病率不断升高[5],严重影响着人类的健康。肝脏损伤是1型糖尿病重要的并发症之一,慢性炎症等因素是糖尿病肝损伤的主要原因[6],但其具体的致病机制尚不十分清楚。揭示糖尿病肝损伤的发生发展机制,寻找新的治疗方法对于降低糖尿病肝脏疾病并发症发病率,延长患者生存期具有非常重要的意义。
糖尿病肝脏损伤的病理生理机制十分复杂,其中一个非常重要的原因便是高血糖导致的高糖积累。本组资料结果显示:血糖最高的糖尿病组小鼠的肝脏损伤最为严重,而干细胞组由于高血糖有所缓解,肝脏损伤亦有所减轻。有研究显示,AGE/ RAGE途径在糖尿病肝脏损伤并发症的发病机理和进展中发挥着一定的作用[7]。另有研究表明,在糖尿病患者中,AGEs/RAGE通路的激活可以通过影响细胞内多种转录因子的表达和活性,导致基因转录调控过程改变[8]。已有研究指出,通过激活caspase-8,NF-κB和JNK途径,可以增强T1DM大鼠肝脏中的TNF-α表达,这可能是导致肝脏凋亡细胞死亡的关键[9]。研究发现,NF-κB的P65亚基在组织炎症损伤中过度表达[10]。NF-κB由p65、p50、IκB-α 3个亚基的异源二聚体组成,释放的p65亚基和p50亚基可以转移到细胞核中,促进IL-6、TNFα等炎症介质的释放,加重炎症损伤[11]。同时,AGEs与NF-κB的P65亚基结合可以导致RAGE表达升高,导致正反馈激活,进一步增加受体表达[12]。本研究结果显示,与正常组相比,AGEs在糖尿病发病后表达升高;Real-time PCR结果显示糖尿病组小鼠肝脏组织中 RAGE、p65、IL-6、TNFα mRNA 表达较正常组小鼠肝脏组织表达升高,证明AGEs/ RAGE可能参与了糖尿病肝脏损伤的发生发展过程。
MSCs是细胞治疗领域的明星分子,其免疫调节能力、自我更新和多向分化的潜能为其应用于临床提供了理论基础。MSCs以其独特的优越性而在临床应用中更受青睐。越来越多的研究表明,MSCs能以多种方式保护糖尿病肝脏损伤,如免疫调节,控制炎症反应,促进组织修复等[13-15],MSCs治疗可以抑制AGEs/RAGE通路的表达,抑制炎症反应,从而减轻由糖尿病并发的肝脏损伤[16]。本组资料MSCs组的随机血糖明显低于糖尿病组,可能与控制了胰岛的炎症反应有关。MSCs组小鼠肝脏组织中各因子表达水平较糖尿病组明显下降,这充分证明了MSCs对糖尿病肝损伤的治疗意义,为糖尿病肝损伤的治疗提供了新的思路。
本研究结果表明:MSCs移植能明显改善糖尿病小鼠的高血糖状态,改善肝脏微观病理状态,降低AGEs浓度及某些炎性因子的水平,从而减轻肝脏损伤,对糖尿病性肝损伤有保护作用。虽然MSCs治疗目前还面临诸多问题,但相信随着科学技术的发展,MSCs终将会为1型糖尿病的治疗创造奇迹。

