贵州省某热泉中可培养细菌的多样性及不同温度胁迫下的变化*
牛雪可, 邱文, 兰永哲, 李文均, 廖万清, 沈志平, 余能彬, 邹成刚, 康颖倩*
(1.贵州医科大学 基础医学院 微生物学教研室, 贵州 贵阳 550025; 2.贵州省微生物与人类健康关系研究人才基地暨贵州省普通高校病原生物学特色重点实验室, 贵州 贵阳 550025; 3.中山大学 生命科学学院, 广东 广州 510275; 4.第二军医大学 上海长征医院 真菌学研究所, 上海 200003; 5.贵州正业国际工程企业管理集团有限公司, 贵州 贵阳 550000; 6.云南大学 云南生物资源保护利用国家重点实验室, 云南 昆明 650091)
陆地热泉环境属于地球上存在了数十亿年的极端环境之一[1],曾经被认为是无菌环境[2],但是Thomas Brock[3]首次在黄石国家公园热喷口发现Thermusaquaticus,彻底改变了人们对热泉微生物的认识。热泉与地球早期的化学环境相似[4],因此研究热泉中的微生物群落和其结构具有非常重要的研究意义和价值。从1986年至今,中国能源研究会地热专业委员会在中国发现了3 398个热泉,主要集中于云南和西藏[5],该地区的研究者们对热泉中微生物的多样性进行了广泛的研究[6-9]。近年的研究表明,干旱、温度以及盐度等环境变化,可导致微生物代谢及生存能力的明显下降[10-11]。贵州位于中国西南部,蕴藏着大量热泉资源,本次研究样本来自贵州某一新探测、但并未开发的热泉。本研究对该高温热泉中可培养微生物进行了研究,并设置不同培养温度来模拟环境变化,比较不同温度下微生物多样性的差异,为热泉微生物资源的开发奠定基础,为研究温度对热泉微生物多样性变化、进化以及适应机制的形成等理论问题提供菌株资源及实验数据。
1 材料和方法
1.1 样品、材料和仪器
1.1.1样品 2017年9月采集贵州省贵阳市青岩古镇某未开发热泉(26°32′69″N,106°68′65″E),热泉温度90 ℃。将采集的热泉水置于500 mL无菌蓝盖瓶中,4 ℃保存。
1.1.2分离培养基 R2A培养基(g/L):葡萄糖0.5 g,可溶性淀粉0.5 g,胰蛋白胨0.5 g,酵母浸膏0.5 g,酸水解酪素0.5 g,丙酮酸钠0.3 g,K2HPO40.3 g,MgSO4·7H2O 0.05 g,琼脂15 g,蒸馏水1 L,pH7.2。
1.1.3主要试剂及仪器 TIANGEN®细菌基因组DNA提取试剂盒、Genstar®PCR MIX、PCR仪(美国BIO-RAD T100)、电泳仪(美国BIO-RAD)、小型台式高速离心机(Thermo 17R)以及恒温培养箱(跃进HH-B11)。
1.2 方法
1.2.1菌种分离培养及保存 将采集到的热泉水样10倍稀释后,取100 μL涂布于R2A平板上,分别置于70、65、60、55、50、45、37以及25 ℃恒温培养5 d,挑取单个菌落进行三区划线,分离纯化后置于对应温度培养,直至得到单一纯菌,纯化菌株用甘油管-80 ℃保存。
1.2.2细菌基因组DNA提取及16S rRNA扩增 采用细菌基因组DNA提取试剂盒制备DNA模板,16S rRNA通用引物[12-13]27f(5′-GAGAGTTTGATCCTGGCTCAG-3′)以及1492r(5′-CTACGGCTACCTTGTTACGA-3′)进行PCR扩增,反应体系及条件参照文献[14-16]进行。PCR产物经1.5%琼脂糖凝胶电泳检测后,送英淮捷基(上海)贸易有限公司进行序列测定。
1.2.316S rRNA基因比对及系统发育树构建 将获得的序列在CLUSTAL_X program中进行比对后[17],与现有的纯培养序列在NCBI 数据库(http://www.ncbi.nlm.nih.gov/blast)及EzTaxon-e工具中进行比对[18],下载与比对菌株最相近菌株16S rRNA的基因序列,通过MEGA 5.0软件[19],采用最大拟自然法(maximum-likelihood)构建系统发育进化树[20],选择Kimura’s two-parameter model[21]以Bootstrap 1000 次评价进化树分支聚类的稳定性,进行菌株的聚类及系统发育分析。通过circos 软件作图[22],绘制温度与不同属间多样性结果分布图。使用R语言[23]绘制不同温度压力下热泉细菌多样性差异图。
2 结果
2.1 菌株分离结果
8个温度梯度下,可培养细菌的菌落数量及多样性最丰富的温度为37 ℃。共获得可培养细菌243株,其中25 ℃ 59株,37 ℃ 156株,45 ℃ 9株,50 ℃ 8株,55 ℃ 6株,60 ℃ 5株,65 ℃及70 ℃未分离出可培养细菌。经过比对,所得细菌归属于25个种、20个属、5个纲以及3个门。在属间水平上,α-变形菌纲细菌的多样性最为丰富,包含8个属;其次为β-变形菌纲、γ-变形菌纲和放线菌纲。在菌株数量上,α-变形菌纲属于优势类群,共82株,分属于11个种。25 ℃时优势菌属为Caulobacte属(45.8%),其次为Rhizobium属(20.3%)和Zhizhongheella属(11.9%);37 ℃时,优势菌属为Zhizhongheella属(20.5%)、Vulcaniibacterium属(18.6%)以及Caulobacter属(12.8%);45 ℃优势菌属为Phenylobacterium属(30%);50和55 ℃时,Vulcaniibacterium属及Geobacillus属各占50%;60 ℃时分离出的细菌全部属于Geobacillus属。见图1和图2。
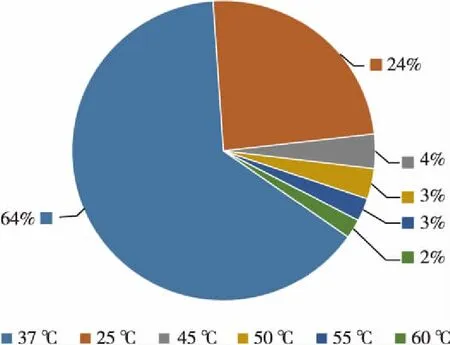
图2 不同温度梯度下热泉可培养菌株的数量分布Fig.2 The strain amount distribution of culturable bacteria in a hot spring under different temperatures
2.2 不同温度压力下热泉中菌株培养结果
在60、55、50、45、37以及25 ℃ 6种培养温度下,分离出的菌株在群落分布上呈现明显的差异。37 ℃培养菌株归属于两个门[变形杆菌门(Proteobacteria)和放线菌门(Actinobacteria)]、4个纲[β-变形菌纲(Betaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)以及放线菌纲(Actinobacteriac)]、 14个属、16种;其中α-变形菌纲多样性最丰富,包含8个属;其余为β-变形菌纲(Betaproteobacteri)、α-变形菌纲(Alphaproteobacteria)芽孢杆菌纲(Bacilli)。在种属水平上,25 ℃分离菌株分属于10个属11种;α-变形菌纲为优势种群,包含7个属;其次为β-变形菌纲包含2个属,芽孢杆菌纲包含1个属。45、50、55以及60 ℃分离菌株分属于α-变形杆菌纲(Alphaproteobacteria)、芽孢杆菌纲(Bacilli)下 5个属。见图3。
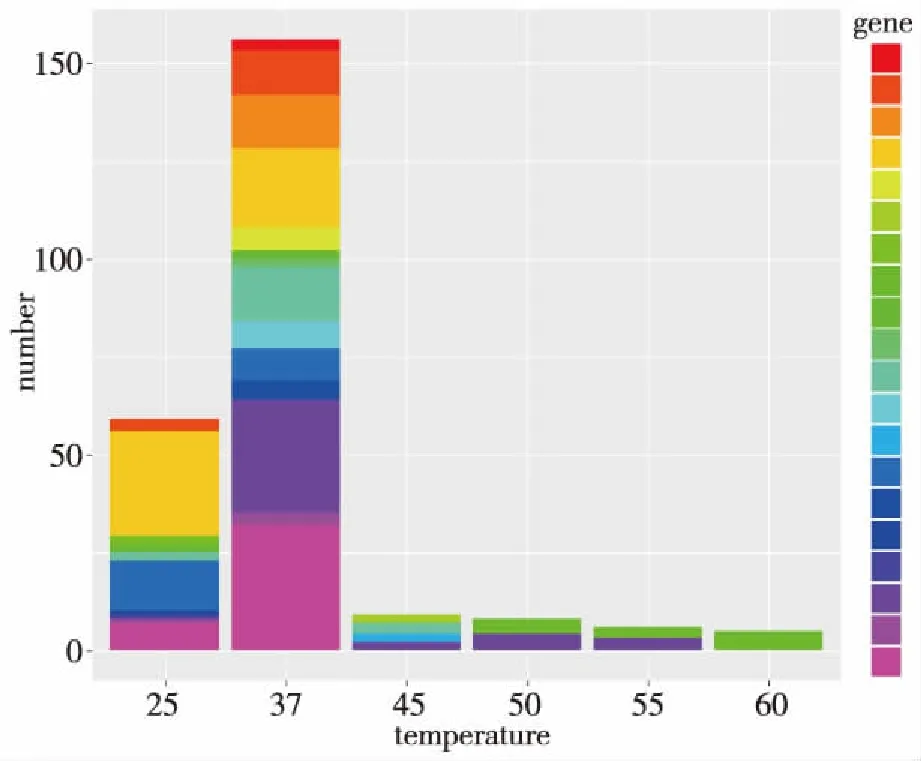
图3 不同温度压力下热泉细菌多样性差异Fig.3 The differential diversity of culturable bacteria in a hot spring under different temperatures
2.3 不同培养温度下分离菌株的系统发育分析
分离纯化菌株,根据形态特征、16S rRNA 序列比对合并,对分离出的20个属,每个温度选择1株构建系统发育进化树,共31株分离菌株,23株标准菌株,构建 M-L系统进化树。分离菌株未出现明显的因温度胁迫而出现的聚类现象,见图4。
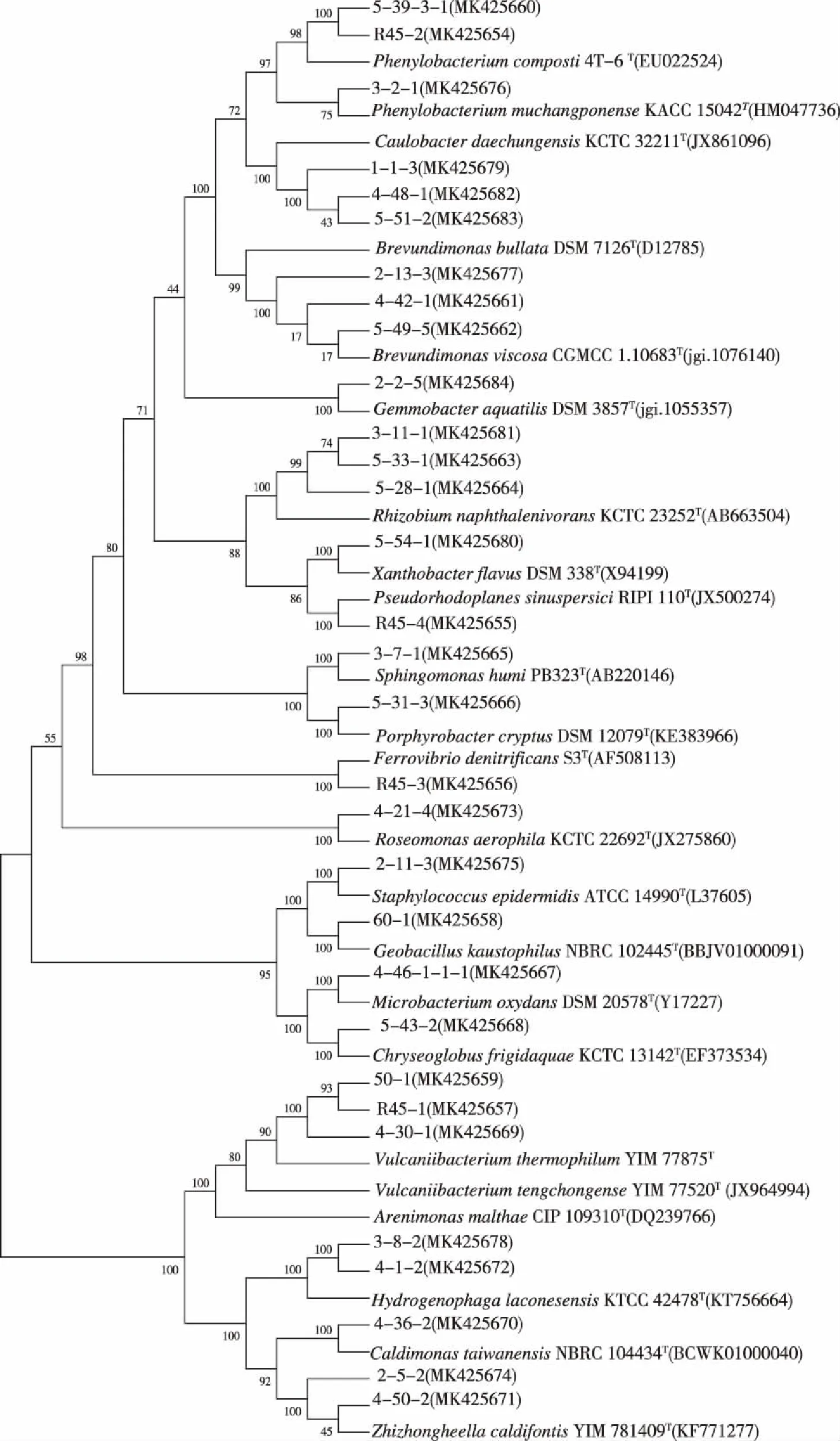
图4 基于分离菌株16S rRNA基因序列构建M-L系统发育进化树Fig.4 Construction of M-L phylogenetic evolutionary tree in term of 16S rRNA sequences
3 讨论
本研究首次对贵州青岩古镇未开发热泉进行了细菌类群的微生物多样性初探,考虑到热泉内营养物质匮乏,且本次研究所采集的样品为水样,故选择使用寡营养、水体微生物培养基R2A培养基。该培养基与常用的2216及LB培养基相比,可避免由于营养条件丰富而导致的优势菌株占比大的问题。本次分离共获得243株可培养细菌,其中变形杆菌门为热泉中最重要的微生物类群,与其他学者对热泉样品进行纯培养的研究结果相一致[24]。本研究优势纲目为α-变形杆菌纲,其次为β-变形杆菌纲,相较于其它地区(平顶山[25]及云南腾冲[26])的研究报道存在一定差异。出现差异可能与热泉本身的温度相关,平顶山等为中低温热泉,云南腾冲为高温热泉,提示可能不同地域热泉微生物群落存在差异,亦可能与分离样本类型不同相关。目前对热泉采样进行纯培养的样本多为热泉底泥或菌席,本次分离样本为热泉水样。以上原因可能导致了热泉中细菌多样性差异。本次研究共分离到约40%的高温细菌类群,如Vulcaniibacterium属、Rhizobium属和Brevundimonas属,获得大量的高温微生物资源,此外还分离出了部分放线菌菌株,栖息在热泉中的放线菌具有独特的代谢活性,具有巨大的开发利用价值;其中Vulcaniibacterium属潜在新种,更是表明了该未开发热泉中可能存在的其它未分出的新分类单元。本研究对贵州当地热泉极端环境的微生物资源和基因资源进行了初步调查,分离得到了具有潜在开发利用价值的微生物资源,为当地热泉微生物资源的开发和保护有重要的理论意义。
温度是调节微生物代谢和生长活力的最重要因素,直接影响微生物细胞中的代谢反应,是决定微生物多样性种类丰度和分布的重要因素之一。温度对微生物类群施加压力,温度胁迫下可能导致特定的菌群选择。目前模拟温度胁迫下的微生物多样性变化,多集中在一般自然环境中,如土壤、淡水中,研究对象包括了细菌、浮游生物及海藻等[27-28],对极端环境中生存的微生物,尤其是热泉环境,在温度影响下其多样性变化是否存在一定规律,与自然环境的研究结果是否存在差异尚未有相关文献报道。本次研究以极端环境中的热泉为研究对象,进行了温度对微生物多样性影响的研究,得出在用于分离的各种培养温度中,热泉中可培养微生物分离多样性及丰度表现出单峰性,具体表现为25~37 ℃增长直至最优,45~60 ℃后迅速下降,37 ℃能分离出数量较多且种类较丰富的微生物。M-L法构建系统发育树显示不同温度的纯养结果并未因温度胁迫而显示出聚类现象,但在种群分布及数量上存在差异。本研究分离结果表明,过高的培养温度和生物多样性丧失是协同作用的,在热胁迫下,物种间多样性降低,可能使各物种间互补性增加,这与García F C等[26]对自然环境的研究结果相一致,说明在热泉这一极端环境中微生物的多样性差异,对温度的响应同自然环境一致。本研究通过人为的温度胁迫,分析热泉中可培养细菌多样性的变化规律,推测在热泉这一极端环境中,微生物群体可能存在的相互作用及其机制;同时也为热泉样品在进行生物多样性研究时,培养温度的选择上提供一定的参考。

