黄铜矿在硫酸溶液中的浸出及电化学氧化机制
郑永飞 华晓鸣 许 茜 鲁雄刚 程红伟 邹星礼
(1.省部共建高品质特殊钢冶金与制备国家重点实验室,上海 200072;2.东北大学 材料科学与工程学院,辽宁 沈阳 110004;3.上海市钢铁冶金新技术开发应用重点实验室,上海 200072;4.上海大学 材料科学与工程学院,上海 200072)
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一[1]。黄铜矿的浸出过程是硫化铜矿湿法浸铜的核心[2- 3]。黄铜矿无论是在常压浸出或是加压浸出的过程中,都面临着表面钝化、浸出速率随时间逐渐变缓的问题[4- 6]。因此,弄清黄铜矿氧化浸出过程的反应机制及其中间产物,对于强化湿法冶金过程具有重要意义。
黄铜矿的浸出速率受黄铜矿表面氧化形成的产物层的限制。很多研究者认为,这些氧化产物层有富铜贫铁硫化物[7- 8],如Cu1- xFe1- yS2- z、CuS、CuSn,铁的氧化物[9- 10]如针铁矿、赤铁矿,以及单质硫[11]等,它们附着在黄铜矿表面从而阻碍金属离子向溶液中转移。在实际浸出过程中,黄铜矿的氧化分步进行,根据反应条件的不同,表面可能产生一层或多层组成各异的钝化层,钝化层的成分与形貌取决于浸出液的氧化电位和pH值[12- 14]。因此,系统地研究浸出过程中氧化电位对黄铜矿界面反应和界面产物的组成和形貌的影响,对于在选择合适的浸出氧化剂、强化浸出过程等都具有重要的指导作用。
本文通过低温加压浸出和电化学极化技术,研究了黄铜矿在硫酸介质中浸出过程的界面反应,并使用拉曼光谱分析了黄铜矿表面产物的化学组成,以揭示黄铜矿在酸浸过程中表面氧化产物层的形成过程和组成,进而得到黄铜矿在酸性介质中氧化浸出的反应机制。
1 试验材料与方法
试验所用原料为天然黄铜矿(CuFeS2),主要化学成分(质量分数,%)为24.48 Cu,25.55 Fe,49.97 S。制备两种不同类型的黄铜矿样品。(1)将黄铜矿制成1 cm×1 cm×0.5 cm的块状样品,用于加压氧化浸出试验;(2)将黄铜矿切割成φ3 mm×10 mm的圆柱体,用银胶与铜线连接制成电极,并用环氧树脂密封固定,用于电化学氧化浸出试验。试验前将所有样品都经砂纸逐级打磨,然后用金刚石研磨膏抛光,并用蒸馏水和无水乙醇冲洗。
加压浸出试验在YZPR型500 ml聚四氟内衬高压釜中进行,温度为110 ℃,氧分压为1.0 MPa,浸出液分别为浓度0.000 5、0.05和0.5 M的硫酸溶液(pH值分别为3、1和0)。电化学试验在BioLogic HCP- 803工作站进行,采用三电极系统,黄铜矿为工作电极,铂电极为辅助电极,饱和甘汞电极为参比电极。电解质采用浓度0.5 M的硫酸溶液,温度为35 ℃。试验前需将黄铜矿在电解液中稳定20 min后再进行电化学测试。
将所有氧化浸出后的黄铜矿样品用去离子水和酒精冲洗、干燥,然后分别采用金相显微镜(Leica,DM4000M)、扫描电镜(HITACHI,SU- 1500)和拉曼光谱(Jobin- Yvon,HR- 800)进行分析。最后对黄铜矿表面剥落的反应产物进行XRD(RigakuD,Max- 2550)分析。
2 试验结果与讨论
2.1 加压氧化浸出过程
图1是分别在pH=3、1和0的硫酸溶液中,温度为110 ℃,1.0 MPa氧分压条件下,浸出不同时间的黄铜矿电极表面的金相照片。从图1可以看出,黄铜矿在浸出过程中其表面均有不同程度的氧化及钝化现象。新鲜抛光黄铜矿(0 h)表面光滑,呈黄色。当浸出液pH=3时,浸出3 h时的黄铜矿表面生成了致密的赤红色层,随浸出时间延长赤红色层逐渐剥落,剥落后的黄铜矿表面氧化形态稳定。pH=1时,浸出3 h的黄铜矿表面变成氧化色,5 h时表面出现腐蚀小坑且有灰色物产生,10 h时灰色区域扩大但仍可见黄铜矿基底。pH=0时,浸出3 h的黄铜矿表面变成深棕氧化色,5 h时形态模糊,10 h时表面形成了致密的灰色层。从表1不同浸出时间的浸出液中Fe/Cu含量比可以看出,pH=3时,浸出液中的Fe/Cu含量比始终为0;pH值降至1和0时,浸出液中明显有Fe和Cu溶出,Fe/Cu含量比随浸出时间的延长而逐渐减小,且浸出5 h后的Fe/Cu含量比变化很小。从以上结果可知,在pH=3时,随着浸出时间的延长,黄铜矿表面始终存在钝化层,抑制了黄铜矿的氧化,几乎没有金属离子进入溶液。pH值降低(酸度增大),黄铜矿发生氧化分解,且随浸出时间延长表面逐渐形成钝化层,阻碍了黄铜矿的继续氧化浸出。
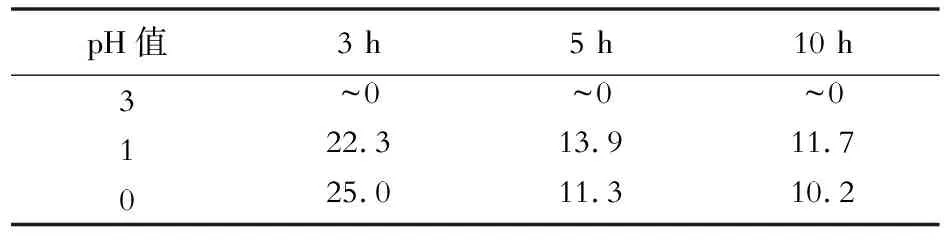
表1 浸出不同时间的浸出液中Fe/Cu含量比Table 1 Content ratio of Fe to Cu in the solution after leaching for different times
图2(a)是pH=3时浸出3 h的黄铜矿表面产物的XRD分析结果,可见黄铜矿表面的赤红色产物由Fe2O3和FeOOH组成。这是因为在氧化浸出过程中,与铜相比,铁更容易与氧结合[15],形成的Fe2O3和FeOOH附着在黄铜矿表面。由于氧化物和硫化物的结合能力差,当氧化铁层达到一定厚度后便从表面脱落进入溶液中。Fe2O3和FeOOH在pH<1的酸性溶液中会发生溶解[16],因此在pH=1和0时,浸出不同时间的黄铜矿表面没有出现铁的氧化物。图2(b~d)分别是在pH=3、1和0时,浸出不同时间的黄铜矿表面组成的拉曼光谱分析结果。浸出试验前测试得出,新鲜抛光的黄铜矿表面(0 h)在292 cm-1处有一个高强度的特征峰,在271、323、359和372 cm-1处有4个较低强度的特征峰[17]。从图2(b)可以看出,在浸出液pH=3时,由于黄铜矿表面生成的Fe2O3和FeOOH的拉曼活性低,因此其拉曼光谱中并没有出现两者的特征峰,甚至在浸出5和10 h的拉曼光谱中仍只有黄铜矿的特征峰。这是因为Fe2O3和FeOOH从黄铜矿表面剥落后,暴露出下层由于Fe优先与氧结合形成的贫铁硫化铜层。有研究表明,这种贫铁硫化物与黄铜矿的拉曼光谱很相似[18]。Klauber和Parker等通过XPS分析和密度泛函理论计算也证实了被氧化的黄铜矿表面生成了二硫化物[19],该硫化物钝化层可阻碍黄铜矿的继续浸出。
从图2(c)可以看出,pH=1时,在不同浸出时间的黄铜矿表面均检测到了黄铜矿的特征峰,但是随着浸出时间的延长,其相对强度逐渐减弱。浸出3 h时,在475 cm-1处出现了铜蓝(CuS)的特征峰[20]。浸出5 h时,除铜蓝的特征峰外,在221和431 cm-1处还出现了单质硫(S0)的特征峰,浸出10 h时单质硫的特征峰相对强度增大,甚至在454 cm-1处出现了聚合单质硫的特征峰[21]。从图2(d)可以看出,pH=0时浸出5 h前的拉曼光谱与pH=1时的相似,浸出10 h时,由于单质硫层达到一定厚度而使得黄铜矿的特征峰相对强度明显减弱。上述结果表明,降低溶液pH值(酸度增大),可使氧化铁层溶解,使贫铁硫化物与酸性介质直接接触,黄铜矿表面形成铜蓝,随浸出时间延长铜蓝逐渐被氧化成单质硫,当硫层发生聚合或者达到一定厚度时会成为钝化层,从而使黄铜矿的浸出速率降低。
60例膝关节损伤患者中,证实为韧带受损14例,占比为23.33%;关节腔积液19例,占比为31.67%;骨质改变8例,占比为13.33%;半月板受损19例,占比为31.67%。
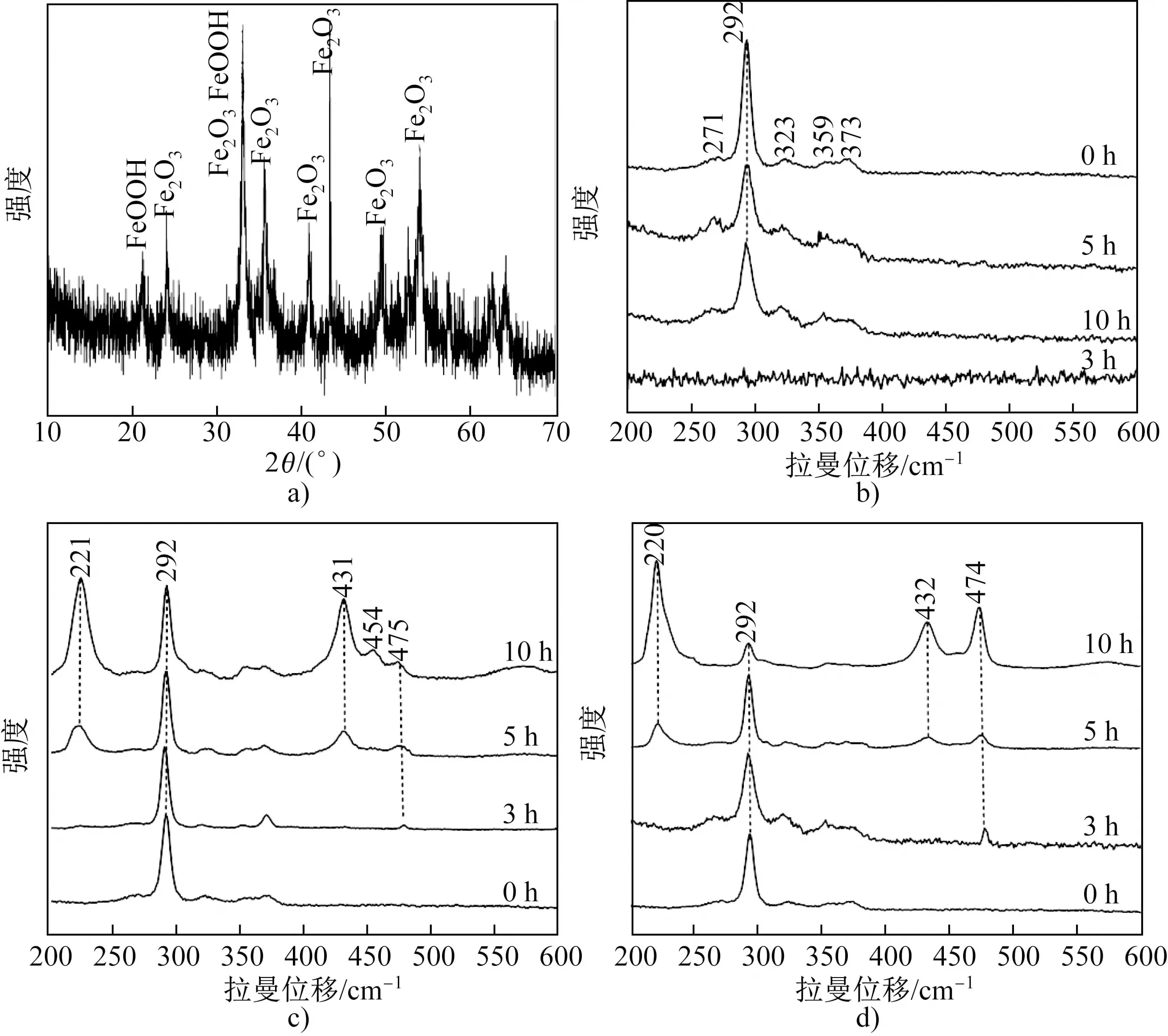
图2 (a)在pH=3的硫酸溶液中浸出3 h的黄铜矿表面产物的XRD图谱和(b~d)在pH=3、1和0的硫酸溶液中浸出不同时间的黄铜矿表面组成的拉曼光谱Fig.2 (a) XRD patterns of products on chalcopyrite surface after leaching in sulfuric acid solution with pH=3 for 3 h and (b,c,d) Raman spectra of the surface composition of chalcopyrite after leaching for different times in sulfuric acid solution with pH=3, 1 and 0
在110 ℃、1 MPa氧分压条件下,浸出体系由氧的还原(式(1))驱使黄铜矿发生氧化:
O2+4H++4e⟺2H2O
(1)
氧电极电位可由式(2)表示:
(2)
110 ℃(383 K)时,
EO2/2H2Ovs.SCE/V=0.92-0.076pH+
0.019lgpO2
(3)
在pH=3的硫酸溶液中,氧电极电位为0.71 V时,黄铜矿表面由Fe2O3、FeOOH及贫铁硫化物构成;pH=1和0,氧电极电位分别为0.87和0.94 V时,黄铜矿表面由CuS和S0构成。由以上结果可知,在110 ℃、1 MPa氧分压条件下,体系所提供的氧化条件和静态浸出的动力学条件使得黄铜矿中的硫元素只能部分氧化形成单质硫;铁与氧结合,迁移出黄铜矿结构,形成铁氧化物和羟基铁;部分铜元素保持与硫元素的结合状态,部分变成离子进入浸出液。
2.2 电化学氧化浸出过程
图3是黄铜矿电极和铂电极在pH=0的硫酸溶液中,温度为35 ℃、扫描速度为20 mV/s条件下的循环伏安曲线。测试前黄铜矿电极在电解液中静止20 min,开路电位稳定在0.28 V左右。初始扫描电位从0.28 V开始,正方向扫描到1.0 V,回扫至-0.3 V的过程中,没有氧气生成。
从图3中可以看出,在pH=0的硫酸溶液中,电位高于1.15 V时,铂电极上开始析氧;电位在-0.15 V左右时,铂电极上开始析氢。当黄铜矿电极的阳极氧化电位正移至0.7 V左右时,阳极电流明显增加,说明黄铜矿界面处发生了阳极反应。
黄铜矿的氧化分解会导致电流密度快速上升,因此可以通过恒电位法来确定阳极电位与阳极产物之间的关联性,如图4所示。图4(a)是黄铜矿电极在0.75~1.2 V极化2 h的I-t曲线。从图中可以看出,当电位低于0.85 V时,黄铜矿阳极电流密度接近零且几乎保持恒定,这表明黄铜矿电极表面的阳极氧化反应速率很小。当电位达到1.05 V时,初始电流密度快速增加,之后随时间延长而缓慢减小,这表明黄铜矿电极表面的阳极氧化反应速率先增大后减小,这可能是由于先期的反应产物阻碍了后续的电极氧化反应所致。当电位高于1.1 V时,阳极电流密度先减小后缓慢增大直至恒定。图4(b)是黄铜矿电极在1.1 V极化4 h的I-t曲线,电流密度约在2 h内达到稳定值,形成稳态电流,这表明当阳极电位高于1.05 V时,黄铜矿的阳极溶解过程可以持续进行,并能保持一定的溶解速率。
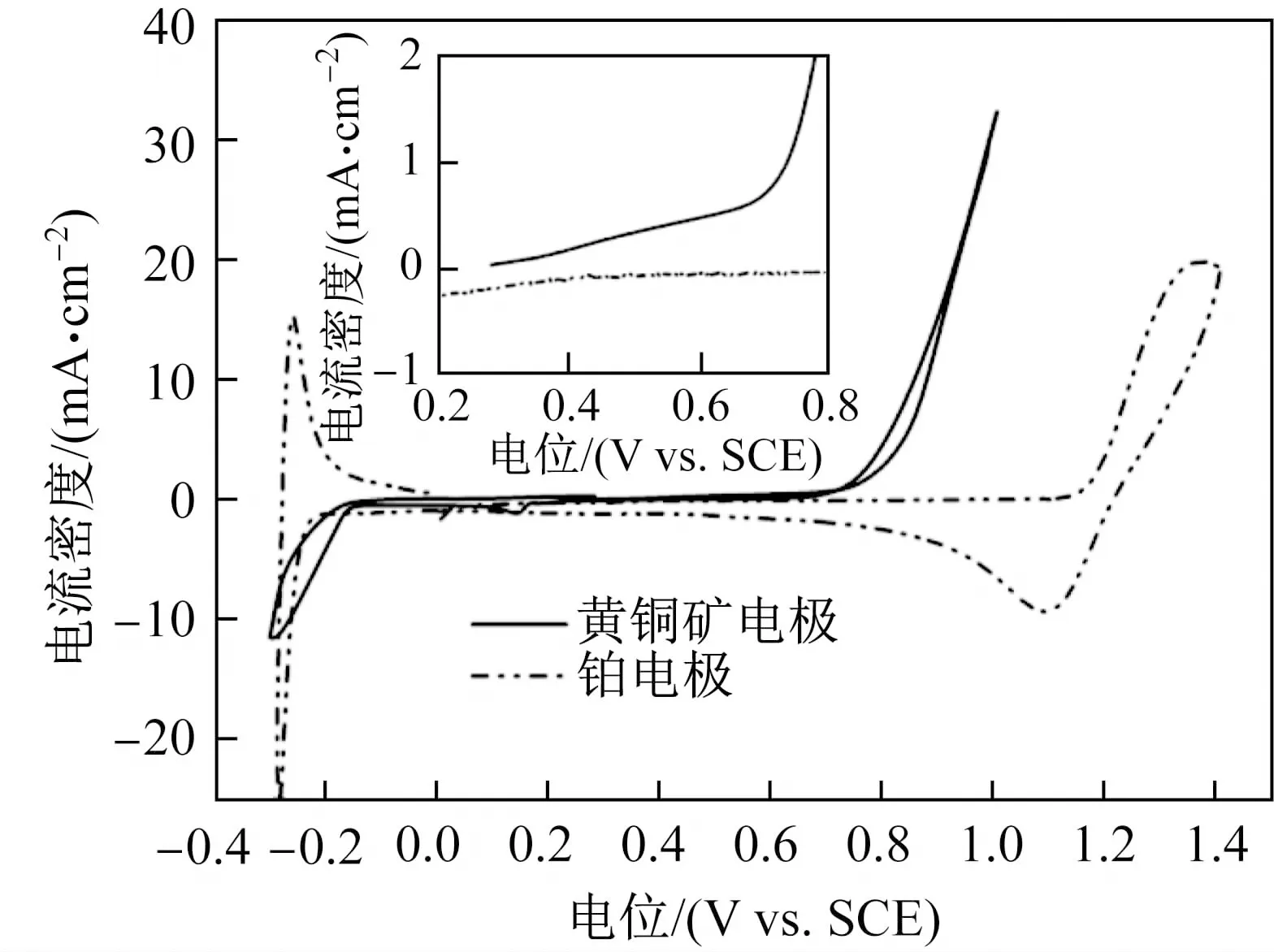
图3 黄铜矿电极和铂电极在pH=0的硫酸溶液中的循环伏安曲线Fig.3 Cyclic voltammetry curves of chalcopyrite electrodes and platinum electrodes in sulfuric acid solution with pH=0
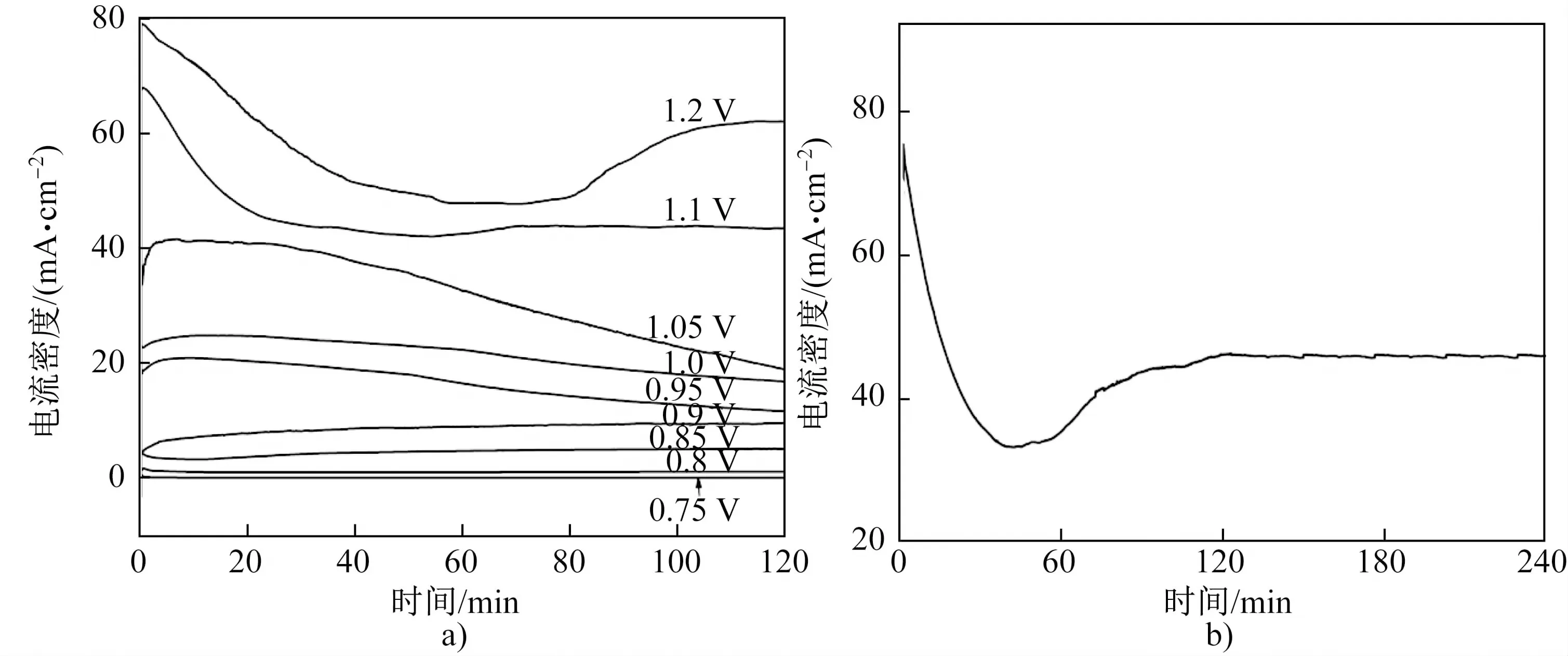
图4 黄铜矿电极在pH=0硫酸溶液中的恒电位极化曲线Fig.4 Potentiostatic polarization curves of chalcopyrite electrode in sulfuric acid solution with pH=0
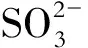
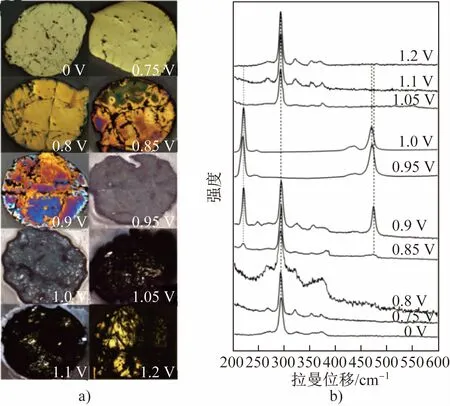
图5 (a)黄铜矿电极在不同电位下恒电位极化2 h后的表面金相照片及其(b)拉曼光谱Fig.5 (a) Metallographs and (b) Raman spectra of the surface of chalcopyrite after potentiostatic polarizing for 2 h at different anodic potentials
从电化学测试、金相及拉曼光谱分析可以看出,黄铜矿的氧化浸出过程有2个快速溶解区,第1个是黄铜矿快速氧化分解生成铜蓝和单质硫,第2个是单质硫发生氧化,黄铜矿的氧化溶解不再受钝化层的限制。因此,可以将黄铜矿在pH=0硫酸溶液中的钝化或氧化过程分为3个阶段:
(1)电位小于0.75 V时,拉曼光谱中只检测到黄铜矿的特征峰,此时黄铜矿的氧化速率很低,界面处只发生了部分Fe的优先溶出,表面仍保持缺Fe的黄铜矿结构。发生的反应如下:
CuFeS2→CuFe1-xS2+xFe3++3xe
(4)
(2)电位为0.8~1 V时,黄铜矿阳极电流密度随时间延长逐渐减小,拉曼光谱中检测到硫化铜和单质硫的特征峰,且单质硫含量不断增加。铜蓝是黄铜矿在氧化过程中的中间产物。发生的反应如下:
2CuFeS2→CuS+Cu2++2Fe3++3S0+8e
(5)
CuS→Cu2++S0+2e
(6)
(3)电位高于1.05 V时,黄铜矿阳极电流密度随时间延长有所增加且最终保持不变,此时单质硫被氧化,暴露出新鲜的黄铜矿表面。发生的反应如下:
CuFeS2+8H2O→Cu2++Fe3++SO42++
16H++17e
(7)
图6是抛光态黄铜矿电极及其在1.1 V电位下极化4 h后表面的SEM图像。从图中可以看出,极化前的黄铜矿表面平整且可见抛光痕迹,极化后的表面出现大小不一的裂纹和较深的腐蚀孔洞,这表明黄铜矿界面的氧化溶出反应是不均匀的,会造成表面明显粗化,这也是图6(a)中的显微组织大部分呈黑色的原因。表2是对应图6(a,b)中A、B和C 3处的EDS分析结果。从表2中可以看出,极化前与极化后黄铜矿表面Cu、Fe和S的原子分数比均为1∶1∶2,这表明当电位高于1.05 V时,黄铜矿表面的氧化产物几乎全部被氧化而进入溶液中,暴露出新的黄铜矿表面。此时黄铜矿的氧化溶解不再受钝化层单质硫的影响,其表面可以持续暴露在溶液中。在酸性浸出过程中,黄铜矿主要是在H+和溶液中的溶解氧作用下溶解,实际浸出体系的氧化还原电位较低,不会达到单质硫分解所需要的电位值,因而也不会发生黄铜矿持续溶解的现象。

图6 黄铜矿电极表面SEM图Fig.6 SEM images of chalcopyrite electrode surface
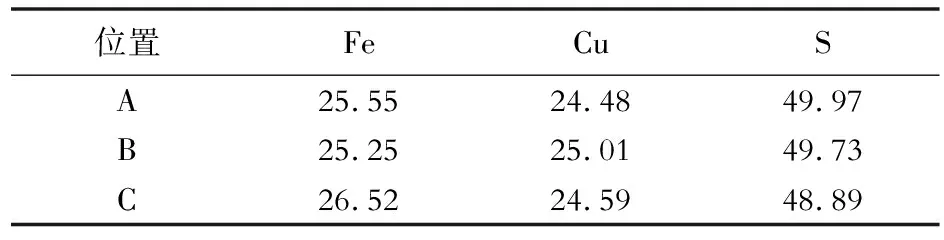
表2 黄铜矿电极在1.1 V恒电位极化4 h后的表面能谱分析结果(原子分数)Table 2 EDS analysis results of surface of chalcopyrite electrode after potentiostatic polarizing at 1.1 V for 4 h (atom fraction) %
可见,黄铜矿的酸性浸出应选择氧化电位高于1.05 V(vs.SCE)的氧化剂,以避免在浸出过程中发生黄铜矿表面钝化现象。但在pH=0的硫酸溶液中,水溶液稳定存在(无析氧发生)的极限电极电位为1.15 V(vs.SCE),因此,为了保持高氧化性和酸性溶液的稳定性,可以适当提高溶液的酸度。
3 结论
(1)加压氧化试验结果表明,黄铜矿在氧化浸出过程中表面所形成产物层的组成与溶液pH值相关。当浸出液pH=3时,黄铜矿表面氧化层由Fe2O3、FeOOH及贫铁硫化铜层(CuFe1-xS2或CuS2)组成,它们作为钝化层可阻碍黄铜矿的继续氧化浸出。pH=0或1时,由于铁的氧化物的溶解,表面氧化层主要是铜蓝(CuS)和单质硫(S0)。在温度110 ℃、1 MPa氧分压下静态浸出时,黄铜矿中的硫元素只能部分氧化形成单质硫。
(2)电化学氧化试验结果表明,黄铜矿氧化浸出的界面产物组成受阳极电位的影响。电位低于0.75 V时,黄铜矿表面几乎不发生反应;电位在0.8~0.9 V时,氧化浸出产物是铜蓝和单质硫,这与加压氧化浸出时黄铜矿界面反应产物相似;电位在0.95~1.0 V时,氧化层是单质硫,为新的钝化层;当电位高于1.05 V时,单质硫分解,新的黄铜矿表面可以持续暴露于硫酸溶液中。
(3)为了实现常压条件下黄铜矿的持续氧化浸出,并避免黄铜矿表面钝化,提高浸出体系的氧化还原电位是必要手段,同时,需适当提高浸出液的酸度以提高其稳定性。

