NO-sGC-cGMP信号通路通过cGK调控PAI-2基因表达*
韩敬丽, 邹丽辉, 金军华, 李文卿, 李 英, 肖 飞△
(1 北京大学第五临床医学院, 2北京医院卫生部北京老年医学中心老年医学重点实验室, 北京 100730)
纤溶酶原激活物抑制剂2(plasminogen activator inhibitor 2, PAI-2)又称为SERPINB-2,是一种丝氨酸蛋白酶抑制剂,在细胞外发挥作用以限制尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,uPA)的活性[1],因此,它可以参与调节纤维蛋白溶解和直接参与降解细胞外基质,从而在炎症反应、组织重塑、伤口愈合和肿瘤转移过程中发挥功能[2]。PAI-2基因位于18q21.3,由8个外显子构成,长约16.5 kb。该基因表达可受多种因子调控,其启动子区域有2个AP1结合位点,还含有cAMP 反应元件,并受生长因子[如转化生长因子β(trans-forming growth factor-β,TGF-β)、表皮生长因子(epidermal growth factor,EGF)和巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)]、激素(如视黄酸和维生素D3)、细胞因子(如TNF-α、IL-1和IL-2)及肿瘤启动子(如佛波酯)等调控[3]。
我们前期的差异基因表达谱分析发现,一氧化氮-可溶性鸟苷酸环化酶-环磷酸鸟苷(nitric oxide- soluble guanylyl cyclase-cyclic guanosine monophosphate,NO-sGC-cGMP)信号通路可调控PAI-2基因表达[4]。此外,我们在人肺动脉平滑肌细胞(human pulmonary arterial smooth muscle cells,HPASMCs)中发现PAI-2具有抗增殖、抗迁移和促凋亡的作用[5]。但NO-sGC-cGMP信号通路调控PAI-2基因表达的具体分子机制尚不清楚。在生物体内,cGMP的作用方式主要为2种,一种是由cGMP及其同系物作为离子通道的配体直接参与细胞功能的调控,另一种是间接作用,也是cGMP作用的主要方式,通过激活cGMP依赖性蛋白激酶(cGMP-dependent protein kinase,cGK)发挥作用。cGK是广泛存在于真核细胞内的丝/苏氨酸蛋白激酶,在HPASMCs中也是cGMP的主要效应蛋白[6]。
为了进一步阐明在HPASMCs中NO-sGC-cGMP信号通路是否也是通过cGK调控PAI-2基因表达,本研究通过构建cGK的真核过表达载体及其小干扰RNA(small interfering RNA,siRNA)敲减体系,分析PAI-2基因不同启动子区域的活性,从而揭示PAI-2基因表达的具体分子机制。
材 料 和 方 法
1 实验材料
HPASMCs和平滑肌细胞培养基SMCM均购自ScienCell;真核表达载体pcDNA3.1(-)为本实验室保存;DNA聚合酶和DNA连接酶购自TaKaRa;限制性DNA 内切酶购自New England Biolabs;DNA凝胶纯化回收试剂盒和质粒小量提取试剂盒购于天根生化科技(北京)有限公司;双萤光素酶报告试剂盒(Dual-Luciferase Reporter Assay System)购于Promega;TRIzol试剂、细胞转染试剂盒(Lipofectamine 3000 Transfection Reagent)和莫洛尼氏鼠白血病病毒(M-MLV)RNA 逆转录试剂盒均购自Invitrogen;BAY 41-2272购自MCE;PRKG1抗体购自Proteintech;山羊抗兔IgG (H+L)抗体购自康为世纪生物科技有限公司;小鼠抗β-actin单抗和辣根过氧化物酶标记山羊抗小鼠IgG(H+L)均购自北京中杉金桥生物技术有限公司;Western细胞裂解液购自碧云天生物技术; Protease Inhibitor Cocktail购自赛默飞世尔科技有限公司;Immobilon Western HRP底物购自Merch Millipore。
2 方法
2.1 细胞培养 将人肺动脉平滑肌细胞置于含2%胎牛血清、1×105U/L青霉素、100 mg/L链霉素及生长因子的SMCM,于37 ℃、5% CO2环境培养。细胞隔天更换培养基,传代比例1 3。
2.2 细胞转染和细胞处理 按照Lipofectamine 3000 Transfection Reagent标准实验方案将携带目的基因的真核表达载体或siRNA瞬时转染HPASMCs。细胞转染6 h后更换常规培养基,BAY 41-2272以100 μmol/L工作浓度处理24 h,对照组加入等量DMSO平行培养。
2.3PAI-2启动子的克隆 PCR引物的设计与合成:利用Primer软件包在PAI-2基因转录起始位点上游2.1 kb处依次设计启动子缺失突变体上、下游引物,在引物序列5’端加上SpeI酶切位点,3’端加上NheI酶切位点,野生型和各启动子缺失突变体共用一条下游引物,扩增片段插入萤火虫萤光素酶报告基因表达载体,同时设计内参照β-actin上、下游引物序列,引物序列由上海生工生物工程公司合成。同样设计cGK和PAI-2的real-time PCR引物。引物名称及其核苷酸序列见表1。 真核表达载体的构建:以HPASMCs基因组DNA为模板,采用PCR方法获得启动子目的片段及其亚克隆片段,回收后分别与经过相同酶切处理的真核表达载体pcDNA3.1(-)大片段连接。连接产物经测序鉴定,获得正确表达质粒。

表1 用于构建PAI-2基因启动子缺失体和cGK过表达质粒的引物核苷酸序列
2.4 细胞总RNA提取和RT-PCR 收集细胞后按照常规TRIzol抽提法提取细胞总RNA,将提取的RNA溶于DEPC处理的去离子水中,通过NanoDrop 2000C定量。用M-MLV逆转录试剂盒进行逆转录合成cDNA第1链。用β-actin作为内参照,进行RT-PCR扩增PAI-2,反应体系如下:10×PCR缓冲液2.5 μL,dNTPs (10 mmol/L)1 μL,基因引物0.l μmol/L,Taq酶1.5 U,加入去离子水至25 μL。反应条件为:98 ℃变性5 min;98 ℃30 s、56 ℃30 s、72 ℃ 30 s,30个循环,72 ℃总延伸10 min。将反应产物于1.2%琼脂糖凝胶进行核酸电泳分析。
2.5 Real-time PCR Real-timePCR反应根据SYBR Green方法进行半定量,iQ5多色实时定量荧光PCR检测系统(Bio-Rad)进行检测。通过分析产物的熔解曲线来确定扩增的特异性,利用2-ΔΔCt法计算cGK和PAI-2 mRNA的相对表达量。
2.6 细胞总蛋白提取和Western blot实验 细胞转染和/或处理24 h后收集细胞,以蛋白裂解液处理提取总蛋白。利用BCA蛋白浓度测定试剂盒测定蛋白浓度。40 μg蛋白溶液用于SDS-PAGE,并将蛋白转至固相载体PVDF膜,以5%脱脂牛乳封闭,Ⅰ抗4℃孵育过夜,PBST(含0.5% Tween-20的PBS溶液)漂洗,以1 5 000辣根过氧化物酶标Ⅱ抗室温孵育1 h,利用Immobilon Western HRP底物进行目的蛋白检测。目的蛋白相对含量以目的蛋白与内参照β-actin的比值表示。
2.7 双萤光素酶报告基因实验 将上述构建的含PAI-2基因启动子和亚克隆启动子的萤光素酶报告基因表达载体转染细胞,24 h后收集细胞,使用试剂盒中的passive lysis buffer进行裂解,通过GloMax 20/20发光检测仪检测细胞内的萤光素酶活性,以萤光素酶相对活性的高低作为启动子活性大小的指标。
3 统计学分析
通过SPSS 20.0统计软件对实验数据进行整理和分析,用均数±标准差 (mean±SD)表示。两组间差异显著性分析采用t检验,多组间采用方差分析(one-way ANOVA),组间两两比较采用最小显著性差异(LSD)法或Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 cGK过表达和敲减体系验证
Real-time PCR和Western blot 结果显示,cGK过表达显著上调HPASMCs中cGK的mRNA和蛋白表达(P<0.01),合成的3组cGK siRNA均能显著降低细胞内cGK的mRNA和蛋白表达水平(P<0.01),见图1。我们挑选敲减效率最为显著的cGKsiRNA-2进行后续研究。

Figure 1. The over-expression and knock-down ofcGKin the PASMCs. A: the mRNA expression of cGK in the HPASMC; B: protein expression of cGK in the HPASMC. Mean±SD.n=3.*P<0.05,**P<0.01vsNC siRNA group;#P<0.05,##P<0.01vspcDNA-NC group.
图1 过表达和敲减cGK表达对cGK mRNA和蛋白水平的影响
2 cGMP对PAI-2基因表达的调控依赖于cGK
在HPASMCs中BAY 41-2272激活NO-sGC-cGMP信号通路后,cGK基因的mRNA水平显著上调,敲减cGK表达后,该上调作用被抑制,见图2A。在HPASMCs中过表达和敲减cGK表达后,PAI-2基因的mRNA表达也相应增加或降低。BAY 41-2272可显著上调PAI-2基因的表达,但加入cGKsiRNA后,该上调作用明显受到抑制(P<0.01)。因此,cGMP调控PAI-2基因表达依赖于cGK。
3 cGMP通过cGK调控PAI-2基因启动子活性
为了进一步证明cGMP通过cGK调控PAI-2基因表达,我们构建了PAI-2基因启动子双萤光素酶报告基因。过表达和敲减cGK表达后,PAI-2基因启动子调控的萤光素酶相对活性也相应增强和减弱,即PAI-2基因启动子活性相应增加和下降;BAY 41-2272处理细胞后,PAI-2基因启动子活性显著增加,与上述cGMP对PAI-2基因表达调控结果一致,见图3。

Figure 2. cGMP regulated PAI-2 expression dependent on cGK. A: knockdown ofcGKexpression and treatment with BAY41-2272 affec-ted mRNA expression of cGK in the HPASMCs; B: over-expression and knockdown ofcGKexpression, and treatment with BAY41-2272 affected mRNA expression of PAI-2 in the HPASMCs. Mean±SD.n=3.**P<0.01vsDMSO group;##P<0.01vsBAY 41-2272 group;△△P<0.01vsNC siRNA group;▲P<0.05vspcDNA-NC group.
图2 cGMP对PAI-2基因表达的调控依赖于cGK
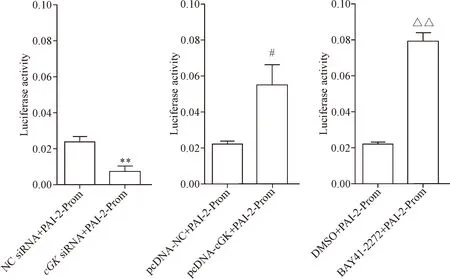
Figure 3. NO-sGC-cGMP signaling pathway regulated the activity ofPAI-2gene promoter. Mean±SD.n=3.**P<0.01vsNC siRNA+PAI-2-Prom group;#P<0.05vspcDNA-NC+PAI-2-Prom group;△△P<0.01vsDMSO+PAI-2-Prom group.
图3 NO-sGC-cGMP信号通路调控PAI-2基因启动子的活性
4 PAI-2转录起始位点上游-1 000~-800 bp为转录调控关键位点
为了进一步找到cGK调控PAI-2基因转录表达的关键启动子区域,我们构建了PAI-2基因转录起始位点上游2 000 bp片段,命名为PAI-2-Prom-WT(-2000-0TSS)(TSS: transcription start site)质粒,如图4A所示依次缺失突变500 bp,分别命名为PAI-2-Prom-M1(-1500-0TSS)、PAI-2-Prom-M2(-1000-0TSS)和PAI-2-Prom-M3(-500-0TSS)质粒。在HPASMCs中进行双萤光素酶报告基因实验,结果显示PAI-2-Prom-M1和PAI-2-Prom-M2启动子活性明显增加,PAI-2-Prom-M3启动子活性下降(P<0.01),见图4B,因此我们推测转录调控的关键启动子区域在PAI-2转录起始位点上游-1 000 bp~-500 bp处。把这一段进一步缺失突变,分别命名为PAI-2-Prom-M4(-650-0TSS)和PAI-2-Prom-M5(-800-0TSS)。在HPASMCs中进行萤光素酶报告基因实验,结果显示,与PAI-2-Prom-M1和PAI-2-Prom-M2比较,PAI-2-Prom-M4和PAI-2-Prom-M5启动子活性也明显下降,并且在BAY 41-2272作用下PAI-2-Prom-M1和PAI-2-Prom-M2的启动活性明显升高(P<0.01),见图4C。因此cGK转录调控PAI-2基因的关键启动子区域在PAI-2转录起始位点上游-1 000 bp~-800 bp处,见图4D。

Figure 4. Dual-luciferase reporter assay. A: the PCR products forPAI-2gene promoter mutants; B and C: dual-luciferase reporter assay; D: schematic diagram of PAI-2 promoter deletion mutations. Mean±SD.n=3.**P<0.01vsPAI-2-Prom-WT group;&&P<0.01vsPAI-2-Prom-WT without BAY 41-2272 treatment group;##P<0.01vsPAI-2-Prom-WT with BAY 41-2272 treatment group;△P<0.05vsPAI-2-Prom-M1 without BAY 41-2272 treatment group;▲▲P<0.01vsPAI-2-Prom-M2 without BAY 41-2272 treatment group.
图4 双萤光素酶报告基因实验
讨 论
cGMP依赖性途径的失调在高血压和心力衰竭等心血管疾病中发挥着重要作用[7]。研究NO-sGC-cGMP信号通路在肺动脉高压的作用近年受到重视。肺血管重构是肺动脉高压的一个主要病理特征,主要因肺血管平滑肌的异常增生而导致血管腔不同程度狭窄。我们前期研究发现肺动脉高压患者外周血细胞中PAI-2 的mRNA水平显著降低,并且sGC特异性激活剂西那西呱(cinaciguat)能上调其mRNA水平[8]。由于PAI-2对肺动脉平滑肌细胞具有抗增殖、抗迁移和促凋亡的作用,因此我们推测NO-sGC-cGMP作用于PAI-2从而在肺动脉高压的肺血管重构中发挥作用。
为探究NO-sGC-cGMP信号通路调控PAI-2基因表达的具体分子机制,本研究对PAI-2基因启动子活性进行检测。人PAI-2基因启动子活性由3个主要转录调控域调控,即近端核心启动子、上游的沉默子(PAUSE-1,-1977~-1675)和远端的反式激活区(-5 100~-3 300)控制,其中PAUSE-1和反式激活区的主要活性区域已被找到[3],然而近端核心启动子的活性区域尚不明确。因此,本研究选取包括PAUSE-1在内的近端核心启动子序列进行研究,探究其主要活性区域。研究结果显示PAI-2启动子的活性在PAI-2-Prom-WT组明显低于PAI-2-Prom-M1和PAI-2-Prom-M2组,推测是因为PAI-2转录起始位点上游-2 000~-1 500包含沉默子PAUSE-1,与文献报道相同[3]。进一步缺失突变PAI-2启动子后其活性仍在PAI-2-Prom-M1和PAI-2-Prom-M2两组有上调,且在PAI-2-Prom-M2组的上调幅度远大于PAI-2-Prom-M1组,而其活性在PAI-2-Prom-M4和PAI-2-Prom-M5两组与对照组无显著差异。因此推断cGK转录调控PAI-2基因的关键启动子区域在PAI-2转录起始位点5’侧翼区的-1 000 bp~-800 bp处。
本研究选用的双萤光素酶报告基因检测系统,具有多方面检测优势。首先,双萤光素酶在宿主细胞内均无内源活性,并且该系统中2个报告基因产生的线性检测的灵敏度均可达<10-18mol;其次,该系统以自身作为内参,可以在最大程度上减小细胞活性和转染效率等外在因素对实验的影响;第三,该系统可快速定量检测转染细胞,并且系统在细胞中同时表达萤火虫萤光素酶和海肾萤光素酶,两者无种属同源性并对应不同的反应底物,无交叉干扰[9-10]。
本研究找到cGK调控PAI-2启动子活性最强的区域,并确定该区域可受cGMP调控,阐明了NO-sGC-cGMP信号通路下游新的调控机制,为NO-sGC-cGMP信号通路的作用机制研究奠定了新的理论基础。

