心衰康抑制慢性心衰大鼠心肌自噬及MAPK/ERK1/2信号通路*
柴松波, 王振涛, 张淑娟, 刘舜禹
(河南中医药大学第二附属医院/河南省中医院心病科, 河南 郑州 450002)
心力衰竭为各种心脏疾病的终末阶段,是导致心血管疾病患者死亡的重要原因之一,给患者家庭带来巨大的经济负担。心力衰竭发生发展机制较复杂[1],目前尚无统一定论。近期研究显示自噬在心脏疾病的发生和发展中发挥重要作用;关于心肌梗死的相关研究发现自噬能够造成心肌细胞数量减少,引发心室壁厚度降低,心腔扩大,从而加重慢性心力衰竭的发展[2]。心衰康主要由黄芪、桂枝、赤芍和丹参等组成,具有温经通脉、补脾益肺和活血利水的功效[3]。临床研究显示,心衰康对慢性心衰患者的治疗效果较好,可改善心功能,降低心衰的反复发作,提高患者生活质量。然而心衰康的具体作用机制目前尚不明确[4]。本研究通过复制慢性心力衰竭大鼠模型,给予心衰康治疗,以探究心衰康对慢性心力衰竭大鼠心肌的保护作用并初步探究其可能的作用机制,以期为慢性心力衰竭的临床治疗提供一定的参考。
材 料 和 方 法
1 实验动物
雄性Wistar大鼠,体重200~220 g, 8周龄,SPF清洁级,由北京维通利华实验动物技术有限公司提供,实验动物使用许可证号为SYXK(豫)2015-0005,严格遵循动物饲养规则进行统一喂养,实验期间大鼠自由饮水、摄食,1 周后用于模型制备。
2 实验药物
心衰康颗粒为三九药业有限公司生产的中药免煎颗粒,经河南省中医院中药房鉴定,由附子、红参、丹参、黄芪、红花和桂枝组成(批号为170526),使用时溶于蒸馏水;卡托普利(captopril)由湖南汉森制药股份有限公司生产(批号为20170618)。
3 试剂及仪器
HE染色试剂盒(生工生物公司);TUNEL细胞凋亡检测试剂盒和TTC染料(碧云天生物技术有限公司);蛋白裂解液、蛋白抽提试剂盒和BCA蛋白定量检测试剂盒(北京中杉金桥生物技术有限公司);兔抗鼠磷酸化细胞外信号调节激酶(phospho-extracellular signal-regulated kinase,p-ERK)、p-p38 MAPK和β-actin抗体(Abcam);抗微管相关蛋白1轻链3(microtube-associated protein 1 light chain 3,LC3)、beclin-1和p62抗体及HRP标记山羊抗兔II抗(CST)。S80彩色多普勒超声诊断仪(SIEMENS,探头频率为3.5 MHz);垂直电泳仪和蛋白凝胶成像仪(Bio-Rad);荧光显微镜(Olympus)。
4 方法
4.1 慢性心力衰竭大鼠模型的制备[5]造模前对所有大鼠进行心脏超声检测,确保所有大鼠心功能正常。腹腔注射水合氯醛(7 mL/kg)麻醉大鼠,气管插管连接小动物呼吸机,于左胸第3~4肋骨间切开皮肤,分离肌层打开胸腔,将心包剪开后,用6-0丝线于左心耳和动脉圆锥下方2 mm处结扎冠状动脉,随后将心脏重新纳入胸腔,缝合切口,待大鼠自由呼吸后撤掉呼吸机,每天注射40万单位青霉素,连用3 d。假手术(sham)组大鼠开胸后仅进行穿线,不结扎冠状动脉。术后4周,进行心脏彩超检测,以左心室射血分数(left ventricular ejection fraction,LVEF)<45%视为慢性心力衰竭大鼠模型制备成功。排除死亡和感染大鼠,共60只大鼠模型制备成功,假手术组大鼠12只。
4.2 动物分组与给药 模型制备后将大鼠分为模型(model)组、心衰康低、中和高剂量(low-, middle-and high-dose Xinshuaikang treatment, TL、TM和TH)组及卡托普利(阳性,captopril)组,每组均12只大鼠。TL、TM和TH组:于模型制备后4周,每只分别予以12、20和40 mg/kg心衰康颗粒灌胃[6];Captopril组:于模型制备后4周,予以10 mg/kg卡托普利灌胃[7];Sham和model组:于模型制备后4周,分别予以等量生理盐水灌胃;各组均每天处理1次,连续处理8周。
4.3 彩色多普勒超声仪检测大鼠心室功能 末次给药后,对大鼠充分麻醉后,使其仰卧固定在鼠板上,采用彩色多普勒超声仪,调节至二维模式,检测各组左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左心室收缩末期内径(left ventricular end-systolic dimension,LVESD)、LVEF、舒张末期左室后壁厚度(left ventricular posterior wall thickness at end-diastole,LVPWTd)和收缩末期左室后壁厚度(left ventricular posterior wall thickness at end-systole, LVPWTs)并记录,连续检测3个心脏周期求得平均值。随后行右颈总动脉插管,将导管从右颈总动脉插入,逆向进入左心室,末端连接血压换能器,测定左心室压力最大上升/下降速率(maximum rate of rise/decrease of left ventricular pressure, +dp/dtmax/-dp/dtmax)、左心室舒张压(left ventricular diastolic pressure,LVDP)、左心室收缩压(left ventricular systolic pressuer,LVSP)和心输出量(cardiac output, CO),连续检测3次取平均值。
4.4 TTC染色评估大鼠梗死体积 超声检测结束后,每组随机选取6只大鼠充分麻醉后,颈总动脉逆行注射0.5%伊文思蓝(Evans blue,EB)1 mL,随后迅速处死大鼠获取心脏,-20 ℃过夜保存。沿左心室横向将左心室切为5片,添加1% TTC溶液室温孵育20 min;随后放置于10%甲醛溶液中固定。染色后蓝色部分代表正常心肌组织,红色部分代表缺血危险组织,白色部分代表梗死组织。拍照保存,采用Image-Pro Plus软件定量分析各组大鼠心肌组织切片梗死体积,计算心肌梗死体积比例。
4.5 样本采集 将各组剩余大鼠处死后收集心脏,清洗后,摘除非心肌组织后将一部分心肌组织置于4%多聚甲醛固定过夜,以制备石蜡切片;另一部分置于-80 ℃保存。
4.6 HE染色观察心肌组织病理形态学的改变 取出固定心肌组织,常规制备石蜡切片(5 μm),经烘烤、二甲苯脱蜡及梯度乙醇脱水后,采用HE染色试剂盒对心肌组织石蜡切片进行染色,树脂封片后,置于光学显微镜下观察心肌组织病理损伤情况。
4.7 TUNEL实验检测心肌细胞凋亡 常规制备心肌冷冻切片,根据TUNEL试剂盒说明书对切片进行染色,其中采用抗心肌肌钙蛋白I(cardiac troponin I,cTnI)抗体染色心肌细胞,4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染色心肌细胞核,置于荧光显微镜下观察心肌细胞凋亡情况,拍照保存,采用ImageJ软件对心肌细胞阳性率进行定量分析,细胞凋亡率(%)=阳性染色细胞数/总细胞数×100%。
4.8 荧光显微镜检测心肌细胞自噬 取出固定心肌组织,添加Triton X-100透化组织20 min,水洗后加入荧光染液,37 ℃避光孵育20 min,封闭后添加LC3荧光 I 抗(1100),4 ℃避光孵育过夜,PBS清洗后加入荧光 II 抗,室温孵育2 h,清洗后置于荧光显微镜中观察蛋白阳性表达情况。
4.9 Western blot法分析蛋白水平 于液氮中研磨冻存心肌组织,后添加裂解液提取组织总蛋白,行SDS-PAGE分离等量蛋白后进行转膜反应,5%脱脂奶粉封闭后添加抗p-ERK、p-p38MAPK、LC3-II、beclin-1、p62和β-actin抗体(1 500),4 ℃过夜孵育,添加 II 抗(15 000)后室温下放置1 h,用ECL发光显影后置于凝胶成像仪内观察各蛋白表达,采用ImageJ软件对各蛋白条带进行量化分析。
5 统计学处理
所得数据均采用SPSS 21.0软件进行统计分析。计量资料以均数±标准差(mean±SD)表示,多组间对比采用单因素方差分析,进一步两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 心衰康对心衰大鼠心室功能的影响
与sham组相比,model组的LVEDD和LVESD升高,LVPWTd、LVPWTs和LVEF降低(P<0.05);与model组相比,心衰康各组与卡托普利组的LVEDD和LVESD均降低,LVPWTd、LVPWTs和LVEF升高(P<0.05),见表1。
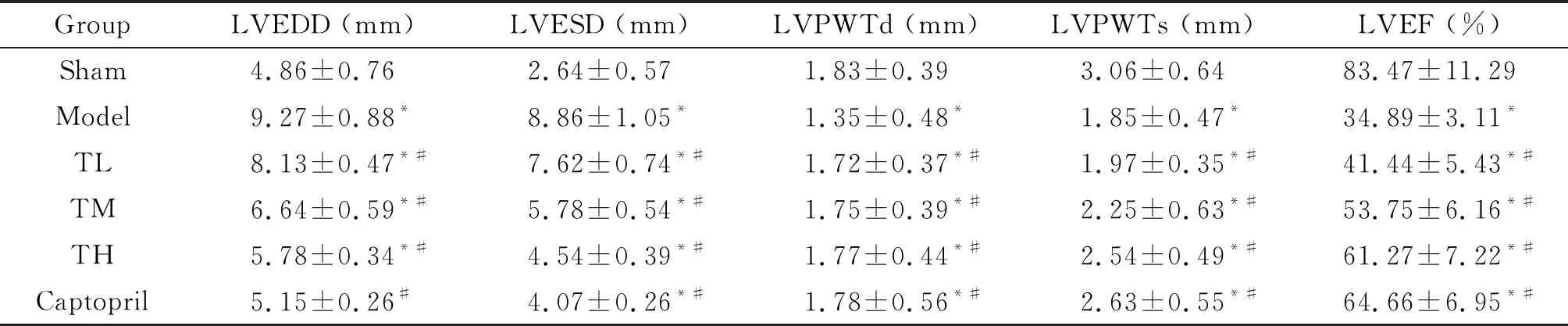
表1 各组大鼠心室功能相关指标的比较
*P<0.05vssham group;#P<0.05vsmodel group.
2 心衰康对心衰大鼠血流动力学的影响
与sham组相比,model组的CO、LVSP、LVDP、 +dp/dtmax和-dp/dtmax均降低(P<0.05);与model组相比,心衰康各组与卡托普利组的CO、LVSP、LVDP、+dp/dtmax和-dp/dtmax均升高(P<0.05),见表2。
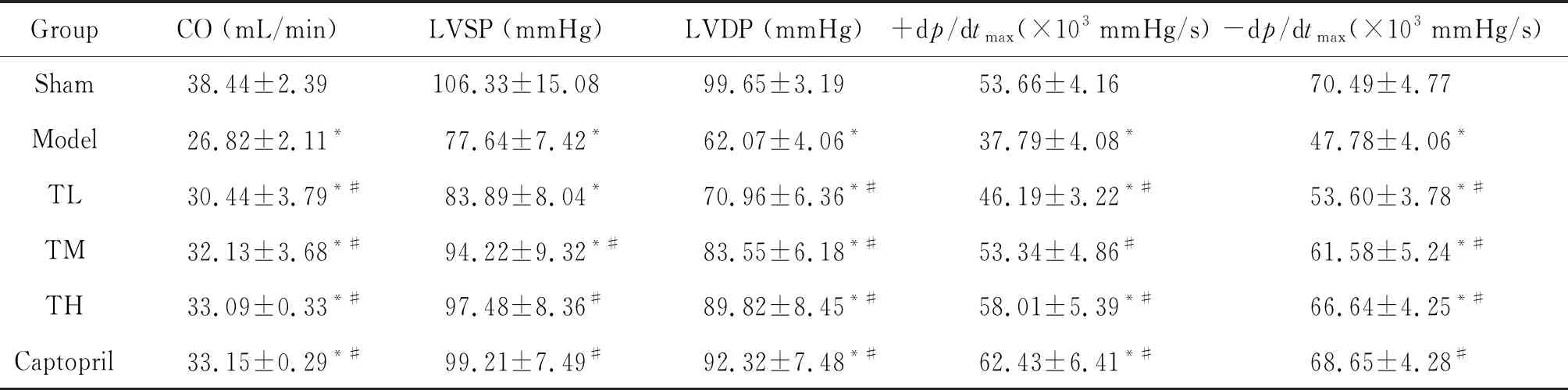
表2 各组大鼠血流动力学变化情况的比较
*P<0.05vssham group;#P<0.05vsmodel group.
3 各组大鼠心肌梗死情况
与sham组相比,model组心肌梗死体积显著升高(P<0.05);与model组相比,心衰康各组与卡托普利组心肌梗死体积显著降低(P<0.05),见表3。
4 各组大鼠心肌组织病理形态学变化
Sham组心肌细胞形态大小正常,细胞器分布均匀,结构正常,心肌纤维排列规则,未见病理性损伤;Model组可见心肌细胞变形,出现空泡,部分细胞坏死,心肌纤维排列不规则,出现断裂,细胞间伴有炎性细胞浸润;心衰康各组与卡托普利组的心肌细胞水肿和坏死减少,细胞纤维形态逐渐恢复正常,炎性细胞浸润明显降低,见图1。
5 各组大鼠心肌细胞的凋亡情况
TUNEL实验结果显示,与sham组相比,model组心肌细胞凋亡率显著升高(P<0.05);与model组相比,心衰康各组与卡托普利组的心肌细胞凋亡率均降低(P<0.05),见图2、表3。
6 各组大鼠心肌组织自噬情况的比较
与sham组相比,model组的LC3-II阳性率显著升高(P<0.05);与model组相比,心衰康各组与卡托普利组心肌细胞的LC3-II阳性率均降低(P<0.05),见图3、表3。
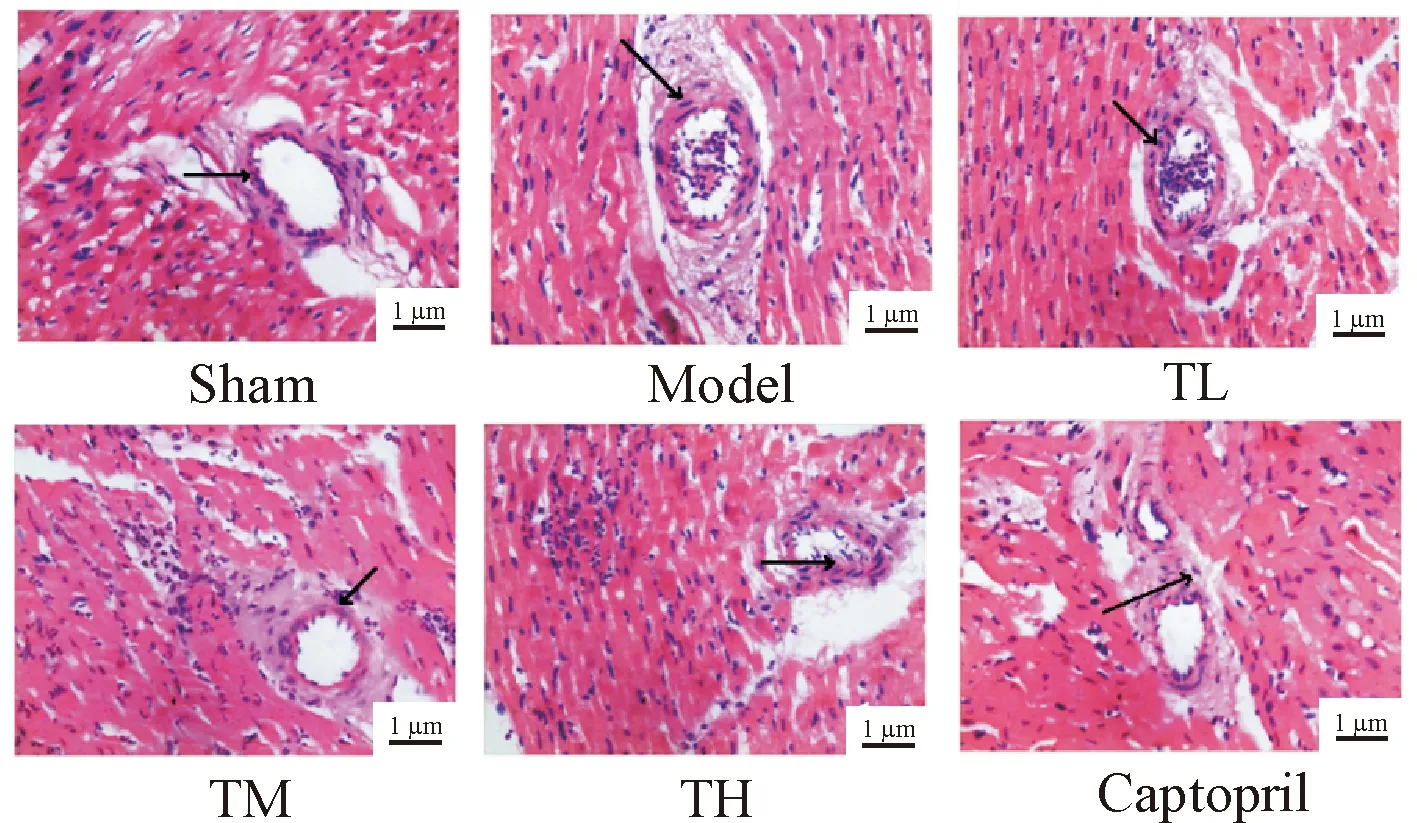
Figure 1. Histopathological changes of myocardium in the rats were observed by HE staining.
图1 HE染色观察大鼠心肌组织病理形态学变化

Figure 2. Apoptosis of cardiomyocyte in rats was observated by TUNEL.
图2 TUNEL法观察大鼠心肌细胞凋亡
表3 各组大鼠心肌梗死体积比、心肌细胞凋亡率及自噬情况(LC3-II阳性率)的比较
Table 3. The changes of TTC staining for evaluating myocardial infarction volume, the apoptotic rate (by TUNEL) and autophagy (by LC3-II immunofluorescene labeling) in the myocardium of the rats with different treatments (Mean±SD.n=6)

GroupInfarcted/total volume (%)Apoptotic rate (%)LC3-II positive rate (%)Sham 6.35±0.3110.73±2.069.51±0.07Model39.86±5.24*42.26±4.58*62.08±7.41*TL32.31±4.42*#34.13±4.16*#45.72±8.37*#TM24.05±4.73*#25.86±3.24*#34.35±4.27*#TH21.27±4.08*#19.47±2.32*#28.66±2.53*#Captopril20.45±5.32*#18.36±2.46*#25.64±3.14*#
*P<0.05vssham group;#P<0.05vsmodel group.

Figure 3. Autophagy of cardiac myocytes was obervated by immunofluorescence. The scale bar=2 μm.
图3 免疫荧光法观察心肌细胞自噬情况
7 心衰康对心衰大鼠MAPK/ERK1/2通路的影响
与sham组相比,model组的ERK和p38 MAPK蛋白磷酸化水平均升高(P<0.05);与model组相比,心衰康各组与卡托普利组的ERK和p38 MAPK蛋白磷酸化水平均降低(P<0.05)。见图4A、表4。
8 心衰康对心衰大鼠自噬相关蛋白表达的影响
与sham组相比,model组的LC3-II/LC3-I比值和beclin-1蛋白表达水平升高,p62 蛋白表达水平降低(P<0.05);与model组相比,心衰康各组与卡托普利组的LC3-II/LC3-I比值和beclin-1蛋白表达水平均降低,p62 蛋白表达水平升高(P<0.05),见图4B、表5。
讨 论
目前常用阿奇霉素法、腹动脉收缩法和冠状动脉结扎法制备动物心衰模型,研究显示结扎左冠状动脉前降支能够造成动物慢性心力衰竭,其病理生理变化以及心室功能变化与临床心力衰竭相似[8]。心力衰竭一般表现为心肌收缩功能障碍,射血能力下降[9]。本研究通过采用左冠状动脉前降支结扎法制备心力衰竭大鼠模型,超声检测发现与sham组相比,model组大鼠的LVEDD和LVESD升高,LVPWTd、LVPWTs和LVEF降低,CO、LVSP、LVDP、+dp/dtmax和-dp/dtmax降低,表明模型大鼠心输出量、收缩能力以及射血能力均显著降低,病理检测发现model组大鼠心肌细胞变形、坏死,心肌纤维断裂,伴有炎性细胞浸润,表明model组大鼠心肌组织出现炎症性损伤,提示慢性心力衰竭大鼠模型复制成功。
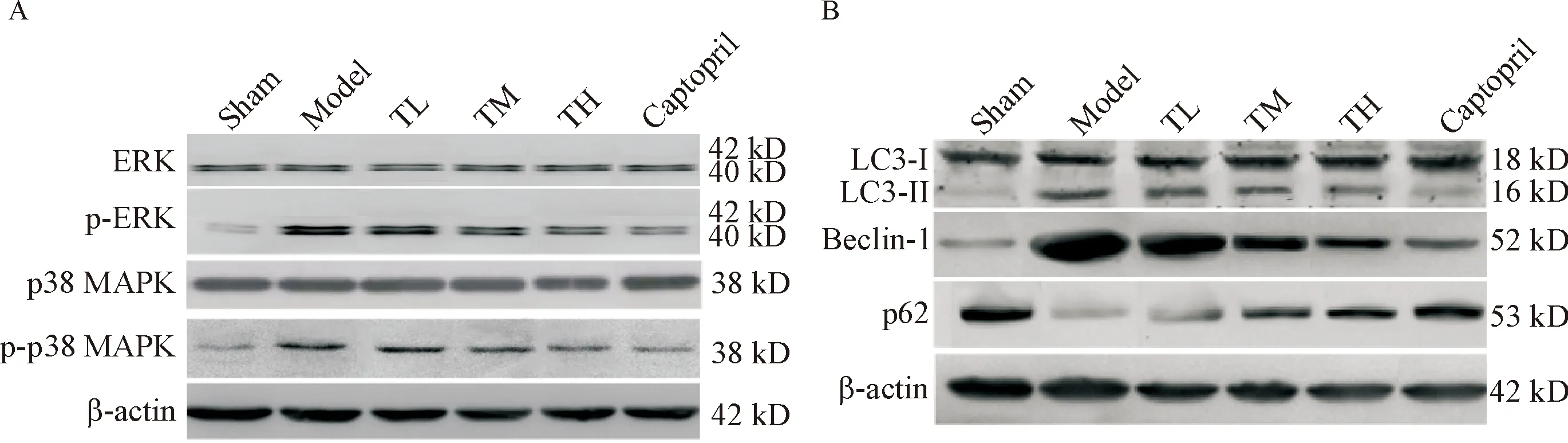
Figure 4. The representitive images of Western blot for determining the protein levels of p-ERK, p-p38 MAPK (A), LC3, beclin-1 and p62 (B).
图4 Western blot法检测各组p-ERK、p-p38 MAPK、LC3、beclin-1和p62的蛋白水平
表4 各组大鼠p-ERK和p-p38MAPK蛋白水平的比较
Table 4. Western blot was used to determine the protein levels of ERK, p-ERK, p38 MAPK and p-p38 MAPK in the myocardium of the rats with different treatments (Mean±SD.n=6)

GroupERKp-ERKp38 MAPKp-p38 MAPKp-ERK/ERKp-p38 MAPK/p38 MAPKSham0.63±0.080.32±0.031.10±0.130.23±0.020.42±0.060.25±0.03Model0.64±0.070.75±0.08*1.08±0.150.64±0.05*1.35±0.07*0.68±0.05*TL0.66±0.080.58±0.07*#1.05±0.120.44±0.06*#1.07±0.07*#0.54±0.06*#TM0.69±0.080.42±0.05*#1.05±0.140.30±0.04*#0.82±0.05*#0.35±0.04*#TH0.63±0.060.37±0.03*#1.04±0.130.26±0.05#0.67±0.03*#0.28±0.05*#Captopril0.64±0.070.32±0.04#1.07±0.090.21±0.03#0.51±0.04*#0.20±0.04*#
*P<0.05vssham group;#P<0.05vsmodel group.
表5 各组大鼠LC3、beclin-1和p62蛋白表达的比较
Table 5. Western blot was used to determine the protein levels of LC3, beclin-1 and p62 in the myocardium of the rats with different treatments (Mean±SD.n=6)
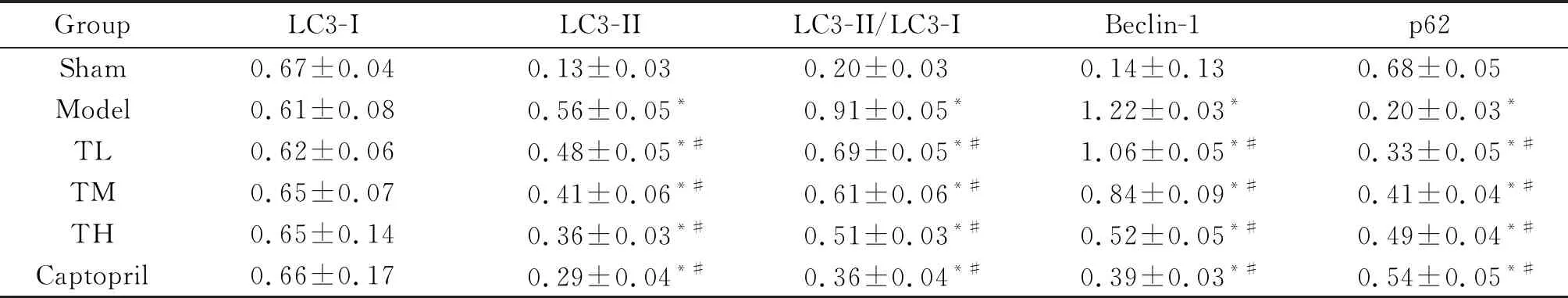
GroupLC3-ILC3-IILC3-II/LC3-IBeclin-1p62Sham0.67±0.040.13±0.030.20±0.030.14±0.130.68±0.05Model0.61±0.080.56±0.05*0.91±0.05*1.22±0.03*0.20±0.03*TL0.62±0.060.48±0.05*#0.69±0.05*#1.06±0.05*#0.33±0.05*#TM0.65±0.070.41±0.06*#0.61±0.06*#0.84±0.09*#0.41±0.04*#TH0.65±0.140.36±0.03*#0.51±0.03*#0.52±0.05*#0.49±0.04*#Captopril0.66±0.170.29±0.04*#0.36±0.04*#0.39±0.03*#0.54±0.05*#
*P<0.05vssham group;#P<0.05vsmodel group.
西医在治疗心力衰竭方面取得较大的进展,可有效提高患者生存质量,减轻心脏负担、抑制心室重构,改善患者的预后。中医治疗心力衰竭方面也占据一定的优势,心衰康为河南省中医院著名心血管病专家孙建芝教授拟定用于治疗心力衰竭的有效方剂,主要由附子、红参、丹参、黄芪、红花和桂枝等组成,具有益气温阳和活血化瘀的功效。临床研究显示,心衰康颗粒能够明显改善心力衰竭患者心功能,提高生活质量,且毒副作用较小[10]。基础研究显示心衰康能够提高心肌细胞能量供应,抑制大鼠心室重构[11]。本研究显示,与model组相比,心衰康各组大鼠的LVEDD和LVESD降低,LVPTWd、LVPTWs和LVEF升高,CO、LVDP、+dp/dtmax和-dp/dtmax升高;心肌细胞形态逐渐恢复正常,炎性细胞浸润减轻,提示心衰康可改善心衰大鼠心室结构以及心功能,还可抑制心室重构,且效果与卡托普利相似,提示心衰康对慢性心力衰竭大鼠具有一定的治疗效果,能够改善心室功能。
心肌组织受损是由多因素共同作用的结果,与细胞凋亡有关。正常情况下细胞凋亡对维持机体健康是有益的;当细胞受到刺激或损伤后,细胞凋亡程序发生紊乱,细胞发生异常凋亡,导致组织病理损伤以及细胞坏死[12]。近期多项研究证实在心肌损伤过程中,除存在凋亡还存在自噬,两者可能呈协同作用或拮抗作用保护/促进心肌损伤,目前尚不明确[13]。研究显示在心力衰竭大鼠中,给予自噬抑制剂干预后,心肺血流动力学发生改善,且线粒体通透性降低,推测自噬可能导致慢性心力衰竭的发生发展[14]。Jensen等[15]研究显示在扩张性心肌病患者进行左心室辅助装置(left ventricular assist device,LAVD)植入后,自噬蛋白LC3-II表达降低,患者心室功能得到一定的改善,推测降低心脏自噬水平可提高心脏功能。本研究发现,与sham组相比,model组心肌细胞凋亡率明显升高;心肌组织中自噬相关蛋白LC3-II和beclin-1蛋白表达升高,p62蛋白表达降低;给予心衰康干预后心肌细胞凋亡率降低,自噬相关蛋白LC3-II和beclin-1蛋白表达降低,p62蛋白表达升高,提示心肌细胞凋亡和自噬同时参与心肌损伤过程,心衰康可能通过抑制心肌细胞自噬和凋亡进而发挥心肌保护作用。
MAPK信号通路与细胞增殖、凋亡、炎症和免疫应答等病理过程相关。MAPK信号通路主要包括ERK、p38 MAPK和JNK信号通路,当细胞遭受外界刺激或损伤后,3条信号通路可独立发挥作用,也能通过相互交联发挥作用[16]。目前已有研究证实,MAPK信号通路与心衰、心梗梗死和心肌肥厚等多种心血管疾病的发生密切相关[17]。Cipolletta等[18]研究显示,在心肌肥厚大鼠中p-ERK表达明显升高,而抑制p-ERK表达后可降低心脏体积、心肌壁厚度和左心室质量,缓解心肌肥厚病情进展。另有实验研究显示,子宫内膜干细胞(endometrial stem cells,EnSCs)来源的细胞因子"鸡尾酒"(EnSC-derived cytokine cocktail,EdCC)通过激活MEK1/ERK1/2信号通路能够有效减轻心肌缺血再灌注损伤,因此推测EdCC可保护小鼠心肌缺血再灌注损伤,而MEK1-ERK信号通路是关键机制,同时也是保护心肌缺血再灌注损伤的重要信号通路[19]。心肌缺血再灌注损伤可激活STAT3/ERK1/2通路,能够提高心肌细胞自噬水平,加重心肌损伤[20]。本研究发现,model组p-ERK和p-p38 MAPK的蛋白水平较sham组均升高,给予心衰康后p-ERK和p-p38 MAPK的蛋白水平均降低,提示心衰康可能通过抑制MAPK/ERK1/2信号通路,降低心肌自噬活性,发挥心肌保护作用。
综上所述,心衰康能够抑制MAPK/ERK1/2通路,进而降低心肌自噬水平,减轻心肌组织损伤,发挥心肌保护功能,然而MAPK/ERK1/2通路调控机制较复杂,涉及上、下游调控蛋白较多,关于心衰康是通过哪些基因来调控MAPK/ERK1/2通路还有待后续深入研究。

