miR-125a-5p靶向LIMK1逆转非小细胞肺癌A549/DDP细胞对顺铂的耐药性*
刘勇志, 张 童, 沈 毅, 邓 爽
[核工业四一六医院(成都医学院第二附属医院)胸外科, 四川 成都 610000]
非小细胞肺癌(non-small-cell lung cancer,NSCLC)属于世界高发的恶性肿瘤之一,以手术治疗、放疗和化疗为主要治疗手段[1]。然而NSCLC早期症状不明显,患者就诊时多数已是晚期,此时化疗是唯一有效的治疗方式[2]。顺铂(cisplatin,DDP)是化疗中常用的化学药物,能够阻碍DNA复制,影响细胞周期,从而诱导NSCLC细胞凋亡,抑制肿瘤生长[3-4]。但长期使用易使肿瘤细胞产生耐药性,影响治疗效果。因此,寻找克服肿瘤细胞耐药性的方法,对改善NSCLC的治疗具有重要意义。
微小RNA(microRNA,miRNA,miR)是一种高度保守的非编码RNA序列,广泛存在于生物体内,参与细胞增殖、分化和凋亡等生物过程,与肿瘤的发生发展及肿瘤细胞的耐药性密切相关[5-6]。已有多项研究表明,miRNA在胃癌[7]和卵巢癌[8]等多种肿瘤中差异表达,调控癌细胞增殖和凋亡并影响细胞耐药性。其中,miR-125a-5p与多种肿瘤的化疗耐药性有关[9-10],但其在NSCLC化疗耐药中的作用机制尚未报道。本文以A549/DDP细胞为研究对象,通过检测miR-125a-5p对细胞活力及凋亡的影响并预测其潜在靶基因,探讨miR-125a-5p影响A549/DDP细胞顺铂耐药性的作用机制。
材 料 和 方 法
1 临床资料
选取2015年3月~2017年12月就诊于核工业四一六医院(成都医学院第二附属医院)经病理科确诊为非小细胞肺癌的患者共52例,其中男性33例,女性19例,年龄45~81岁,收集患者经手术切除的肿瘤组织及对应的癌旁组织(距离病灶≥5 cm),所有组织切除迅速放入液氮中,带回后存放于-80 ℃ 冰箱。本实验获得医学伦理委员会审批同意,所有患者术前未接受放疗、化疗等相关治疗并签署知情同意书。
2 材料
人支气管上皮细胞株16-HBE和非小细胞肺癌细胞株A549购自中国科学院上海生命科学研究院细胞库;顺铂耐药细胞株A549/DDP购自中国医学科学院肿瘤细胞库。胎牛血清、RPMI-1640培养基、胰蛋白酶和DDP购自Sigma;MTT和Annexin V-FITC/PI细胞凋亡检测试剂盒购自赛默飞世尔科技有限公司;BCA蛋白浓度测定试剂盒和SDS-PAGE 试剂盒购自江苏碧云天生物技术公司;TRIzol试剂购自北京天根生化科技有限公司;LipofectamineTM2000购自Invitrogen;TaKaRa反转录试剂盒和荧光定量试剂盒购自TaKaRa;miR-125a-5p mimics、miR-125a-5p inhibitor、mimics NC、inhibitor NC、si-NC和si-LIMK1购自Invitrogen; I 抗和II 抗购自Abcam;萤光素酶载体购自Promega。
3 方法
3.1 细胞培养及转染 使用含10% 胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基于37 ℃、5% CO2条件下常规培养,其中A549/DDP细胞培养基中含终浓度1 mg/L的DDP,每隔2 d更换1次新鲜培养基,细胞融合度约85% 时进行传代。收集对数生长期的细胞,加入适量胰酶消化,接种至6孔培养板常规培养。待细胞生长至融合度约50%,参照LipofectamineTM2000转染试剂说明书将mimics NC、miR-125a-5p mimics、inhibitor NC、miR-125a-5p inhibitor、si-NC和si-LIMK1分别转染至A549/DDP细胞并标记为mimics-NC组、mimics-miR-125组、inhibitor-NC组、inhibitor-miR-125组、si-NC组和si-LIMK1组。
3.2 RT-qPCR检测miR-125a-5p表达 适量组织或细胞充分研磨后,加入TRIzol试剂提取总RNA。使用TaKaRa反转录试剂盒进行反转录,TaKaRa荧光定量试剂盒配制反应体系,置于实时荧光定量PCR仪上进行扩增。以β-actin为内参照,所用引物及序列见表1,mRNA相对表达量用2-ΔΔCt表示。

表1 RT-qPCR引物序列
3.3 MTT法检测细胞活力及DDP的半数抑制浓度(IC50) 收集转染的A549/DDP细胞和常规培养的A549细胞,加入适量胰酶消化,以每孔2×104个的密度接种于96孔板中常规培养,分别在培养0 h、24 h、48 h和72 h时加入20 μL MTT(5 g/L),继续培养4 h,吸出培养液,每孔加入150 μL二甲基亚砜,室温振荡反应10 min,使用酶标仪测定490 nm的吸光度(A)值。细胞存活率(%)=(对照组A值-实验组A值)÷实验组A值×100%。药物对细胞的抑制率(%)=(1-实验组A值/对照组A值)×100%,计算IC50值。
3.4 流式细胞术检测细胞凋亡 转染的A549/DDP细胞培养72 h后,使用PBS缓冲液洗涤3次,胰酶消化后离心收集。加入500 μL 1×Binding Buffer重悬细胞,分别加入Annexin V-FITC和碘化丙啶,染色20 min后使用流式细胞仪检测细胞凋亡。
3.5 Western blot实验 收集转染的A549/DDP细胞,加入细胞裂解液裂解30 min,4 ℃、12 000 r/min离心10 min取上清,BCA试剂盒测定蛋白浓度。取50 μg蛋白样品进行SDS-PAGE,电泳结束后将蛋白转至PVDG膜,5% 脱脂奶粉封闭液封闭1 h,分别加入 I 抗4 ℃ 孵育过夜,TBST洗膜后加入 II 抗孵育1 h。TBST洗膜后ECL发光显影。
3.6 萤光素酶报告基因检测 收集A549/DDP细胞,按照LipofectamineTM2000转染试剂说明书将LIMK1-3’UTR野生型质粒与mimics NC和miR-125a-5p mimics共转染,将LIMK1-3’UTR突变型质粒与mimics NC和miR-125a-5p mimics共转染,常规培养48 h。裂解液裂解后4 ℃、 12 000 r/min离心10 min收集上清,检测细胞中萤光素酶活性。
4 数据处理及统计学分析
实验中每个样本重复3次, 运用SPSS 17.0对数据进行统计分析。计量资料正态分布数据采用均数±标准差(mean±SD)进行描述,两组数据比较采用t检验,多组数据总体比较采用单因素方差分析,总体有差异再用SNK-q检验进行多重比较。偏态数据采用中位数(下四分位数,上四分位数)[median (Q1,Q3)]描述,两组数据比较采用Mann-WhitneyU检验,多组数据比较采用Kruskal-WallisH检验,发现差异再用Nemenyi法进行多重比较。以P<0.05为差异有统计学意义。
结 果
1 miR-125a-5p在非小细胞肺癌组织和细胞中的表达
MTT法检测细胞活力发现,A549/DDP细胞活力明显高于A549细胞(P<0.05),见图1A,提示A549/DDP细胞具有DDP耐药性。RT-qPCR检测结果表明,与癌旁组织相比,miR-125a-5p在非小细胞肺癌组织中表达下调(P<0.05),见图1B;与16-HBE细胞相比,A549细胞和A549/DDP细胞中miR-125a-5p表达均显著下调(P<0.05),见图1C。
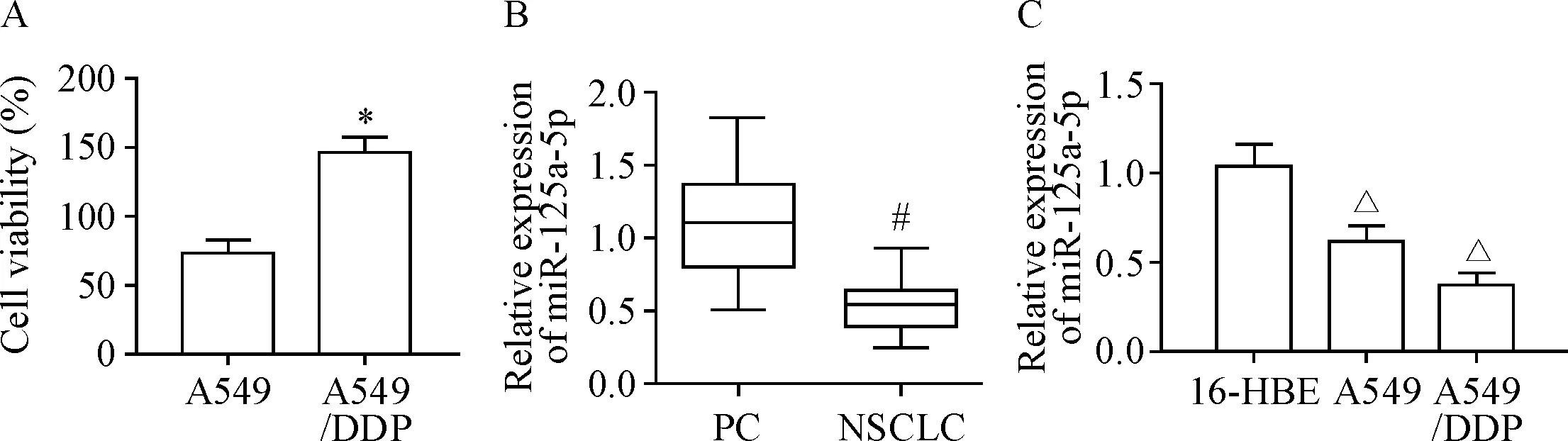
Figure 1. The expression of miR-125a-5p in the non-small-cell lung cancer (NSCLC) tissues and cells. A: the viability of A549 and A549/DDP cells was detected by MTT assay. Mean±SD.n=3. B: the expression of miR-125a-5p in the paracancerous (PC) and NSCLC tissues. Median (Q1,Q3).n=52. C: the expression of miR-125a-5p in various cell lines. Mean±SD.n=3.*P<0.05vsA549 cells;#P<0.05vsPC group;△P<0.05vs16-HBE cells.
图1 miR-125a-5p在非小细胞肺癌组织和细胞中的表达
2 过表达miR-125a-5p降低A549/DDP细胞耐药性
与control组和mimics-NC组相比,转染miR-125a-5p mimics的A549/DDP细胞中miR-125a-5p的表达上调(P<0.05),细胞活力下降(P<0.05),细胞凋亡率增加(P<0.05),DDP对细胞的IC50值减小(P<0.05),耐药相关蛋白P-糖蛋白(P-glycoprotein, P-gp)和谷胱甘肽S-转移酶π(glutathioneS-transfe-rase π, GST-π)蛋白表达下调(P<0.05),见图2。
3 抑制miR-125a-5p表达提高A549/DDP细胞耐药性
与control组和inhibitor-NC组相比,转染miR-125a-5p抑制剂的A549/DDP细胞中miR-125a-5p的表达下调(P<0.05),细胞活力升高(P<0.05),细胞凋亡率降低(P<0.05),DDP对细胞的IC50值增大(P<0.05),P-gp和GST-π的表达上调(P<0.05),见图3。

Figure 2. Up-regulation of miR-125a-5p inhibited the drug resistance of A549/DDP cells. A: the expression of miR-125a-5p in va-rious groups; B: the cell viability in various groups; C: the apoptotic rate in various groups; D: IC50values of DDP in va-rious groups; E: the protein expression of P-gp and GST-π. Mean±SD.n=3.*P<0.05vscontrol group and mimics-NC group.
图2 过表达miR-125a-5p降低A549/DDP细胞耐药性

Figure 3. Inhibition of miR-125a-5p enhanced the drug resistance of A549/DDP cells. A: the expression of miR-125a-5p in various groups; B: the cell viability in various groups; C: the apoptotic rate in various groups; D: IC50values of DDP in various groups; E: the protein expression of P-gp and GST-π. Mean±SD.n=3.*P<0.05vscontrol group and inhibitor-NC group.
图3 抑制miR-125a-5p提高A549/DDP细胞耐药性
4 LIMK1是miR-125a-5p的靶基因
过表达miR-125a-5p的A549/DDP细胞中LIMK1的表达较mimics-NC组下调(P<0.05);敲减miR-125a-5p表达的A549/DDP细胞中LIMK1的表达较inhibitor-NC组上调(P<0.05),证明miR-125a-5p能够调控LIMK1表达,见图4A、B。通过TargetScan在线预测,发现LIMK1-3’UTR上存在miR-125a-5p的结合位点,见图4C。进一步使用萤光素酶报告基因实验验证miR-125a-5p和LIMK1的靶向性,发现与mimics-NC组相比,转染miR125a-5p模拟物的LIMK1野生型细胞的萤光素酶活性降低(P<0.05),而LIMK1突变型细胞的萤光素酶活性无明显变化,见图4D,表明LIMK1是miR-125a-5p的靶基因。miR-125a-5p与LIMK1表达呈负相关(r=-0.7823,P<0.01),见图4E。

Figure 4. miR-125a-5p regulated the expression of LIMK1. A: the mRNA expression of LIMK1 in various groups; B: the protein expression of LIMK1 in various groups; C: the complementary sequences of miR-125a-5p and LIMK1; D: the result of dual-luciferase assay; E: the negative correlation between miR-125a-5p and LIMK1. Mean±SD.n=3.*P<0.05vsmimics-NC group;#P<0.05vsinhibitor-NC group.
图4 miR-125a-5p靶向调控LIMK1表达
5 敲减LIMK1表达降低A549/DDP细胞对DDP的耐药性并诱导细胞凋亡
对比癌旁组织,NSCLC组织中LIMK1表达上调(P<0.05),见图5A;A549细胞和A549/DDP细胞中LIMK1的表达较16-HBE细胞上调(P<0.05),见图5B。与control组和si-NC组相比,敲减LIMK1表达后A549/DDP细胞中的LIMK1表达下调(P<0.05),细胞活力下降(P<0.05),细胞凋亡率升高(P<0.05),DDP对细胞的IC50值减小(P<0.05),P-gp和GST-π 蛋白的表达下调(P<0.05),见图5C~G。

Figure 5. Silencing ofLIMK1inhibited A549/DDP cell resistance to DDP and induced apoptosis. A: the expression of LIMK1 in paracancerous (PC) and NSCLC tissues [median (Q1,Q2),n=52]; B: the expression of LIMK1 in different cell lines; C: the protein expression of LIMK1 in various groups; D: the cell viability in various groups; E: the apoptosis in various groups; F: IC50values of DDP in various groups; G: the protein expression of P-gp and GST-π in various groups. Mean±SD.n=3.*P<0.05vsPC group;#P<0.05vs16-HEB cells;△P<0.05vscontrol group and si-NC group.
图5 敲减LIMK1表达降低A549/DDP细胞对DDP的耐药性并诱导细胞凋亡
6 过表达LIMK1能逆转miR-125a-5p降低A549/DDP细胞对DDP的耐药性并诱导凋亡的作用
MTT法检测细胞活力,结果显示,LIMK1组较vector组细胞活力升高(P<0.05),mimics-miR-125+LIMK1组较mimics-miR-125+vector组细胞活力升高(P<0.05),见图6A。进一步检测细胞凋亡率、DDP的IC50值及P-gp和GST-π蛋白表达,结果显示,与vector组或mimics-miR-125+vector组相比,过表达LIMK1或共表达miR-125a-5p和LIMK1,A549/DDP细胞凋亡率降低(P<0.05),DDP对细胞的IC50值增大(P<0.05),P-gp和GST-π 蛋白的表达上调(P<0.05),见图6B~D。
讨 论
化疗是晚期NSCLC患者延长寿命、改善生活质量的希望,其中顺铂已被广泛应用于肿瘤的临床治疗,然而治疗过程中癌细胞对顺铂耐药性的产生限制了顺铂的疗效[11]。已有报道表明,miRNA可通过调节细胞周期和凋亡影响NSCLC细胞对顺铂的敏感性[12]。Li等[13]研究发现,抑制miR-196a表达可逆转A549/DDP细胞的顺铂耐药性;此外,Zhang等[14]通过实验证明,miR-181c能够通过靶向调控WIF-1表达增强癌细胞顺铂抗性。
miR-125a-5p在胰腺癌、宫颈癌和胃癌等多种肿瘤组织中差异表达,影响肿瘤细胞增殖、凋亡和迁移,具有抑癌因子的作用[15-17];在NSCLC组织中miR-125a-5p表达下调并调控癌细胞的迁移和侵袭[18]。随着不断的研究,发现miR-125a-5p不仅能影响肿瘤细胞生长和迁移,对肿瘤细胞在化疗中产生的耐药性也有一定影响,但相关研究较少。Naidu等[10]发现在NSCLC中,miR-125a-5p能通过靶向调控KRAS等肿瘤基因而增强癌细胞药物敏感性。为探讨miR-125a-5p对NSCLC顺铂耐药性的影响及作用机制,本文通过检测miR-125a-5p在NSCLC组织和细胞中的表达及其对A549/DDP细胞凋亡和耐药蛋白表达的影响,发现miR-125a-5p在NSCLC组织及细胞株中表达下调,过表达miR-125a-5p能抑制A549/DDP细胞中耐药P-gp和GST-π蛋白表达,降低细胞活力,促进细胞凋亡并使IC50值减小;抑制miR-125a-5p表达则得到相反的结果,表明miR-125a-5p能够影响A549/DDP细胞顺铂耐药性。通过TargetScan在线预测及萤光素酶报告基因实验,结果显示miR-125a-5p能靶向调控LIMK1表达,两者呈负相关。

Figure 6. Over-expression of LIMK1 reversed the effects of miR-125a-5p on the drug resistance and apoptosis of A549/DDP cells. A: the cell viability in various groups; B: the apoptosis in various groups; C: IC50values of DDP in various groups; D: the results of Western blot for determining the protein levels of P-gp and GST-π in various groups. Mean±SD.n=3.#P<0.05vsvector group;*P<0.05vsmimics-miR-125+vector group.
图6 过表达LIMK1能逆转miR-125a-5p降低A549/DDP细胞耐药性并诱导凋亡的作用
LIMK1属于LIM激酶(LIM kinase,LIMK)蛋白家族,能够使肌动蛋白结合蛋白cofilin磷酸化而调控细胞的有丝分裂、迁移和侵袭[19]。在乳腺癌和非小细胞肺癌组织中,LIMK1表达显著上调,促进癌细胞迁移和侵袭[20-21]。为进一步研究LIMK1与肿瘤细胞耐药性是否相关,陈瑞等[22]研究发现,上调LIMK1表达能增强人骨肉瘤细胞的耐药性。并且在NSCLC细胞顺铂耐药性的研究中,Chen等[23]发现,敲低LIMK1能降低肺癌细胞对顺铂的敏感性。为进一步验证miR-125a-5p与LIMK1在NSCLC细胞耐药性中的共同作用,我们使用RT-qPCR和Western blot实验进行检测,结果表明LIMK1在NSCLC及其细胞株中表达上调。敲减LIMK1表达能够抑制A549/DDP细胞活力并诱导凋亡,使IC50值减小,抑制耐药相关蛋白P-gp和GST-π的表达,与上述结论一致;而共表达miR-125a-5p和LIMK1,则miR-125a-5p对A549/DDP细胞活力及P-gp和GST-π蛋白表达的抑制作用减弱,对细胞凋亡的诱导作用亦减弱,DDP的IC50值回升。
综上所述,在NSCLC组织及其细胞株中,miR-125a-5p表达下调而LIMK1表达上调,LIMK1是miR-125a-5p的靶基因,且miR-125a-5p可靶向LIMK1而逆转肺癌A549/DDP细胞对顺铂的耐药性。这一结论补充了NSCLC顺铂耐药的机制,为寻找克服NSCLC顺铂耐药性的新方案提供可能途径。

