大黄附子汤作用机制的靶标与通路探讨
赵金龙,陈国铭,邝梓君,汤顺莉,黄 雁,陈子茵,张培婵,刘韵韵,唐纯志△
(1. 广州中医药大学针灸康复临床医学院,广州 510405; 2. 广州中医药大学第一临床医学院,广州 510405; 3. 广州中医药大学第三临床医学院,广州 510405)
经典中药复方大黄附子汤来源于《金匮要略》,此方包含大黄、附子及细辛3味中药,功效为温里散寒、通便止痛,主治寒积里实证[1]。在较多文献研究和临床实际应用中,大黄附子汤主要用于治疗消化系统[2]、肾病[3-4]、痛证、妇科疾病等系统或疾病[5]。霍黎生[6-7]、张林军[8]等报道了大黄附子汤在治疗功能性便秘方面的优势和显著疗效。吴丽[8]等报道了大黄附子汤治疗急性胰腺炎的作用机理。陈伟平[3]等报道了大黄附子汤治疗慢性肾衰竭的临床疗效,反馈较好。由于附子与细辛具有一定的毒性,也在一定程度上限制了该方的推广,其作用机制及原理尚未完全阐明,因此研究大黄附子汤治疗的作用机制及原理,对于推广其临床应用及新药开发具有重要的临床意义。
基于系统药理学的推导方法,对该方设计的数据进行分析,将从分子层面及通路领域预测大黄附子汤作用机制,以期为大黄附子汤的临床推广应用及开发新药提供有力的循证支持。
1 资料与方法
1.1 大黄附子汤的化学分子信息库
本研究通过中药系统药理学分析平台(TCMSP),以“大黄”“附子”“细辛”3个中药成分作为中药名检索大黄附子汤的化学成分。
1.2 化合物的信息提取
通过口服方式表现出来的生物利用度,是药物ADME中最重要的药物代谢动力学中的一个参数,其代表口服药物到达体循环所占口服剂量的多少,作用比率高的口服生物利用度也许是决定生物活性分子类药性的重要指标[9]。本文研究以口服生物利用度(oral bioavailability,OB)最低大于或等于30%和类药性(druglikeness,DL)最低大于或等于0.18作为活性化合物的选取标准,将数据库中具有较高活性的成分进行提取,以保证数据的有效性。
1.3 化合物与靶点网络的构筑
将该方相关的化合物及靶点通过软件Cytoscape 3.5.1构筑化合物-靶点网络,并对其进行拓扑学数据分析,从而研讨大黄附子汤的药理学作用机理,其中靶点度值(Degree)和中介中心度(Betweenness Centrality)是拓扑学数据中2个关键参数,可以评判该方剂相关化合物和靶标的关键性。
1.4 蛋白互作(PPI)网络的构建
蛋白质一般以相互组合的方式方能实现其生理学功能,因此蛋白相互作用网络的分析及研究是理解生命活动如生理过程等的基础条件。为阐明靶点蛋白在系统层面的用途,将大黄附子汤相关的靶点输入数据库STRING 10.5,使用相关设置功能,将评分设为0.90及以上,以此提升信息的可信性。通过以上数据处理而导出蛋白互作的可视化图,并根据相关数据提取相关靶标蛋白的关联频数。
1.5 KEGG通路富集分析
KEGG(Kyoto Enclopedia of Genes and Genomes)是东京大学和日本京都大学共同开发的数据库,研究可以通过此信息库进行相关通路的研究,且该信息库与David在线互联。为了阐明本研究方剂中相关化合物的靶点蛋白在信号通路中的作用机制,本文采用David v6.8数据库对靶点蛋白进行信号通路富集分析,从而分析大黄附子汤所涉及的相关通路。
2 结果
2.1 大黄附子汤的有效化合物数据
表1显示,通过TCMSP共提取到大黄附子汤中有效化合物349种,其中大黄含92种,附子含65种,细辛含192种。以OB 大于或等于30% 及DL 大于或等于0.18作为提取标准,筛选出活性化合物共45种,其中大黄含有16种,附子含有21种,细辛含有8种,所有化合物经比对并去除重复化合物后共计有39种。
2.2 大黄附子汤化合物-靶点互作网络
图1显示,化合物-靶点网络中共计有164个节点(其中化合物节点共计有26个及靶点节点138个)和602条边,其中化合物分子以红色节点进行标注,药物靶点以黄色节点进行标注,每条边代表化合物和靶点之间相关性,其中共有13个化合物未进行网络构筑。在网络中,一个节点度值的多少代表网络中节点之间相连边的数量。根据网络拓扑学的特点,选取度值较大的节点进行探讨分析。表2显示,化合物-靶点网络中的关键节点及其拓扑学性质。网络拓扑学相关结果如下,网络集中度0.368,网络密度0.023,网络异质性1.916,最短路径26732(100%)。平均度值结果3.670731707,大于平均度值的节点共计35个;节点平均中介中心度0.013573227,大于平均中介中心度的节点共计22个。根据节点的度值和中介中心度等拓扑学特征选用核心节点分析。这些连接化合物或靶点较多的节点在整个网络中甚至起到决定性的作用,可能是核心的化合物或靶点。

表1 大黄附子汤化合物信息特征表
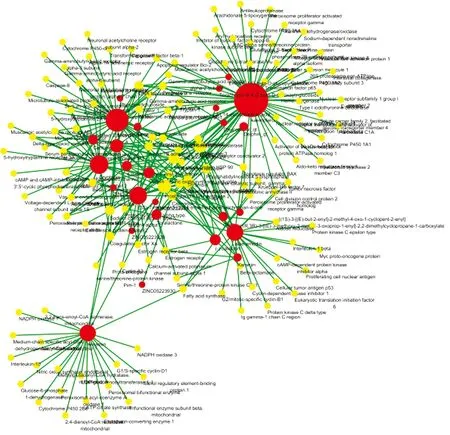
图1 化合物-靶标关系图

节点名称节点类型节点度值中介中心度kaempferol化合物630.45727971beta-sitosterol化合物380.21146257Cryptopin化合物280.13304807(3S)-7-hydroxy-3-(2,3,4-trimethoxyphenyl)chroman-4-one化合物260.11886808aloe-emodin化合物240.15672641sesamin化合物230.22268755Prostaglandin G/H synthase 2靶点170.21662085EUPATIN化合物160.04435578Nuclear receptor coactivator 2靶点120.06152629Prostaglandin G/H synthase 1靶点120.05155499Heat shock protein HSP 90靶点110.04910038(-)-catechin化合物110.03680959Toralactone靶点90.013935424,9-dimethoxy-1-vinyl-$b-carboline化合物90.01425451Sodium channel protein type 5 subunit alpha靶点80.05156333Phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit, gamma iso-form靶点80.02291593DNA topoisomerase II靶点70.04485815Calmodulin靶点70.0253232mRNA of PKA Catalytic Subunit C-alpha靶点70.03393374Coagulation factor Xa靶点60.03398017Alpha-1B adrenergic receptor靶点60.01840589
网络拓扑学分析最后表明,山奈酚(kaempferol)、β-谷甾醇(beta-sitosterol)、芦荟大黄素(aloe-emodin)等是大黄附子汤的关键性化合物成分,前列腺素G/H合成酶2、热休克蛋白HSP 90等是关键靶标。
山奈酚(kaempferol)是一种可从姜科植物山奈的根茎、槐树果实等植物类果实或根茎中分离出来的有效成分[10]。现代药理学研究结果证明,它可抑制金黄色葡萄球菌(SA)、绿脓杆菌(Pseudomonas aeruginosa)、伤寒杆菌(Salmonella typhi)等多种病原菌的生长, 具有抑制眼醛糖还原酶的作用,且能止咳祛痰兼具利尿等功效[11]。研究表明[12], 山奈酚是一类作用较大的蛋白激酶 CK2抑制剂,CK2 具有其内在的致瘤活性并与肿瘤的发生发展有着密切联系[13],因此山奈酚可能具有一定程度抗瘤抑制作用。这一结论也与山奈酚对离体人子宫肌瘤细胞增殖具有抑制作用相符[14]。这也提示大黄附子汤可能具有抗瘤作用。
beta-sitosterol是植物甾醇类化合物—β-谷甾醇,有抗炎、抑制肿瘤、免疫调节、防治前列腺肥大、抗氧化、降血脂、镇痛、促进伤口愈合、调节骨代谢平衡、保护胃黏膜、治疗癫痫等较多的药理作用及活性[15-16]。β-谷甾醇具有抗炎抗炎的作用[17],与现代药理研究[18]β-谷甾醇具有较强抗炎作用不谋而合。大黄附子汤酊剂用于治疗甲沟炎等炎症[19]疗效显著,可能是此活性成分在其中起到重要作用,与临床报道相符,从侧面印证了大黄附子汤潜在的抗炎作用。
芦荟大黄素(aloe-emodin)是一种蒽醌类生物活性成分,具有保护心血管系统、护肝、抗肿瘤、抗菌抗炎、免疫调整及泻下等药理作用[20]。有研究表明[21],芦荟大黄素可明显降低 LPS诱导的 RAW264.7细胞 NO释放,从而抑制NO的释放量。而诸多文献研究成果表明[22],功能性便秘可能是由于P物质、乙酰胆碱、NO等肠神经递质异常而引起的。也有研究显示,大黄附子汤在便秘治疗中,其机制可能与肠神经递质的分泌有关[23]。因此,大黄附子汤在治疗功能性便秘疾病时,可能是其有效化合物成分芦荟大黄素在其中调节NO等神经递质而起到治疗功能性便秘的治疗效果。这与临床上李虹[8]等运用大黄附子汤治疗便秘取得良好的疗效相符。且现代药理学研究大黄附子汤得出结论[24],其具有泻下、兴奋胃肠功能,与促进排便等药理学功能相符。
前列腺素G/H合成酶2(Prostaglandin G/H synthase 2)被认为是“快速反应基因”,通过一系列反应起到抗炎抗癌作用[25]。Fujita H等研究发现,COX-2可以通过抑制前列腺癌细胞凋亡起到促进前列腺癌细胞增殖的作用,且COX-2与前列腺癌血管形成、癌转移呈正相关[26]。邓琳等研究表明,COX-2 可促进卵巢癌细胞增殖及上皮间质转化,从而增强肿瘤细胞迁移能力[27]。COX-2作为炎性因子,会导致炎症发生和红肿热痛,使用抑制剂对COX-2进行抑制则可减少这种反应[28-29]。
热休克蛋白HSP 90(heat shock protein HSP 90)作为一种分子伴侣,具有广泛的生物学功能。张杰等[30]定量比较(狭缝杂交法检测)22对人肝细胞癌(HCC)及其配对非癌肝组织(PNL)和2例正常肝(NL)组织中热休克蛋白HSP90基因mRNA的表达水平,结果显示HSP90基因mRNA在HCC中表达最高,PNL中次之,NL中最少。此结果提示,Hsp90变化表现的时间较迟,也许在已经发生癌变的细胞中发挥某些作用,即可能与某些癌细胞如肝癌细胞的异常生长及转移等相关。
从以上对关键化合物及靶标的深度分析,大黄附子汤化合物、靶标与抗癌、抗炎机制及胃肠道疾病的关系十分密切。
2.3 大黄附子汤PPI网络的构建与分析
图2、3显示,为更好地理解与分析大黄附子汤的作用机制及原理,基于蛋白之间相互作用的关系,利用STRING构造本方剂中相关靶标的蛋白互作网络图。设置置信度大于或等于0.90,去除孤立于网络的相关靶标蛋白,得到PPI网络共计84个节点,470条边,平均度值5.595238095,其中节点代表靶标蛋白,每条边表示靶标蛋白之间的关联性。根据节点的度值绘制大于平均度值且度值较高的9个关键蛋白质节点的条形图。度值较高的3位分别为JUN、RELA、TP53,其中JUN度值(度值为23)高于其他节点,说明这个蛋白在网络中发挥了相对重要的作用,成为联通网络中其他节点的关键节点。
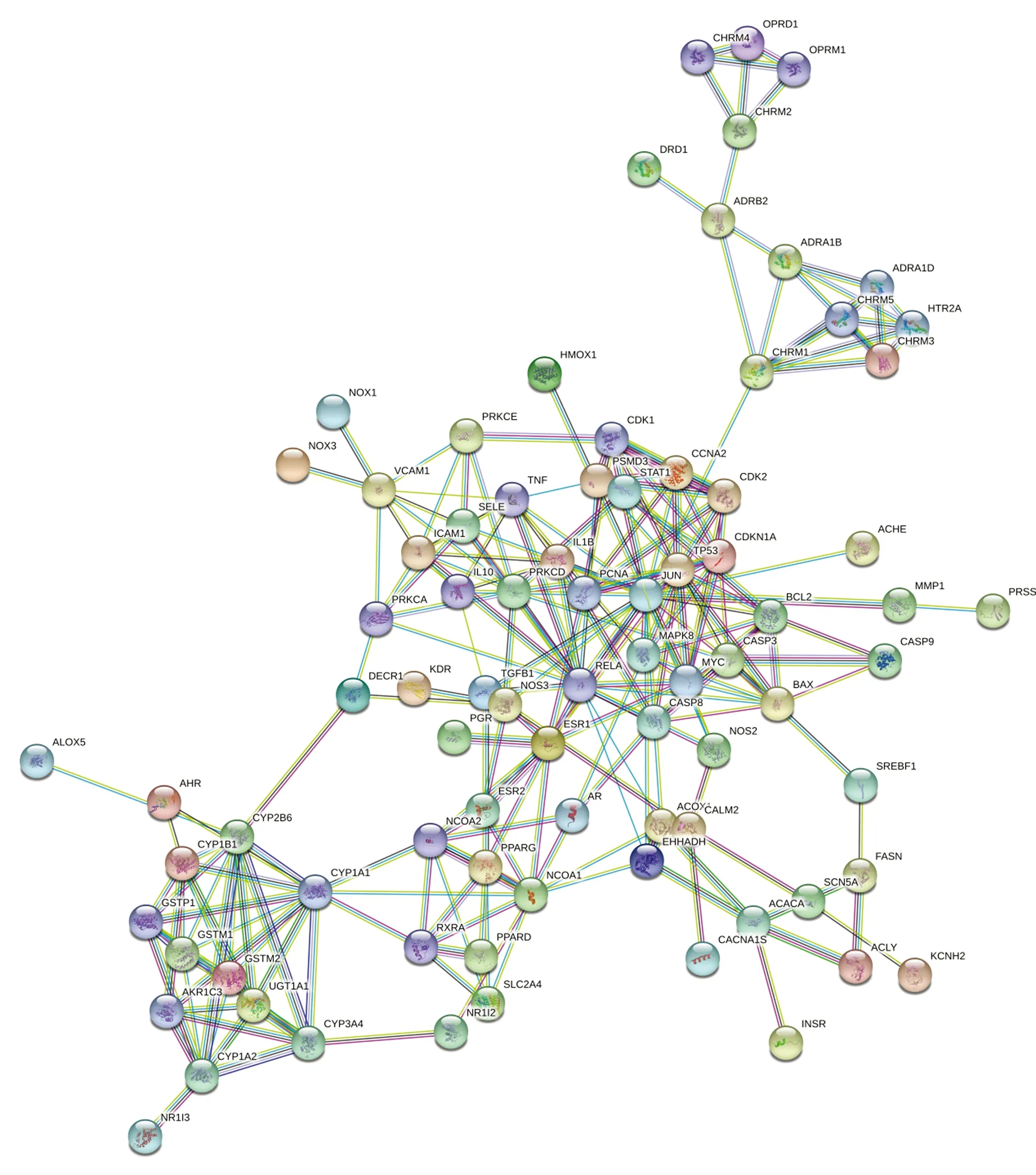
图2 大黄附子汤靶蛋白互相作用网络图
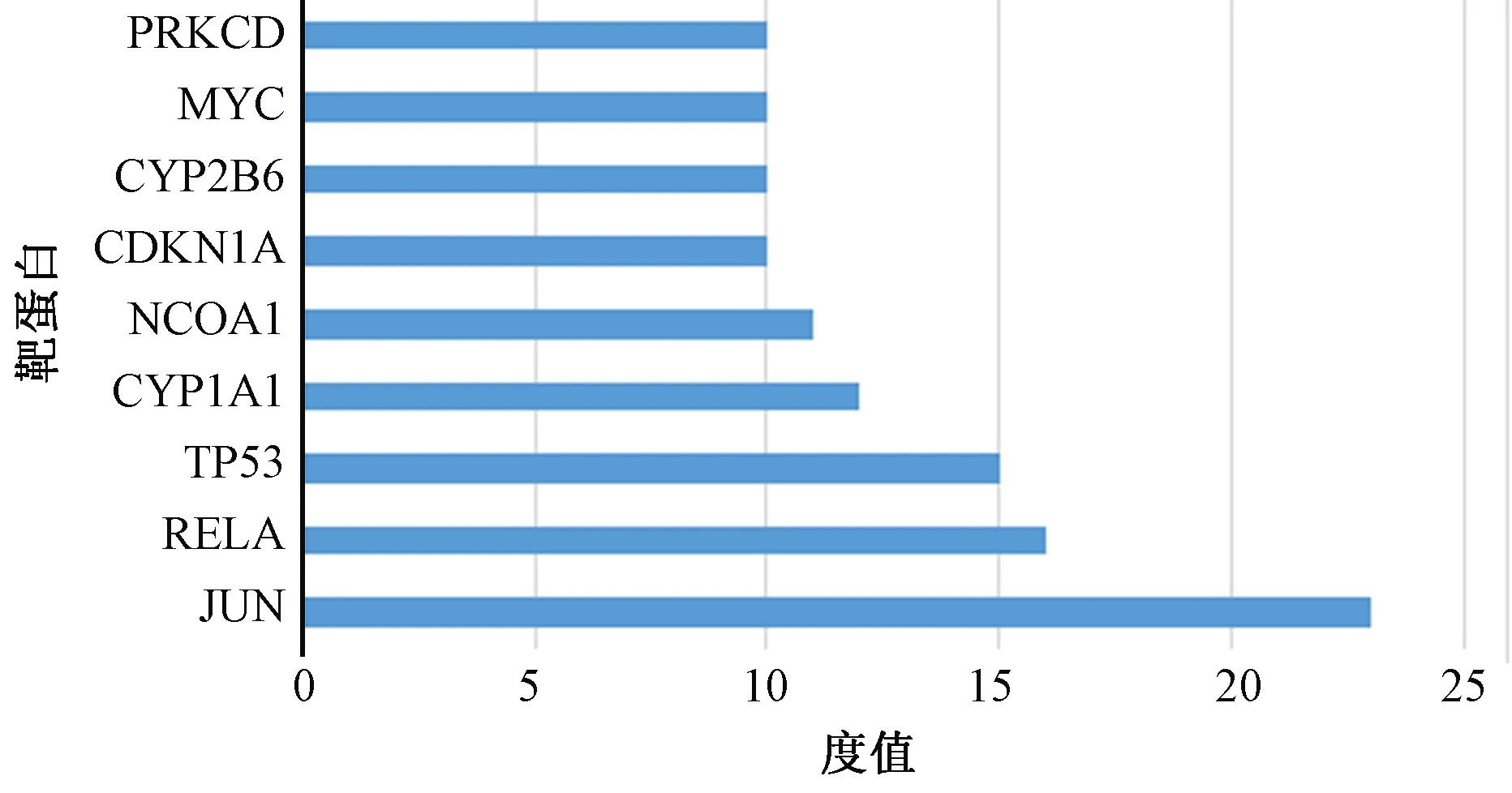
图3 蛋白质信息条形图
PPI网络分析表明,JUN、RELA、TP53、CYP1A1、MAPK1等靶蛋白度值远高于其他。c-jun蛋白水平的循环变化在腺上皮细胞的增殖和凋亡中是显着的。c-jun蛋白的持续基质表达可以防止基质细胞在晚期分泌期进入细胞凋亡[31]。RelA/p65为NF-Kβ的亚单位,且在炎症反应及炎症反应相关疾病的过程中有着重要影响。NF-κB能够引导单核巨噬细胞产生炎性细胞因子,如白细胞介素2、6、12等,从而引起强烈的炎症反应[32]。研究显示[33-34],外源性物质刺激生物体可以引起机体TNF-α和白细胞介素6等促炎因子的分泌,从而抗炎因子水平会降低,因而引起细胞因子水平的不平衡等,最终使得体内炎症的发生及发展。由此推测,大黄附子汤可能是通过作用于JUN、RELA等靶蛋白,从而调整IL-2等促炎因子在体内的生物学活动,起到抗炎等生理功能。这与大黄附子汤在临床治疗急性胰腺炎[33-34]、腹膜炎[35]等炎症疾病取得较好的临床疗效相符,从机制理论和临床实际应用层面证实了其抗炎作用。
正常情况下TP53的活性很低,当机体受到外界刺激而引起机体DNA受到损害时其活性会提高。研究显示,TP53基因的变化,可能与肝细胞癌的发生有较大联系[36]。TP53突变/蛋白质分子的表达可能是2级星形胶质细胞瘤复发恶性进展的预示指征[37]。有研究认为[38],TP53基因是一种非常重要的抑癌基因,其编码的蛋白p53能让众多基因保持相对稳定性,并调控细胞的相关生理过程,从而避免疾病的发生。TP53在大黄附子汤PPI网络中度值较高,因此其作用也不可忽视。由此推测,大黄附子汤有其内在的抗瘤作用及活性,可能是通过TP53基因蛋白的作用而发挥抗瘤的生物学功能。
2.4 KEGG通路富集分析
表3显示,使用David v6.8数据库对大黄附子汤靶蛋白基因进行信息通路富集,结果共有122条生物信息通路,计算每条富集通路的p值(P 值小于0.01为显著富集),对P值排序后取前10名进行分析。
为更深层次地探究大黄附子汤作用靶点在生物信号通路层面的机理,本文利用KEGG通路富集对大黄附子汤靶标基因进行研究。结果表明,差异有统计学意义的10条相关通路分别是Chemical carcinogenesis、Metabolism of xenobiotics by cytochrome P450、Hepatitis B、Drug metabolism- cytochrome P450、Steroid hormone biosynthesis、Retinol metabolism、Drug metabolism- other enzymes、Colorectal cancer、Pentose and glucuronate interconversions、Ascorbate and aldarate metabolism。由上述KEGG富集结果分析可知,大黄附子汤与化学致癌相关通路、细胞色素P450相关通路及视黄醇代谢等相关通路有较大联系。因此本文试图从以上几个主要方面进行机制探讨与分析,试图理解大黄附子汤在基因功能及信号通路层面的作用机制。

表3 KEGG通路富集情况表(Top 10)
细胞色素P450不仅是内源性物质的代谢酶,同时也是外源性物质的代谢酶,参与的代谢有致癌物质和临床药物治疗等,并具有重要的生物学功能如激素合成、外源物质降解、致癌物质消除等[39]。其中,CYP1A1等为细胞色素P450的亚型。与PPI网络中CYP1A1出现在度值较高具有某种内在联系,说明细胞色素P450及其亚型CYP1等在其相关通路中发挥着重要作用。有研究表明[40-41],CYP1A1的多态性基因或许会提高乳腺癌的患病概率。同时也有相关研究指出,有一类细胞保护机制是表达CYPs,如某些肿瘤细胞会通过此途径提供给癌细胞某一类未知的解毒药物或对癌细胞有害的物质,从而提高相关癌细胞的生存几率[42]。由此本文认为,大黄附子汤可能是通过细胞色素P450相关通路,调整CYP1等亚型破坏肿瘤细胞的保护机制,从而起到治疗癌症的作用。
3 讨论
本文运用系统药理学对大黄附子汤的作用机制及原理进行分子机制、基因及信号通路等层面的分析,认为大黄附子汤可能是其核心化合物山奈酚(kaempferol)、β-谷甾醇(beta-sitosterol)、芦荟大黄素(aloe-emodin)等通过Chemical carcinogenesis、Metabolism of xenobiotics by cytochrome P450等相关通路作用于JUN、RELA、TP53、CYP1A1、MAPK1等靶标而起治疗作用。结果发现,大黄附子汤在治疗消化系统疾病方面如便秘具有很强的科学性,由化合物-靶标网络分析可知,其可能是通过芦荟大黄素(aloe-emodin)等化合物、靶标及相关通路促进排便从而治疗便秘。这与大黄附子汤传统用法及现代临床应用[8,43]相符合,同时也验证了其在临床上具有抗炎活性的理论机制,如临床应用其治疗如胰腺炎、腹膜炎等炎症疾病。由PPI分析、David通路富集分析可知,大黄附子汤在理论上具有抗癌抗瘤潜在作用机制,但是临床及基础实验研究中极少提及大黄附子汤在治疗癌症疾病方面有特别之处。因此,大黄附子汤是否具有抗癌抗瘤作用及其临床疗效如何,可以作为今后研究的一个方向。

