60 Hz低频电磁场对α-淀粉酶催化效率的影响及作用机理
杨 慧,林日辉,*,樊艳叶,廖安平,蔡杏华,韦世昌,廖成超
(1.广西民族大学化学化工学院,广西多糖材料与改性重点实验室培育基地,广西高校化学与生物转化过程新技术重点实验室,广西南宁 530006;2.广西民族大学海洋与生物技术学院,广西高校微生物与植物资源利用重点实验室,广西南宁 530006;3.广西民族大学相思湖学院,广西南宁 530006)
淀粉的水解产物主要有糊精、麦芽糖、葡萄糖[1],其中葡萄糖广泛应用于工业、食用及医药等领域[2-3]。国内外比较常用的淀粉糖化工艺主要有3种:酸法、酶解法及酸酶法[4-5],其中酶解法具有反应条件温和,设备简单,催化效率高,产品纯度高等优点[5]。目前,酶法制备淀粉水解糖普遍存在反应时间长、能耗及生产成本高等问题[3,5],因此,提高酶促反应效率,有效缩短淀粉水解反应时间具有现实意义。刘洪等[5]报道微波-双酶耦合催化淀粉的水解率比水浴加热提高20%以上。石文奇等[6]在超声波对液体α-淀粉酶酶学活性的影响研究中,利用适当的超声波处理α-淀粉酶,其酶活性最大可提高13%,退浆率提高约10.2%。但微波和超声波的机械强度过高,容易破坏酶的活性中心,使酶失活,而且由于微波的热效应难以有效控制及超声波的衰减因素的制约,微波和超声波难以应用于工业大规模生产。
低频电磁场(low frequency electromagnetic field,LF-EMF)是指频率在0~300 Hz范围内的交变电磁场,其中工频电磁场(50~60 Hz)是在LF-EMF中应用最为广泛一类电磁场[7]。薛丽萍等[8]利用低电频电磁场对过氧化氢酶进行处理,酶活性及酶构象均发生改变,当处理温度为55 ℃时,最高酶活可提高100%以上,其二级结构向α-螺旋转变。张秋霞等[9]发现用0.1 T的磁场处理脂肪酶1 h可使酶活力提高76.1%。肖祖峰等[10]认为电磁场可降低传质过程的活化能,强化扩散。
本实验室前期研究中发现,在频率为60 Hz低频电磁场作用下,酿酒酵母生长速率提高了14.52%,葡萄糖消耗加快了15.6%,胞内乙醇脱氢酶(ADH)和超氧化物歧化酶(SOD)的比活力分别提高了7.25%和43.18%,有效促进酿酒酵母的生长代谢[11]。目前利用LF-EMF提高酶促反应效率的研究鲜见报道,且提高催化效率,缩短反应时间,降低能耗一直是工业上对酶制剂应用的追求目标,所以为了拓展LF-EMF的应用范围,提高酶催化效率,探索LF-EMF的作用机理,本文以α-淀粉酶催化水解玉米淀粉为研究对象,在反应过程中加入频率为60 Hz LF-EMF,探讨LF-EMF辐射对α-淀粉酶催化效率的影响,并进一步分析LF-EMF辐射对玉米淀粉的形貌及结晶度、α-淀粉酶结构及传质过程等方面的影响,探究LF-EMF的作用机理。
1 材料与方法
1.1 材料与仪器
玉米淀粉 食品级,广西南宁旺蜀商贸有限责任公司;α-淀粉酶(≥500 KNU/g)生物试剂 阿拉丁试剂(上海)有限公司;3,5-二硝基水杨酸、浓盐酸 分析纯,成都市科龙化工试剂厂;氯化钠 分析纯,天津市博迪化工有限公司;Tris碱 分析纯,北京索莱宝科技有限公司;N,N′-亚甲基双丙烯酰胺 分析纯,阿拉丁试剂(上海)有限公司;柠檬酸 分析纯,天津市科密欧化学试剂有限公司;磷酸氢二钠 分析纯,天津市大茂化学试剂厂。
电场发生装置(DENBA~08,功率为3.3 W,频率为60 Hz,电场强度为2.5 mV/m,有效辐射范围8 m3) 日本株式会社;SUPRA 55 Sapphire场发射扫描电子显微镜 德国卡尔蔡司公司;UItime IV组合型X射线衍射仪 日本理学公司;L400型高速冷冻离心机、F-700型荧光光度计 日本日立公司;WIX-miniPR02型垂直电泳槽 韦克斯科技有限公司;EPS301型电泳仪 瑞士Amershan Biosciences公司;GeIDOC XR凝胶电泳成像分析系统 美国BIO RAD公司;Chirascanq CD圆二色CD光谱仪 英国应用光物理公司;MQL-61R立式振荡培养箱 上海旻泉仪器有限公司;DDS-307型电导率仪 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 LF-EMF对α-淀粉酶催化效率的影响 实验设置辐射及对照两组(每个实验样品设三个平行),辐射反应组采用60 Hz LF-EMF进行辐射(放入摇床前开启辐射),对照组则不作辐射处理。实验组与对照试验的反应体系均含玉米淀粉1.00 g,50 mmol/L pH为6.4的柠檬酸-磷酸氢二钠缓冲液50 mL,置于150 mL锥形瓶,加入α-淀粉酶100 μL在150 r/min,40 ℃恒温摇床中反应。
采用DNS法测定水解产生的葡萄糖浓度[12-13],每隔2 h取样1 mL,8000 r/min离心5 min,取上清100 ℃水浴加热3 min,经无菌水稀释相应倍数,然后按照1∶1的体积之比与DNS试剂充分混匀,100 ℃水浴加热5 min,冷却至室温后,在540 nm波长下检测吸光值。葡萄糖的浓度计算根据标准曲线y=7.456x-0.3676(R2=0.9995)。
1.2.2 LF-EMF对玉米淀粉结构的影响 以蒸馏水代替反应体系的α-淀粉酶,在LF-EMF辐射下分别处理12、24 h,5000 r/min离心5 min,沉淀于60 ℃烘箱中烘干。将LF-EMF辐射处理淀粉与原淀粉制成电镜观察样品,采用场发射扫描电子显微镜(SEM)对样品表面形态进行对比分析;采用X射线衍射仪对样品进行XRD表征,CuKa射线,Ni滤波,管电压40 kV,管电流15 mA,扫描速率8(°)/min,扫描范围4~60 °;参照陈翠兰等[14]的方法计算样品的相对结晶度,对比结晶度变化。
1.2.3 LF-EMF处理对α-淀粉酶结构的影响 为了研究LF-EMF辐射是否对酶结构造成影响,对α-淀粉酶进行LF-EMF处理后,进行聚丙烯凝胶电泳(SDS-PAGE)、圆二色谱(circular dichroism,CD)及荧光光谱分析。
1.2.3.1 LF-EMF对α-淀粉酶一级结构的影响 将LF-EMF辐射处理的α-淀粉酶液与原酶液稀释至相同浓度(0.15 mg/mL),通过SDS-PAGE电泳[15]分析,分离胶浓度为12%(分离范围12~150 kDa),浓缩胶浓度为5%,上样量为10 μL,预电泳电压80 V,进入分离胶后调到120 V,用0.25%的考马斯亮蓝R 250染色1 h,脱色过夜。电泳结果采用凝胶成像仪进行拍照和分析。
1.2.3.2 LF-EMF对α-淀粉酶二级结构的影响 用pH6.4,5 mmol/L柠檬酸-磷酸氢二钠缓冲液配制0.4 mg/mLα-淀粉酶溶液,分别进行LF-EMF辐射处理与非LF-EMF辐射处理对照,在处理时间为6、12、24 h时分别取样0.5 mL,参考文献[16]运用圆二色谱仪检测α-淀粉酶的CD图谱。利用CDpro软件计算α-螺旋、β-折叠、β-转角、无规则卷曲所占比例。
1.2.3.3 LF-EMF对α-淀粉酶三级结构的影响 用pH6.4,50 mmol/L柠檬酸-磷酸氢二钠缓冲液配制0.008 mg/mLα-淀粉酶溶液。分别进行LF-EMF辐射处理与非LF-EMF辐射处理对照,在处理时间为6、12、24 h时分别取样1 mL,参照文献[17]记录激发波长为278 nm和发射波长298~436 nm波长范围内的荧光光谱。
1.2.4 LF-EMF下不同离子强度对α-淀粉酶催化效率的影响 电磁场可改变带电粒子的运动状态,提高动能[18],因此,反应体系中的离子强度可能对LF-EMF作用于酶促反应产生影响。为此,本文通过调整反应体系的柠檬酸-磷酸氢二钠缓冲液浓度[19-20],使反应体系离子强度分别设置为0.0047、0.0237、0.0474、0.0947、0.1894、0.2841、0.4735 mol/L,其他反应条件同1.2.1(每个实验样品设三个平行),进行酶促淀粉水解反应。反应4 h后取样检测葡萄糖浓度,分析不同离子强度下LF-EMF对α-淀粉酶催化玉米淀粉水解效率的影响差异。
1.2.5 LF-EMF对传质的影响 参考文献[21-22]以氯化钠在溶液中的扩散为模型进一步探究LF-EMF对传质的影响。准确称量10 g NaCl固体于称量瓶(ø40 mm×25 mm)内,以饱和食盐水装满,使之呈过饱和状态,用12000 kDa透析膜封口,将称量瓶轻柔置于装有500 mL蒸馏水的500 mL烧杯中。随机分成两组(每组3个平行),一组处于LF-EMF持续辐射,另一组为自然状态的自由扩散,每隔0.5 h用电导率仪检测液面以下1 cm电导率值,分析LF-EMF辐射对离子扩散的影响。
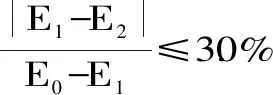
1.2.6 数据处理 所有实验均进行三次重复,采用Excel 2010进行实验数据统计,采用Origin(Pro 9.0)软件对实验参数和结果进行拟合分析及作图。
2 结果与分析
2.1 LF-EMF对α-淀粉酶催化效率的影响
如图1所示,在反应时间内,LF-EMF辐射显著提高α-淀粉酶催化玉米淀粉水解的反应效率(p<0.05)。当反应时间为10 h时,LF-EMF辐射条件下淀粉水解产葡萄糖为14.39 mg/mL,比对照提高了15.90%。说明LF-EMF辐射提高了α-淀粉酶催化玉米淀粉水解的效率。

图1 LF-EMF对α-淀粉酶水解玉米淀粉反应的影响
2.2 LF-EMF对玉米淀粉结构的影响
由图2、图3所示:电镜图显示玉米淀粉经LF-EMF辐射处理12、24 h后,表面光滑、平整、结构紧密并未发生破裂,与原玉米淀粉对比无明显差别。XRD分析显示LF-EMF辐射处理的玉米淀粉与原淀粉在衍射图谱上无明显区别;经计算,LF-EMF辐射处理12、24 h玉米淀粉与原淀粉的结晶度分别为26.92%、26.57%及26.74%,结晶度无显著变化(p>0.05)。该结果表明LF-EMF辐射对玉米淀粉的形貌及晶体结构均无显著影响,说明LF-EMF辐射对酶促水解的促进作用并非改变底物淀粉形貌或结构所致。

图2 玉米淀粉的电镜图(500×)

图3 玉米淀粉的XRD图
2.3 LF-EMF对α-淀粉酶结构的影响
2.3.1 LF-EMF对α-淀粉酶一级结构的影响 如图4所示:经LF-EMF辐射处理12 h及24 h后,α-淀粉酶在SDS-PAGE均显示只有一条蛋白带,其位置与原α-淀粉酶一致,分子质量约为60 kDa,表明经LF-EMF处理后,α-淀粉酶的肽链并未发生降解或聚合,α-淀粉酶的一级结构并没有受到显著影响[23]。LF-EMF辐射对提高α-淀粉酶水解玉米淀粉的促进作用并非由于改变催化剂α-淀粉酶的一级结构所致。
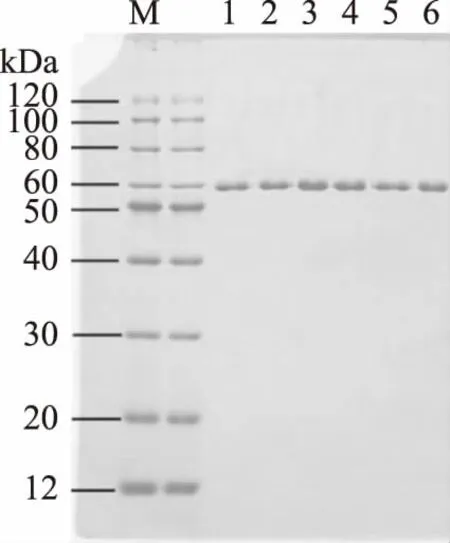
图4 α-淀粉酶SDS-PAGE电泳分析
2.3.2 LF-EMF对α-淀粉酶二级结构的影响 圆二色光谱(CD)是研究溶液中蛋白质构象的一种重要手段,具有不同二级结构的蛋白质或多肽所产生CD谱带的位置及吸收的强弱都不相同[23]。对比分析了经LF-EMF处理的α-淀粉酶及对照酶的CD光谱图,结果如图5所示。可见,经LF-EMF处理6、12、24 h的α-淀粉酶CD光谱图均未见特殊吸收峰出现,与未进行LF-EMF处理的对照酶谱图的基本一致。利用CDpro软件计算α-螺旋、β-折叠、β-转角、无规则卷曲所占比例见表1,计算结果显示α-淀粉酶的主要二级构象为β-折叠和无规则卷曲,占比均在30%以上,经LF-EMF处理的α-淀粉酶及对照酶的四种二级构象均无显著变化(p>0.05)。

图5 α-淀粉酶的CD光谱图

表1 α-淀粉酶的二级结构含量
2.3.3 LF-EMF对α-淀粉酶三级结构的影响 实验进一步以荧光光度仪分析了LF-EMF对α-淀粉酶结构的影响,结果见图6。α-淀粉酶的最大发射波长为340 nm,经LF-EMF处理6、12、24 h后的α-淀粉酶其最大发射波长均未发生移位,表明酶蛋白荧光发色基团周围的微环境没有发生改变;与对照相比,经LF-EMF处理6、12、24 h的α-淀粉酶在荧光发射峰的峰高与峰形上均未见显著改变(p>0.05)。

图6 α-淀粉酶的荧光谱图
上述LF-EMF辐射处理未发现对α-淀粉酶分子的圆二色光谱及荧光光谱造成影响有两种可能性。一是在实验辐射强度及处理时间内,LF-EMF辐射确实不能影响或破坏酶分子上的氢键等次级键,不会对酶分子的高级构象产生影响,LF-EMF辐射对提高α-淀粉酶水解玉米淀粉的促进作用并非由于改变催化剂α-淀粉酶的分子构象所致。第二种可能是:LF-EMF辐射会一定程度对影响α-淀粉酶的高级构象,但其作用相对较弱,一旦脱离辐射区,酶分子将迅速恢复其天然构象,表现为圆二色光谱及荧光光谱检测时未出现变化。此时,不能排除LF-EMF辐射对提高α-淀粉酶水解玉米淀粉的促进作用为改变α-淀粉酶的分子构象所致的可能性。
2.4 LF-EMF下不同离子强度对α-淀粉酶催化效率的影响
为进一步探讨LF-EMF辐射对促进α-淀粉酶水解玉米淀粉的作用机制,实验分析了LF-EMF辐射下不同离子强度对α-淀粉酶的催化效率,结果见图7。可见,在离子强度0.0047~0.4735 mol/L范围内,离子强度对α-淀粉酶催化淀粉水解反应具有相似的趋势:在离子强度达到0.0947 mol/L前,提高反应体系的离子强度对酶促反应具有促进作用,高于离子强度为0.0947 mol/L则对酶促反应产生抑制作用,张春玲等[24]关于大麦发芽过程中金属离子对大麦酶系中淀粉酶活力影响的研究也报道相似的结果。但是,LF-EMF辐射下不同离子强度对α-淀粉酶催化效率的影响与对照实验具有显著差异(p<0.05),主要表现在一下三个方面。第一,LF-EMF条件降低了α-淀粉酶最适离子强度。在实验条件下,非LF-EMF辐射下最适离子强度为0.0947 mol/L,LF-EMF辐射使之降至0.0474 mol/L。第二,在低离子强度条件下,LF-EMF辐射对离子提高酶活的影响具有强化作用。其中,反应体系离子强度由0.0047 mol/L提高至0.0237 mol/L时,非LF-EMF辐射下,反应体系葡萄糖浓度由(4.90±0.05) mg/mL提高至(4.99±0.06) mg/mL,α-淀粉酶的催化效率提高了1.84%;LF-EMF辐射下反应体系葡萄糖浓度则由(4.91±0.06) mg/mL提高至(5.29±0.02) mg/mL,催化效率提高了7.74%。第三,LF-EMF条件降低了高离子强度对α-淀粉酶的抑制作用。将反应体系离子强度由0.0947 mol/L提高至0.2841 mol/L时,非LF-EMF辐射下,反应体系葡萄糖浓度由(5.31±0.06) mg/mL降至(5.02±0.004) mg/mL,α-淀粉酶的催化效率降低了5.46%;LF-EMF辐射条件下反应体系葡萄糖浓度则由(5.45±0.03) mg/mL降至(5.42±0.009) mg/mL,催化效率仅降低了0.55%。

图7 LF-EMF下不同离子强度对α-淀粉酶催化效率的影响
离子对淀粉酶活性的影响机理很复杂,一般认为,无机离子是通过改变酶蛋白的构象来影响酶的活性的[25-27]。由于离子以强带电颗粒形式存在,其在反应体系中的运动或与酶蛋白相互作用将受到LF-EMF辐射直接影响。推测在低浓度离子下,提高离子强度有利于改善淀粉酶催化构象的形成,该作用在LF-EMF辐射作用下被进一步强化,表现为最适离子强度的降低及对酶催化活性的促进作用。在高离子强度下,此时无机离子浓度已经满足酶蛋白最适构型所需,过高的离子浓度反而会对酶活性中心产生遮蔽或阻碍作用,造成对酶催化的抑制作用[28]。在LF-EMF辐射条件下,无机离子运动被加强,其对酶活性中心的遮蔽或阻碍作用被减弱,表现为降低高离子强度对α-淀粉酶的抑制作用。
2.5 LF-EMF对传质的影响
实验以溶液中NaCl扩散为模型,探讨了LF-EMF对溶液中物质传质的影响。如图8所示:随NaCl的扩散,溶液电导率呈线性上升,LF-EMF辐射处理及对照的电导率时间曲线斜率分别为121.75及98.78,表明LF-EMF辐射处理强化了溶液中离子的扩散,增强因子β=1.23(斜率比)。武宏等[29]曾报道电磁场能够加速质量传递和扩散速率,改善动力学条件,肖祖峰等[10]认为电磁场可以降低传质过程中的活化能,强化传质。
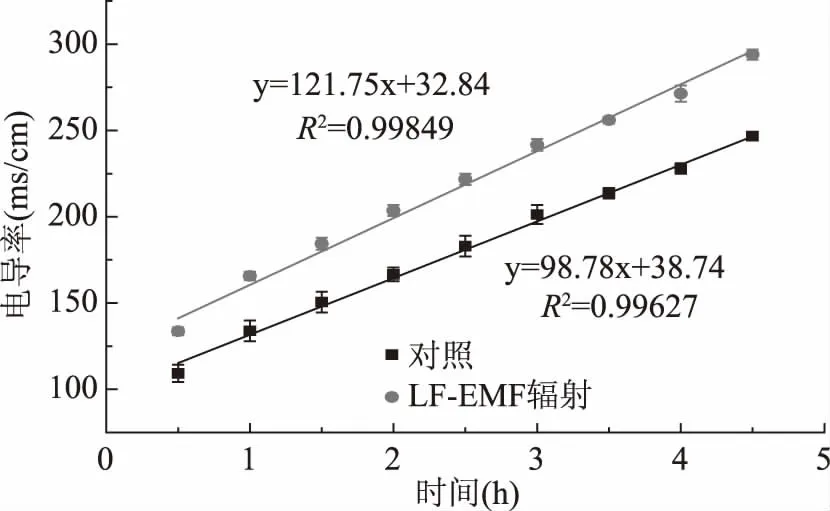
图8 溶液的时间电导率曲线

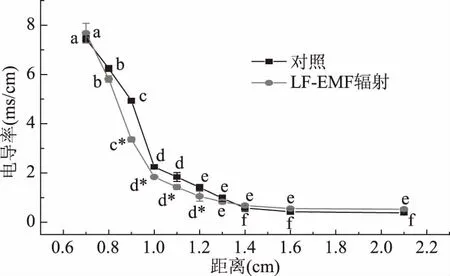
图9 表观膜厚度分析图
3 结论
LF-EMF辐射可提高α-淀粉酶催化玉米淀粉水解的反应效率,在反应时间为10 h时,反应效率提高15.90%。LF-EMF对玉米淀粉的形貌及结晶度没有影响,也未引起α-淀粉酶的一级的变化,因此LF-EMF辐射对提高α-淀粉酶水解玉米淀粉的促进作用并非由于改变底物结构或改变催化剂一级结构所致。实验虽未直接检测出LF-EMF辐射对α-淀粉酶圆二色光谱及荧光光谱的影响,但LF-EMF辐射降低了α-淀粉酶最适离子强度,强化了低离子强度条件下无机离子对酶活的促进作用,降低了高离子强度对α-淀粉酶的抑制作用等结果,均表明不能排除LF-EMF辐射影响α-淀粉酶高级构象,进而提高酶促反应效率的可能性。LF-EMF辐射可促进反应过程传质,是提高α-淀粉酶酶促反应效率的原因之一。在后续工作中,需要进一步研究LF-EMF辐射促进酶催化淀粉水解的反应机理,特别是在应用更有效的技术手段分析LF-EMF辐射对酶高级构象的可能影响,以及LF-EMF辐射对α-淀粉酶在淀粉粒表面吸附作用的影响等方面进行深入的研究。

