溃疡性结肠炎患者结肠黏膜5-HT信号通路的变化特点
溃疡性结肠炎(UC)是一种炎症性肠病(IBD),其特征是结肠黏膜和黏膜下慢性炎性反应,临床表现主要包括腹泻、便血和腹痛。UC的发病机制尚未完全明确[1]。
肠道5-羟色胺(5-HT)主要由肠嗜铬(EC)细胞合成、贮存和释放[2]。EC细胞通过色氨酸羟化酶1(TPH1)合成5-HT,5-HT释放后,一部分作用于各种5-HT受体发挥生物学效应,另一部分被5-HT再摄取转运蛋白(SERT)摄取到上皮细胞中,经单胺氧化酶代谢而终止作用。5-HT在胃肠道的运动、分泌和感觉调节中起着关键作用[3]。研究发现5-HT与肠道疾病如肠易激综合征、IBD有关[2,4-5]。有研究报道UC患者结肠黏膜中5-HT信号通路的变化,但结果不一致[2]。本课题组研究了5-HT信号通路在UC患者结肠黏膜中的变化,并分析了5-HT释放量与UC疾病活动度的相关性,以期进一步了解UC的发病机制。
1 研究对象与方法
1.1 研究对象
本研究选择2016年6月至2018年1月在香港大学深圳医院接受诊治的18例活动期UC患者,另选择11名同期的健康体检者作为健康对照组。UC患者包括11例男性和7例女性,年龄范围24~68岁,平均年龄(45.3±12.0)岁,平均病程(4.5±3.1)年。UC的诊断根据溃疡性结肠炎共识第1部分,采用Mayo病活动指数(DAI)评估UC疾病活动度(3~5分为轻度,6~10分为中度,11~12分为重度)[6]。UC组与健康对照组的年龄、性别差异无统计学意义(P>0.05),详见表1。两组均未使用针对5-HT系统的药物(如选择性5-羟色胺再摄取抑制剂、5-HT4激动剂或5-HT3拮抗剂)。通过结肠镜下活组织检查获得两组的结肠黏膜组织标本。本研究获得医院伦理委员会批准,所有入选者均知情同意。

表1 两组一般情况
1.2 结肠黏膜5-HT含量的测定
按照说明书制备结肠黏膜组织匀浆,使用酶免疫分析试剂盒(美国ENZO公司)检测5-HT含量。组织中5-HT含量单位为ng/mg。
1.3 结肠黏膜5-HT释放量的测定
每个受试者均取两块结肠黏膜活组织标本用来检测5-HT释放量。将标本置于37 ℃、5% CO2的组织培养板中(24孔),在1 000 μL含有10%胎牛血清(美国Gibco公司)、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基中孵育24 h,吸取培养液后离心,获取上清液,用酶免疫测定试剂盒(美国ENZO公司)测定释放到上清液中的5-HT量。
1.4 免疫荧光法检测5-HT、TPH1和SERT的分布和表达
将结肠黏膜活组织标本固定在10%的中性甲醛中过夜,常规制备石蜡切片。石蜡切片经脱蜡和水化后,经pH 6.8的枸橼酸钠溶液用高压锅行抗原热修复,在室温下0.1 mol/L PBS溶液(含5%正常驴血清和0.3%Triton X-100)中孵育30 min,4 ℃孵育一抗过夜,使用的一抗包括山羊抗人5-HT(1∶1 000)、兔抗人SERT(1∶100)和兔抗人TPH1(1∶100),均购自美国Abcam公司。切片用PBS溶液洗3次,在室温下用相应的二抗孵育1 h,使用的二抗包括Alexa Fluor 594标记的驴抗山羊IgG(1∶200)和Alexa Fluor 594标记的驴抗兔IgG(1∶200),均购自美国Jackson ImmunoResearch公司。切片用PBS溶液洗3次,再用包含DAPI的抗荧光衰减试剂封片(美国Cell Signaling公司),用荧光显微镜进行图像采集和分析。
1.5 图像分析EC细胞数量
用荧光显微镜观察5-HT和DAPI染色的免疫反应性,使用20倍高倍镜获取图像。5-HT免疫反应呈红色,DAPI复染细胞核为蓝色,位于结肠黏膜内的5-HT免疫阳性细胞即EC细胞。每个切片随机选取3个视野计数EC细胞数量和隐窝数量[24],计算隐窝的EC细胞平均数(3个视野的EC细胞总数÷3个视野的隐窝总数)。
1.6 结肠黏膜TPH1和SERT的mRNA表达水平
采用qRT-PCR检测TPH1和SERT的mRNA表达水平。使用RNeasy Plus Mini试剂盒(德国Qiagen公司),从新鲜冷冻结肠黏膜组织中提取和纯化总RNA。测定所有样品的RNA量,凝胶电泳评估RNA完整性。使用QuantiNova Reverse Transcription试剂盒(德国Qiagen公司)进行反转录,将所得的cDNA用于qRT-PCR。
qRT-PCR在LightCycler 480实时热循环仪(德国Roche公司)中进行,反应体积为20 μL。TPH1、SERT和内参基因β-肌动蛋白的mRNA水平采用QuantiNova SYBR Green PCR试剂盒(德国Qiagen公司)进行PCR检测。PCR扩增条件为95 ℃、5 s,然后95 ℃、5 s和60 ℃、10 s进行40个循环。用2-ΔΔCt法将SERT和TPH1的mRNA水平与内参基因β-肌动蛋白进行标准化,并与健康对照组进行比较。所有引物购自上海英潍捷基公司,SERT的正义引物为5′-TTGGACGTGTGAGGAT GTGG-3′,反义引物为5′-TCCCTGTTCTCTC CTACGCA-3′;TPH1的正义引物为5′-ACGTCGA AAGTATTTTGCGGA-3′,反义引物为5′-AC GGTTCCCCAGGTCTTAATC-3′;β-肌动蛋白的正义引物为5′-CATGTACGTTGCTATCCAGGC-3′,反义引物为5′-CTCCTTAATGTCACGCACGA T-3′。
1.7 统计学处理
采用SPSS 16.0软件进行数据分析,计量数据以均数±标准差表示。比较UC组和健康对照组时,用Studentt检验分析比较组间均数,用卡方检验分析计数资料。采用线性回归分析确定5-HT释放量与UC疾病活动度的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 5-HT的含量
如图1A所示,UC组结肠黏膜中5-HT含量[(67.48±21.14)ng/mg]显著高于健康对照组[(24.69±7.08) ng/mg],差异有统计学意义(P<0.001),说明UC患者结肠黏膜5-HT的含量增加。
2.2 TPH1的表达
肠道5-HT绝大部分由EC细胞合成、储存和分泌。5-HT生物合成的限速酶为TPH1。UC患者结肠黏膜中5-HT含量增加是否与5-HT合成增加有关?本研究采用RT-PCR定量研究TPH1的mRNA表达水平。结果显示,与健康对照组(1.01±0.18)相比,UC组结肠黏膜中TPH1的mRNA水平(2.01±0.43)显著升高,差异有统计学意义(P<0.001),见图1B。免疫荧光法检测发现,结肠黏膜隐窝内TPH1免疫反应性呈红色,DAPI复染细胞核为蓝色,UC组结肠黏膜中TPH1的免疫反应性较对照组升高,提示其TPH1蛋白表达水平显著升高,见图1C和1D。UC患者结肠黏膜中TPH1表达水平升高,提示5-HT合成增加。
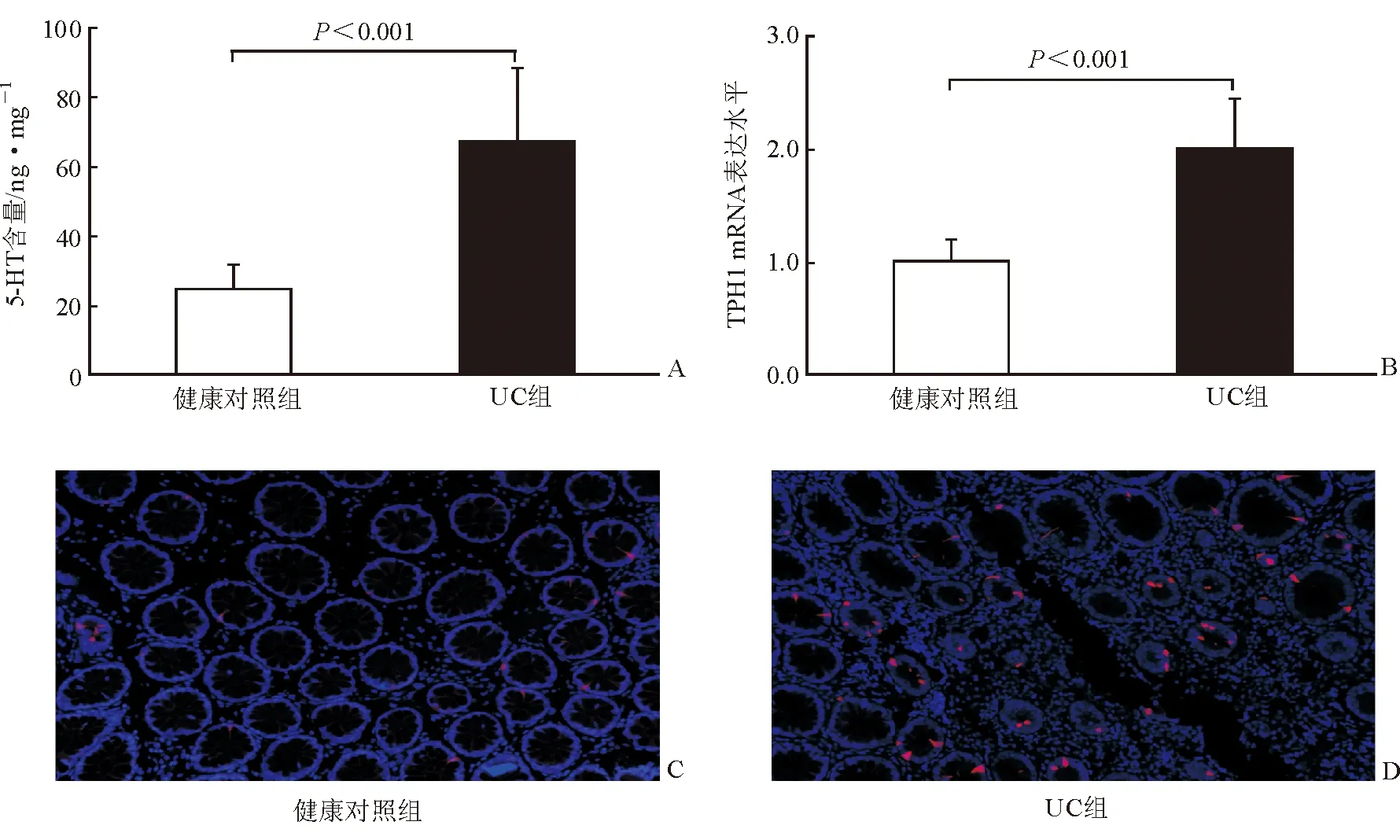
图1结肠黏膜中5-HT含量和TPH1表达A两组的5-HT含量比较B两组的TPH1 mRNA表达水平比较C对照组TPH1的免疫荧光反应(红色) ×200DUC组TPH1的免疫荧光反应(红色) ×200
2.3 EC细胞的数量
为了确定结肠黏膜中5-HT含量增加是否与EC细胞数量增加有关,本研究通过免疫荧光标记结肠黏膜中5-HT来定量检测EC细胞。如图2A和2B所示,结肠黏膜隐窝内5-HT免疫反应性呈红色,DAPI复染细胞核为蓝色,UC组的5-HT免疫反应性较对照组升高。如图2C所示,定量分析显示UC组结肠黏膜中每个隐窝的EC细胞数量[(1.3±0.3)个]比对照组[(0.5±0.1)个]显著增加(P<0.001)。

图2结肠黏膜中EC细胞数量A对照组的5-HT免疫荧光反应(红色) ×200BUC组的5-HT免疫荧光反应(红色) ×200C两组的EC细胞数量定量分析比较
2.4 5-HT的释放量及其与UC疾病活动度的相关性
结肠黏膜5-HT释放量如图3A所示,与健康对照组[(15.18±3.42)ng/mg]相比,UC患者5-HT释放量显著增加[(81.16±16.62)ng/mg],差异有统计学意义(P<0.001)。这表明随着TPH1表达水平的升高,5-HT含量和EC细胞数量的增加,结肠黏膜5-HT释放量也增加。相关分析显示,UC组结肠黏膜5-HT释放量与UC疾病活动度(Mayo评分)呈线性正相关(r=0.735,P=0.001),见图3B。

图3结肠黏膜5-HT释放量及其与UC疾病活动度的相关性A两组结肠黏膜5-HT释放量比较B结肠黏膜5-HT释放量与UC疾病活动度的相关性分析
2.5 SERT的表达
上述数据表明UC组结肠黏膜5-HT的释放量增加,然而,如果5-HT释放后被再摄取灭活的能力受到影响,5-HT信号通路可能改变。为了确定SERT在UC组结肠黏膜中的表达是否发生改变,本研究采用免疫荧光法检测发现,SERT广泛表达于结肠黏膜细胞,阳性表达的细胞染色为红色。与对照组相比,UC患者结肠黏膜中SERT的免疫反应性显著降低(见图4A和4B),提示结肠黏膜中SERT的蛋白表达水平也降低。本研究采用qRT-PCR法检测SERT的mRNA表达水平,发现与对照组(1.05±0.33)相比,UC组结肠黏膜中SERT mRNA表达水平(0.33±0.14)显著降低,差异有统计学意义(P<0.001),见图4C。

图4结肠黏膜中SERT表达水平A对照组的SERT免疫荧光反应(红色) ×200BUC组的SERT免疫荧光反应(红色) ×200C两组的SERT mRNA表达水平比较
3 讨论
UC发病率在全球普遍升高,其发病机制尚未完全清楚。5-HT在肠道运动、分泌和感觉功能中起着重要作用,并可加重结肠炎动物模型的炎性反应[5],因此UC发病可能与5-HT信号通路的改变有关。有关UC患者结肠黏膜5-HT信号通路异常的研究报道较少,而且结果不一致[2]。
本课题对UC患者结肠黏膜5-HT信号通路的变化以及5-HT释放量与UC疾病活动度的相关性进行了研究。肠黏膜中5-HT信号通路涉及5-HT的合成、储存、释放和再摄取降解。本研究结果表明,5-HT信号通路的几个关键环节在UC患者中发生改变,包括结肠黏膜中EC细胞增加、5-HT含量增加、合成酶TPH1表达上调以及SERT下调而导致的5-HT再摄取改变,这些改变导致UC患者结肠黏膜中5-HT的有效性增强。此外,本研究还发现结肠黏膜5-HT释放量与UC疾病活动度呈正相关。
本研究发现,UC组结肠黏膜中EC细胞数、5-HT含量和TPH1表达水平高于健康对照组,表明UC组结肠黏膜中5-HT的有效性增强。EC细胞中5-HT合成的限速酶TPH1表达升高,提示EC细胞合成5-HT增加。以往研究表明,UC患者结肠黏膜中EC细胞数量和5-HT含量增加[7-8],与本研究结果一致。然而,也有研究发现重度UC患者的结肠黏膜中EC细胞数量减少[9],这可能是由于重度UC患者结肠黏膜损伤导致EC细胞数量减少,也可能与EC细胞计数方法有关(EC细胞数量÷上皮细胞数量),UC患者结肠黏膜细胞增生可能导致EC细胞计数结果减少。
本研究发现UC患者结肠黏膜5-HT释放量增加,提示结肠黏膜中5-HT含量和EC细胞数量的增加改变了5-HT的释放量。动物实验发现结肠炎性反应时5-HT释放量增加[10],但也有研究发现UC患者结肠黏膜5-HT释放量无改变[9],这可能与检测方法有关,结肠黏膜5 min的5-HT释放量可能不足以反映炎性反应的黏膜与正常黏膜的差异。本研究检测结肠黏膜24 h的5-HT释放量,发现炎性反应黏膜较正常黏膜释放更多的5-HT。释放量增加的5-HT可能作用于各种5-HT受体,从而诱导更强的生物学作用。动物实验发现,5-HT可诱导动物结肠炎性反应加重[11],TPH1基因敲除小鼠[5]和TPH1抑制剂[12-13]均可使小鼠的结肠炎性反应显著减轻。本研究发现,5-HT释放量与UC疾病活动度(Mayo评分)呈正相关性。因此,UC患者结肠黏膜5-HT释放量增强,可能导致结肠炎性反应加重。
本研究还发现,UC组结肠黏膜5-HT摄取转运蛋白SERT的mRNA和免疫反应水平下调。以往研究发现UC患者结肠黏膜中SERT表达在蛋白和转录水平上均显著降低[9,14],动物结肠炎模型研究也有类似的结果[15],本研究结果与以往研究结果一致。临床研究发现,选择性5-HT再摄取抑制剂的应用与显微镜下结肠炎有关[16]。缺乏SERT的转基因小鼠可出现更严重的结肠炎[17]。因此,UC患者结肠黏膜SERT表达降低,提示5-HT再摄取灭活可能受损,可能也导致了5-HT有效性增强,导致结肠炎性反应加重。
总之,本研究结果表明,UC患者结肠黏膜5-HT信号通路多个环节发生异常改变,包括EC细胞数量增加、5-HT合成酶TPH1表达升高、5-HT含量和释放量增加,以及5-HT再摄取转运蛋白SERT表达下调,导致结肠黏膜5-HT的有效性增强。此外,结肠黏膜5-HT释放量与UC疾病活动度呈正相关。鉴于5-HT在肠道运动、感觉、分泌功能和炎性反应中的作用,UC患者的临床症状可能与结肠黏膜的5-HT信号通路异常改变有关。今后有必要进一步研究5-HT在UC患者结肠炎性反应中的作用,以及以5-HT信号通路为靶点的药物对UC患者的治疗作用[2,18]。

