农杆菌转化法高效构建顶头孢霉sorA和sorB双缺失菌株提高头孢菌素C产量
陈国枝 储炬
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
顶头孢霉(Acremonium chrysogenum)是β-内酰胺类抗生素的主要工业生产菌,其发酵产物头孢菌素C(CPC)经过化学法或者酶法处理可获得7-氨基头孢烷酸(7-ACA)[1],后者是合成各种头孢类抗生素药物的母核物质。2014年,Dominik等[2]公布了顶头孢霉野生型菌株ATCC11550的全基因组序列,使得从分子层面研究顶头孢霉基因功能更加便利。
原生质体转化法是顶头孢霉中最为成熟的遗传操作方法。然而,由于顶头孢霉细胞结构复杂、分生孢子量比较少[3]等特性,其原生质体制备较为繁琐、困难。同时,原生质体转化效率低下,使得顶头孢霉分子研究进程缓慢。农杆菌转化法依赖于根癌农杆菌的侵染性,会将自身体内的Ti质粒的一部分基因转移并整合到宿主菌内。由于该方法转化对象多样,宿主菌可以是孢子、菌丝体以及原生质体等,操作简便,转化效率也相对较高,逐渐成为真菌基因操作的常用手段[4]。
聚酮合酶(PKS)负责聚酮化合物主链的合成。其中I型PKS基于其β-酮的还原程度可分为:非还原型(NR)PKS、高度还原型(HR)PKS和部分还原型(PR)PKS。真菌聚酮化合物结构复杂多样,具有广泛的生产应用价值,如可降低胆固醇的洛伐他丁等。
Sorbicillinoids是顶头孢霉产生的黄色色素,它是一类环酮类化合物,属于次级代谢产物。由于其广泛的生物活性谱,它在抗氧化、抗癌等方向具有很大的应用潜力[5]。该物质存在于很多真菌中,如产黄青霉[6]、里氏木霉[7]等。在产黄青霉中有负责sorbicillinoids合成的PKS基因簇,Guzmán-Chávez等[6]通过对该基因簇中单基因敲除研究后发现,该基因簇中有一对反向排列的聚酮合酶,分别为HR PKS(sorA,Pc21 g05080)和NR PKS(sorB,Pc21 g05070),负责合成sorbicillinoids的骨架结构,敲除两个基因中的任意一个都会造成sorbicillinoids的缺失。目前该物质只能在很多野生型菌株中分离出来,青霉素高产菌如Wisconsin 54-1255不能产生sorbicillinoids[8],高产的顶头孢霉1-D1菌株呈白色,根据表型可以判断该菌株也无法合成该物质。同时实验表明,在传统菌株改良过程中,相对高产的产黄青霉的次级代谢基因转录图谱显示PKS基因簇被沉默了[9]。以上种种迹象表明sorbicillinoids缺失和CPC产量提高之间存在联系。
基于此,本研究采用农杆菌转化法高效了构建野生型顶头孢霉sorbicillinoids的缺失菌株,同时敲除sorA和sorB,考察色素sorbicillinoids和顶头孢霉产量之间的关系。
1 材料与方法
1.1 菌株和质粒
野生型顶头孢霉CGMCC 3.3795购于中国普通微生物菌种保藏管理中心;大肠埃希菌DH5α、农杆菌AGL-1和潮霉素表达载体pAN7-1均由本实验室保存;pAg1-H3由北京中科院刘刚老师馈赠。
1.2 仪器与试剂
主要仪器有HP1100液相色谱(Agilent有限公司);Nanodrop 2000型核酸定量仪(美国Thermo公司);MicroPluser型电转化仪。
真菌基因组DNA提取试剂盒、质粒提取试剂盒均购自Axygen公司;限制性内切酶、Taq酶等购自大连Takara公司;一步克隆法试剂盒购自南京诺唯赞生物科技有限公司;抗性筛选标记购自于生工生物工程(上海)股份有限公司,测序工作也由该公司完成。
1.3 培养条件及培养基
农杆菌与顶头孢霉共转化基本培养基(MM)、诱导培养基(IM)参见文献[10],摇瓶发酵培养基、培养方法以及产物HPLC检测方法参考文献[11],TSA培养基参考文献[12]。大肠埃希菌、AGL-1及顶头孢霉培养过程根据需要加入抗生素。
1.4 同源臂扩增
在产黄青霉中,负责合成sorbicillinoids的基因簇一共包含7个基因(Pc21 g05110-Pc21 g05050)[6]。通过NCBI的蛋白数据库,对产黄青霉中该基因簇上相关蛋白进行BLASTP检索,找到顶头孢霉野生型ATCC11550中对应的基因簇并确定表达SorA和SorB蛋白的两个基因。设计两对引物(pksup-F,pksup-R)和(pksdown-F,pksdown-R),通过真菌基因组DNA提取试剂盒提取野生型顶头孢霉CGMCC3.3795的基因组,以其为模板,分别扩增同源臂上游sorB和下游sorA基因中的片段。扩增得到单一条带后连接T载体送至上海生工生物工程有限公司测序。
1.5 载体的构建
将上下游同源片段与扩增后的表达载体pAg1-H3用一步克隆法相连接,得到pAg1-up-down质粒。将质粒进行KpnI单酶切回收,与扩增出的pAN7-1中潮霉素抗性表达片段进行一步克隆法连接,构建质粒pAg1-∆pks。将质粒转化DH5α感受态,挑选4个单菌落,对hph抗性编码区进行菌落PCR验证。对初步验证成功的质粒进行测序。载体构建流程见图1,所需引物见表1。
1.6 农杆菌转化
使用电击转化法将质粒pAg1-∆pks转化至农杆菌AGL-1的感受态中。取0.2μg pAg1-∆pks,将其与100μL农杆菌感受态混合冰浴30min,加入预冷的间距为1mm的电击转化杯中,电击转化(2400V场强,200Ω并联电阻,25μF电容器)。电击结束后立即加入900μL无抗LB,吹打吸取混合液,置于2mL离心管,28℃、100r/min下孵育2h。吸取液体,涂在含有对应抗生素的LB固体培养2d后,随机挑取至含抗LB液体中培养,PCR进行验证。
1.7 共培养
将转化成功的农杆菌转接至IM培养基中,待其A600为0.6左右时,与107个/mL的顶头孢霉孢子悬液等量混合。将混合液涂布与贴有Whatman Grade 542滤纸的IM平板中,置于24℃避光培养3d,然后将滤纸转移到含有100μg/mL潮霉素和200μmol/mL头孢噻肟的TSA筛选板中。28℃培养5d左右。挑取肉眼可见的白色菌落,转接至含有潮霉素的固体平板中,连续传代3次。
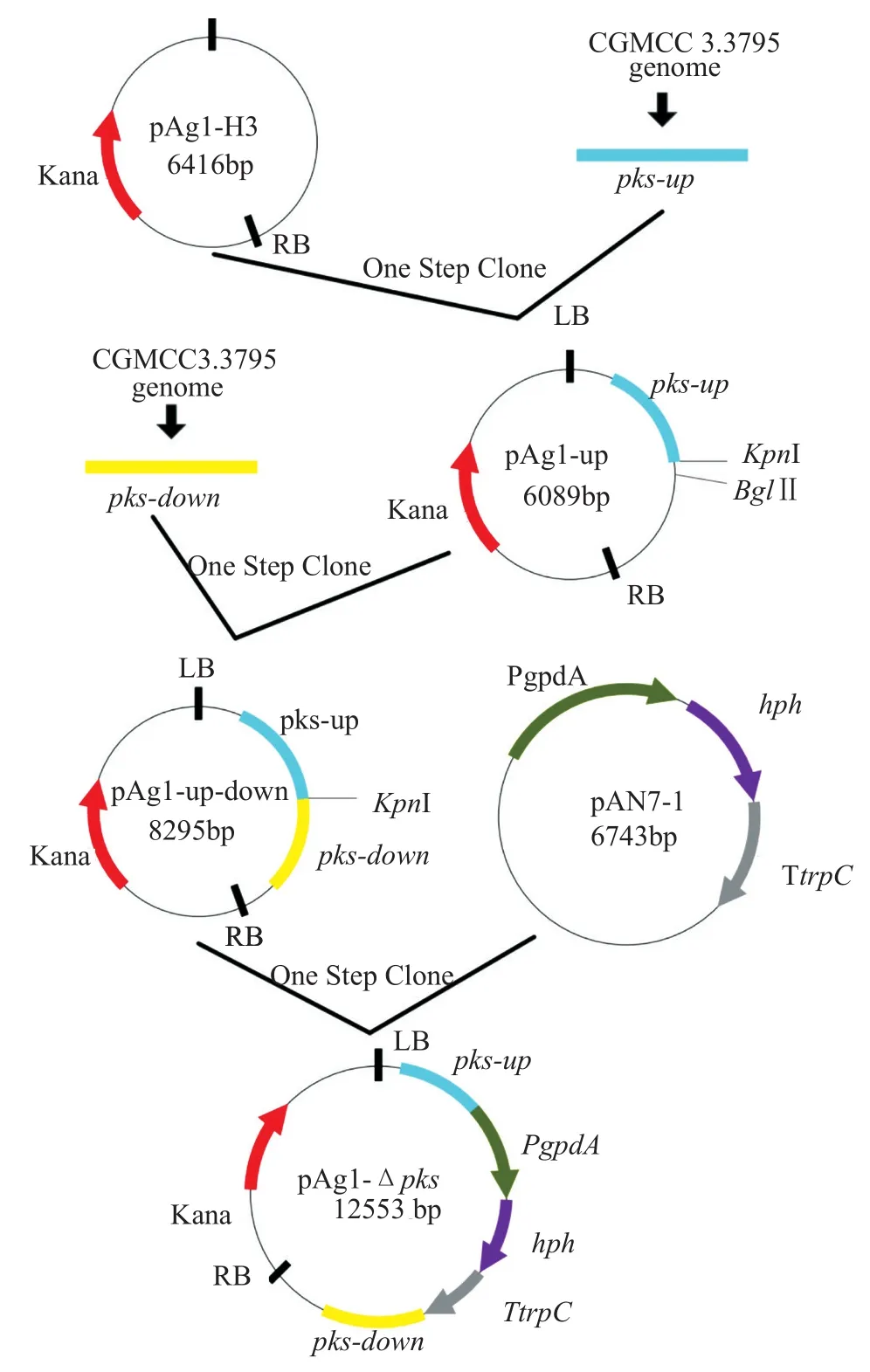
图1 载体pAg1-∆pks构建示意图Fig.1 Construction fl owchart of pAg1-∆pks

表1 试验所需引物Tab.1 Primers used in this research
1.8 转化子的PCR验证
挑取传代后仍为白色的菌落,使用真菌基因组DNA提取试剂盒提取基因组,以其为模板,通过4组引物进行PCR验证。验证正确后,扩增转化子的抗性表达片段,连接T载体后测序。
2 结果
2.1 同源臂扩增结果
通过蛋白序列的比对,发现顶头孢霉野生菌ATCC 11550中负责表达sorbicillinoids的基因簇一共包含8个基因(ACRE_048110- ACRE_048180)。其中有两个反向排列的基因,sorA(ACRE_048180)以及sorB(ACRE_048170)分别编码两个聚酮合酶,是合成sorbicillinoids的关键基因。因此实验设计敲除质粒,将潮霉素筛选标记连接至上下游同源片段中间,依据同源交换原理,敲除sorA以及sorB的部分编码基因,构建缺失菌株。载体的构建过程见图1。缺失菌的鉴定原理如图2所示,根据同源双交换的原理,抗性基因整合到了真菌基因组上。因此设计不同的引物可以扩增得到不同的片段,可用于缺失菌的鉴定。
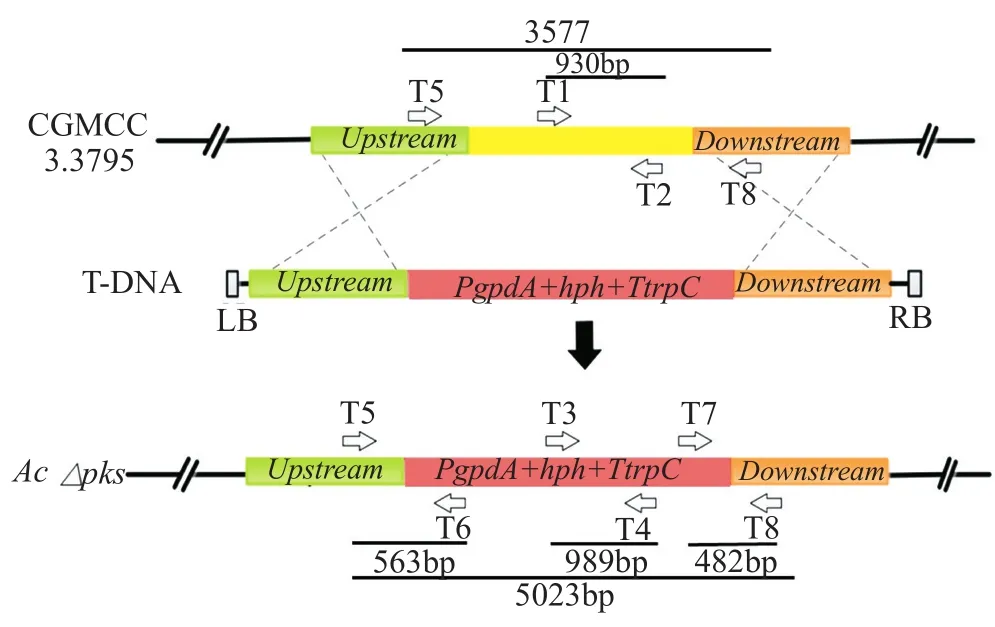
图2 缺失菌鉴定示意图Fig.2 Identification illustration of the mutants
依据序列设计并合成两对PCR引物,分别为用于扩增同源臂上游sorB基因中2105bp片段,以及下游sorA基因中2202bp片段。扩增结果如图3所示,其大小符合预期。同时,测序结果与GenBank公布的基因一致。这也表明顶头孢霉ATCC11550菌株与CGMCC 3.3795菌株的这两个基因序列无差别。
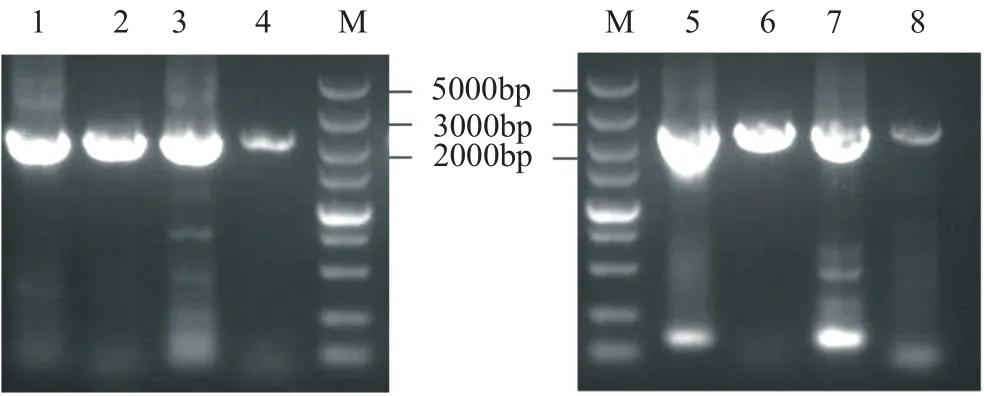
图3 pks上下游同源臂PCR结果Fig.3 PCR amplification of pks upstream and downstream
2.2 载体构建结果
用KpnI单酶切验证pAg1-up-down质粒。如图4A所示,单酶切后pAg1-up-down 质粒长度在7500~10000bp之间,符合实验预期结果。将线性化的质粒与潮霉素抗性表达片段进行连接,转入DH5α后,挑取4个单菌落进行培养,提取质粒,扩增hph抗性编码区,即1020bp。如图4B所示,电泳结果表明扩增片段长度均符合预期。随机选择其中1个质粒进行测序,验证无误,表明pAg1-∆pks质粒构建完成。
2.3 转化子验证结果
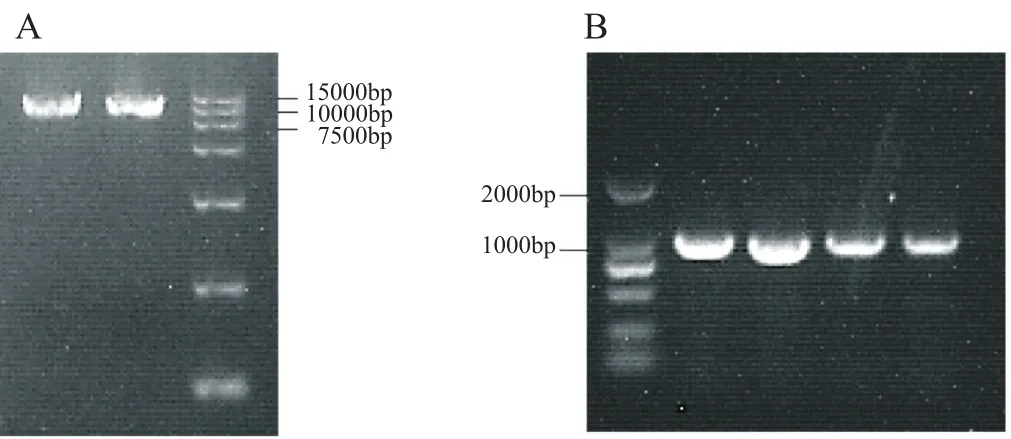
图4 电泳图谱验证Fig.4 Electrophoresis pattern verification
通过电击转化法将质粒转入农杆菌中,将农杆菌与顶头孢霉孢子共培养,抗性筛选得到转化子。挑选肉眼可见的变白的转化子,进行PCR验证。PCR验证原理以及PCR产物电泳图分别见图2和图5。两个聚酮合酶基因的缺失,会导致sorbicillinoids合成的阻断。如图2所示,以T1/T2扩增野生型顶头孢霉同源交换片段,以T3/T4扩增缺失菌中的抗性表达片段,以T5/T6扩增同源臂以及启动子片段,以T7/T8扩增终止子及下游同源臂片段。同时以T5/T8扩增时,野生菌和缺失菌均能扩增出片段,但是片段长度不同,可以用于确认是否转化成功。PCR结果显示,1~5号转化子的扩增片段和预期一样,6号转化子除T3/T4扩增结果不合预期外,其余都符合预期。从图5扩增结果可以看出,缺失菌基因组扩增大小明显区别于野生菌,符合同源双交换结果。将该扩增片段连接T载体后测序,测序结果表明,实验筛选得到双交换同时敲除sorA和sorB的菌株A.chrysogenum-∆pks。
通过表型挑选出的6株白色菌落,测序验证发现都是成功进行双交换的缺失菌。可以判定,呈现白色的菌落基本都是缺失突变株。挑选任意一个转化平板,如图6。已圈出的为5个白色菌落是缺失突变株,19个黄色菌落为野生菌,由此计算出本实验系统的基因缺失效率高达20%左右。
2.4 产量比较
为分析色素sorbicillinoids的缺失对CPC产量的影响,将其中1个突变株和野生菌株同时进行液体摇瓶发酵培养。先将菌株在摇瓶种子培养基上培养3d之后,转接到发酵培养基中先28℃培养3d,然后将培养温度调到25℃培养5d。每隔24h取样分析其发酵产量。液体摇瓶发酵培养过程及HPLC测定CPC浓度条件参见文献[11]。
HPLC结果显示,野生菌在第5天达到CPC产量的最高点,为0.36mg/mL,之后效价慢慢下降,在发酵第7天的效价只有0.33mg/mL。在发酵第7天的时候,缺失突变株的CPC产量达到最大值,为0.56mg/mL,比野生型菌株提高了70%。这表明,色素sorbicillinoids的缺失会提高CPC产量的影响。
3 总结
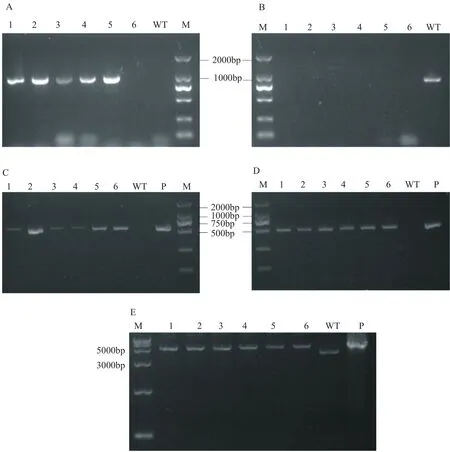
图5 缺失突变株的PCR验证Fig.5 PCR verification of pks deletion mutants
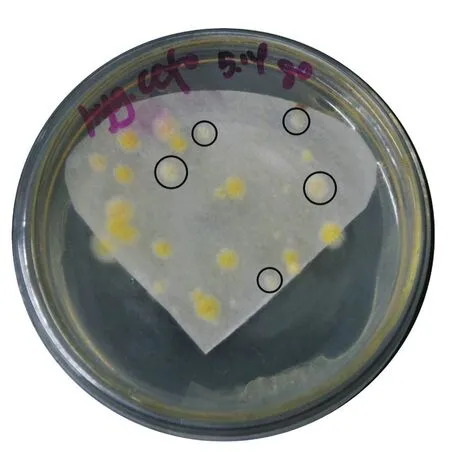
图6 抗性板筛选缺失突变株Fig.6 Screening of pks deletion mutants on plate
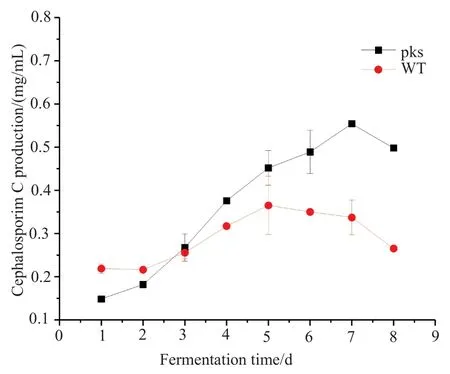
图7 缺失突变株及野生菌的CPC产量Fig.7 CPC production in pks deletion mutant and the wild-type strain
传统的原生质体转化法中,原生质体制备困难,再生率低下,导致转化效率低下,耗时费力,使得顶头孢霉分子研究进程缓慢。Xu等[13]建立的农杆菌转化平台,但是其转化对象为顶头孢霉原生质体,操作同样费时费力。本实验采用了农杆菌介导转化法,转化对象为孢子而非原生质体,操作简单,效率高,可以为顶头孢霉提供更为方便的分子构建平台。
Sorbicillinoids是一种次级代谢产物。通过Blast发现,在顶头孢霉中有一个聚酮合酶基因簇,共8个基因,负责其生物合成。本实验构建A.chrysogenumpks菌株,同时敲除了sorA和sorB基因,切断了次级代谢产物sorbicillinoids的合成途径,节约了代谢能量,其CPC产量比出发菌株提高了70%。这不仅为CPC产量提高提供一个策略,也为后续深入研究sorbicillinoids的代谢调控机制奠定了基础。