组蛋白去乙酰化酶抑制剂与加替沙星新缀合物的合成及抗肿瘤活性
杨科 王进 邓艾平
(1 华中科技大学同济医学院附属武汉中心医院药学部,武汉 430014;2 华中科技大学同济医学院药学院,武汉 430030)
近年来,以喹诺酮类药物为结构基础来设计新型的抗肿瘤药物已经成为肿瘤化学的一个热门领域[1-3]。目前已有数百个具有抗肿瘤活性的喹诺酮衍生物被报道的[4-6]。通过研究喹诺酮类药物的抗肿瘤机制发现,其主要通过抑制肿瘤细胞的拓扑异构酶II与有丝分裂来起作用[7-8]。微管作为细胞的骨架在其有丝分裂过程中发挥着重要的作用,通过微管蛋白聚合抑制剂能够破坏微管的结构,使肿瘤细胞产生非正常的有丝分裂,从而造成肿瘤细胞的凋亡[9]。因此,设计出具有微管蛋白聚合抑制活性的喹诺酮衍生物将是喹诺酮类抗肿瘤药物研究的一个新方向[10]。
组蛋白去乙酰化酶(histone deacetylases,HDACs)是表观遗传中一个重要的酶家族,它调控着基因的转录和表达。当HDACs呈现出过表达状态时,将会打破基因的乙酰化平衡,使调控细胞周期和增殖的信号分子缺少表达,从而使得细胞恶变,引发肿瘤[11]。目前,HDACs,尤其是HDAC1、2、6,被发现过表达在多种癌细胞中[12-14]。因此,HDACs也成为了近年来肿瘤学研究的一类重要靶点。相应地,已有多个HDAC抑制剂被美国食品药品监督管理局(FDA)批准了用于治疗不同的癌症[15],例如伏立诺他(vorinostat,SAHA)能够通过增加癌细胞中组蛋白乙酰化水平来重新激活抑癌基因,最终实现肿瘤细胞的分化与凋亡[16]。
基于喹诺酮类药物和HDACi展现出的优秀抗肿瘤活性,最近本研究组以及其他研究组均发现将HDACi单元,即SAHA类似物通过酰胺(图1,1A)[17]、酯(图1,1B)[17]或者杂环(图1,1C)[18]拼接到喹诺酮类药物C-3位构建出的喹诺酮-HDACi双靶点缀合物不仅具有较强的HDACs靶向性,而且还展现出了优秀的抗肿瘤活性。
近期的研究发现,喹诺酮类药物C-3位羧基虽是抗菌活性的药效团,但并非抗肿瘤活性是必须的,用其生物电子等排体或其他活性片段取代均能显著地提高抗肿瘤活性[19-22]。然而,目前尚不了解喹诺酮类药物C-7位碱性侧链引入活性基团是否也能够提高其抗肿瘤活性。因此,在前期研究的喹诺酮类药物C-3位与HDACi(SAHA类似物)拼接的基础上[17],为了进一步探讨喹诺酮类药物C-7位拼接SAHA类似物对活性的影响,本研究拟将SAHA类似物通过点击化学拼接到加替沙星(gatifloxacin,1)上构建出新型加替沙星-HDACi缀合物(图2,缀合物10a~c);同时将SAHA类似物单元拼接在加替沙星(1)的C-3位作为对照物(图2,缀合物13);接着,测试这些缀合物的生物活性。结果表明,目标缀合物对HDAC1、HDAC2和HDAC6均有不同程度的抑制活性,其中SAHA类似物单元拼接在加替沙星C-7位的缀合物10b与C-3位的13对HDACs的抑制活性、微管蛋白聚合抑制活性以及抗肿瘤活性影响相当,即SAHA类似物单元的拼接位置对活性影响较小。所合成的4个目标缀合物均未见文献报道。
1 合成方法
目标缀合物10a~c和13的合成过程见图3。参照加替沙星(1)的合成方法[23],以1-环丙基-6,7-二氟-4-氧代-1,4-二氢-喹啉-3-甲酸(3)为原料,将其喹诺酮母核与硼酸乙酯[B(OAc)3]鳌合得到鳌合物4,随后再与哌嗪发生亲核取代反应得到了加替沙星鳌合物5;进一步将鳌合物5哌嗪基与炔丙基溴发生亲核取代反应得到乙炔基衍生物6。同时,通过亲核取代反应将溴代烷基酸2与叠氮钠反应制得烷基叠氮酸7;接着通过点击化学将乙炔基化合物6与7反应制得羧酸类缀合物8;然后用新配置的羟胺将羧酸类缀合物8的羧基转化成相应的肟酸类缀合物9;最后将缀合物9水解即得到了加替沙星-HDACi缀合物10[图3(i)]。
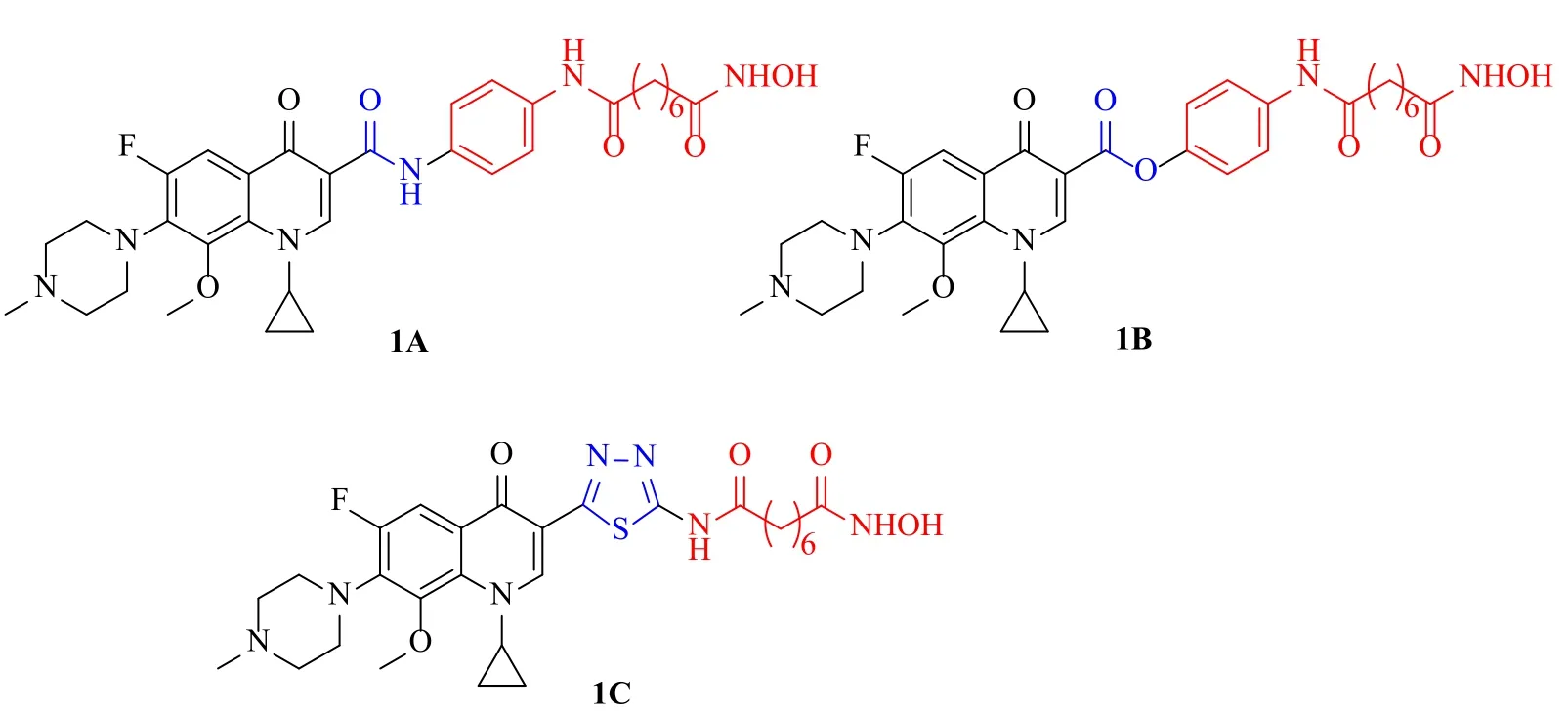
图1 C-3 喹诺酮类药物-HDACi 缀合物的结构Fig.1 Structures of C-3 gatif l oxacin-HDACi conjugates
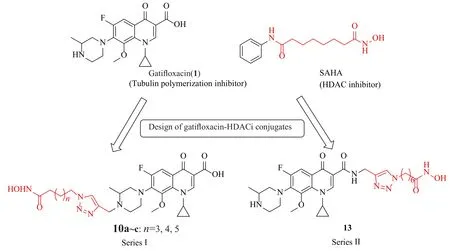
图2 设计的加替沙星-HDACi 缀合物Fig.2 Design of dual-acting gatif l oxacin-HDACi conjugates
另一方面,C-3位加替沙星-HDACi缀合物13的合成路线如图3(ii)所示。首先,将加替沙星(1)与炔丙胺反应制成乙炔加替沙星11;接着通过点击化学将乙炔加替沙星12与烷基叠氮酸7b反应,制得加替沙星-HDACi羧酸类缀合物12;然后用新配置的羟胺将羧酸类缀合物12的羧基转化成异羟肟酸,得到了相应的肟酸类缀合物13。
2 实验部分
2.1 实验仪器
AM-400Hz型核磁共振仪(德国Bruker公司);Q Exactive高分辨质谱仪(美国Coring公司);细胞培养箱(美国Thermo公司);CKX31型倒置显微镜(Olympus公司);SpectraMAX Plus384酶标仪(美国Molecular Devices公司)。
2.2 实验试剂
1-环丙基-6,7-二氟代-8-甲氧基-1,4-二氢代-4-氧代喹啉基-3-羧酸、硼酸、2-甲基哌嗪、醋酸铜、氯甲酸乙酯、盐酸羟胺、硫酸铜、L-抗坏血酸钠、加替沙星、炔丙基溴、炔丙胺、TBTU、DIPEA、NaN3等试剂均购自国药集团化学试剂或百灵威科技有限公司(质量分数≥95%); HepG2、DU-145、MDA-MB-231、MCF-7细胞株购自武汉大学细胞典藏中心,MCF-10a细胞株购自中科院上海细胞典藏中心。
2.3 化学实验步骤
2.3.1 1-环丙基-6,7-二氟代-8-甲氧基-1,4-二氢代-4-氧代喹啉-3-羧酸-O3,O4-二乙酸根合硼(4)的合成
在150mL的单口瓶中加入H3BO3(5.031g,81.2mmol)和Ac2O(40mL),升温至120℃,反应2h后冷却至70℃,加入化合物3(5.993g,20.3mmol),升温至120℃,继续反应7h,将反应液冷却至室温,倾入150mL冰水中,用CH2Cl2(3×60mL)萃取,有机层用无水Na2SO4干燥,脱除溶剂,粗产品用乙醇重结晶得到8.421g白色固体,产率为97.8%,m.p.114~116℃(文献值[23]:112~117℃)。1H NMR(400MHz,CDCl3):δ 9.19(s,1H),8.06(d,J=13.2Hz,1H),4.02~4.07(m,1H),3.79(s,3H,-OMe),2.01(s,6H,-OCOCH3),1.26~1.30(m,2H),1.18(t,J=6.4Hz,2H)。
2.3.2 1-环丙基-6-氟-7-(3-甲基-1-哌嗪基)-8-甲氧基-1,4-二氢-4-氧代喹啉-3-羧酸-O3,O4-二乙酸根合硼(5)的合成
将化合物4(6.786g,16.0mmol)、2-甲基哌嗪(2.404g,24.0mmol)和Et3N(4.6mL)溶解到乙腈(30mL)中,室温反应12h,脱除溶剂,经柱色谱纯化(石油醚/乙酸乙酯=1:1,V/V)得到7.326g白色粉末,产率为90.8%,m.p.177~179℃。1H NMR(400MHz,CDCl3):δ 9.17(s,1H),8.04(d,J=13.6Hz,1H),3.97~4.06(m,1H),3.76(s,3H,-OMe),3.37~3.43(m,3H),3.06~3.13(m,3H),3.01(d,J=6.4Hz,1H),1.98(s,6H,-OCOCH3),1.21~1.29(m,5H),1.15(t,J=6.8Hz,2H)。
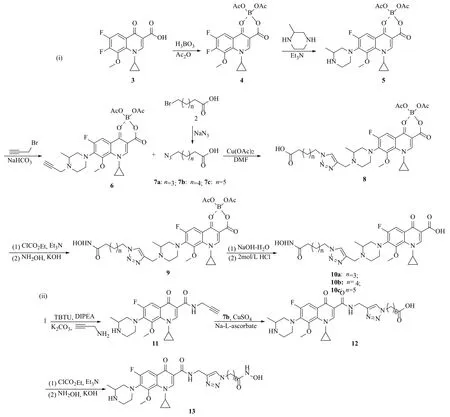
图3 加替沙星-组蛋白乙酰酶抑制剂缀合物的合成路线Fig.3 Synthetic route of gatif l oxacin-HDACi conjugates
2.3.3 1-环丙基-6-氟-7-(3-甲基-4-N-丙炔基-1-哌嗪基)-8-甲氧基-1,4-二氢-4-氧代喹啉-3-羧酸-O3,O4-二乙酸根合硼(6)的合成
氩气保护下,将化合物5(5.863g,11.6mmol)、炔丙基溴(2.760g,23.2mmol)和碳酸氢钠(1.949g,23.2mmol)用无水N,N-二甲基甲酰胺(30mL)溶解,在100℃下反应48h,脱溶后粗产物用硅胶柱纯化得到化合物6。白色固体,3.907g(62.1%),m.p.182~185℃;1H NMR(CDCl3,400MHz):δ9.18(s,1H),8.05(d,J=13.2Hz,1H),4.57(t,J=2.4Hz,1H),3.95~4.03(m,1H),3.74(s,3H,-OMe),3.32~3.41(m,3H),3.03~3.14(m,4H),2.42(t,J=2.8Hz,1H),1.24~1.31(m,5H),1.99(s,6H,-OCOCH3),1.17(t,J=7.2Hz,2H)。
2.3.4 叠氮烷基酸(7)的合成
按照文献报道的方法[24],以溴代烷基酸2和NaN3为原料制得叠氮烷基酸7。其中:5-叠氮戊酸(7a),白色油状物,产率91.7%;1H NMR(CDCl3,400MHz):δ 3.35(t,J=6.4Hz,2H),2.46(t,J=6.8Hz,2H),1.71~1.86(m,2H),1.45~1.57(m,2H)。
6-叠氮己酸(7b),白色油状物,产率86.4%;1H NMR(CDCl3,400MHz):δ 3.32~3.39(m,2H),2.42(t,J=7.2Hz,2H),1.72~1.89(m,2H),1.52~1.66(m,2H),1.33~1.44(m,2H)。
7-叠氮庚酸(7c),白色油状物,产率90.3%;1H NMR(CDCl3,400MHz):δ 3.31(t,J=6.8Hz,2H),2.44(t,J=6.4Hz,2H),1.73~1.90(m,2H),1.58~1.69(m,2H),1.36~1.55(m,4H)。
2.3.5 羧酸类缀合物(8)的合成
氩气保护下,将化合物6(1.302g,2.4mmol)、叠氮烷基酸7(3.6mmol)和醋酸铜(0.145g,0.8mmol)溶解到DMF(10mL)中,室温下搅拌反应48h后加入冰水(20mL),用CH2Cl2(3×25mL)萃取,脱溶后粗产物用硅胶柱纯化即得相应的羧酸类缀合物8。其中:
8a(n=5),白色粉末物,产率64.9%;1H NMR(400MHz,Acetone-d6):δ 9.14(s,1H),8.02(d,J=13.6Hz,1H),7.71(t,J=4.4Hz,1H),4.49(t,J=7.2Hz,2H),3.96~4.03(m,1H),3.94(s,2H),3.78(s,3H,-OMe),3.32~3.39(m,3H),3.02~3.13(m,4H),2.43(t,J=6.8Hz,2H),2.06(s,6H,-OCOCH3),1.65~1.73(m,2H),1.62(t,J=6.8Hz,2H),1.21~1.39(m,9H),1.18(t,J=6.4Hz,2H)。
8b(n=6),白色粉末物,产率69.2%;1H NMR(400MHz,Acetone-d6):δ 9.17(s,1H),8.04(d,J=13.2Hz,1H),7.71(t,J=4.4Hz,1H),4.36(t,J=6.8Hz,2H),3.94~4.05(m,3H),3.76(s,3H,-OMe),3.31~3.38(m,3H),3.10(t,J=6.4Hz,1H),3.08(t,J=6.0Hz,2H),3.02(d,J=6.8Hz,1H),2.42~2.46(m,2H),2.07(s,6H,-OCOCH3),1.98(t,J=7.2Hz,2H),1.51~1.59(m,2H),1.23~1.38(m,9H),1.11~1.17(m,2H)。
8c(n=7),白色粉末物,产率68.9%;1H NMR(400MHz,Acetone-d6):δ 9.11(s,1H),8.07(d,J=13.6Hz,1H),7.75(t,J=4.8Hz,1H),4.43(t,J=6.8Hz,2H),4.01~4.07(m,1H),3.93(s,2H),3.77(s,3H,-OMe),3.31~3.39(m,3H),3.01~3.11(m,4H),2.42~2.48(m,2H),2.05(s,6H,-OCOCH3),1.99(t,J=6.8Hz,2H),1.56~1.64(m,2H),1.24~1.39(m,11H),1.14(t,J=6.4Hz,2H)。
2.3.6 C-7加替沙星-HDACi缀合物(10)的合成
按照文献报道的方法[18],以羧酸类缀合物8(1.1mmol)和氯甲酸乙酯(184mg,1.7mmol)为原料,在三乙胺(121mg,1.2mmol)的催化制得肟酸类缀合物10。
1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-(4-(N-羟基-6-(4-亚甲基-1,2,3-三氮唑基))-己酰胺)-3-甲基-1-哌嗪基)-4-氧代-3-喹啉羧酸(10a,n=5),白色粉末物,产率73.4%;1H NMR(400MHz,Acetone-d6):δ 9.74(s,1H),8.49(s,1H),8.09(d,J=13.2Hz,1H),7.67(t,J=4.4Hz,1H),4.46(t,J=6.8Hz,2H),3.92(s,2H),3.71~3.79(m,4H),3.31~3.37(m,3H),3.06(t,J=6.4Hz,1H),2.93~2.99(m,2H),2.89(d,J=6.0Hz,1H),2.42(t,J=6.8Hz,2H),1.68~1.74(m,2H),1.65(t,J=6.4Hz,2H),1.34(t,J=6.8Hz,2H),1.24~1.31(m,7H),1.14(t,J=6.8Hz,2H);13C NMR(100MHz,Acetone-d6):δ 175.7(d,4JC-F=2.0Hz),173.2,171.8,155.4(d,1JC-F=252.6Hz),144.7(d,3JC-F=6.8Hz),141.9,144.1,131.3(d,2JC-F=24.5Hz),124.9(d,4JC-F=1.8Hz),124.4,123.6(d,3JC-F=8.4Hz),109.7,105.6(d,2JC-F=24.2Hz),63.3,57.2,55.9,54.8,51.9,51.2,50.5,41.2,30.7,29.7,28.8,25.2,15.8,9.0,8.9;HRMS(ESI)calcd for C28H37FN7O6[M+H]+,586.6351;found 586.6355。
1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-(4-(N-羟基-7-(4-亚甲基-1,2,3-三氮唑基))-庚酰胺)-3-甲基-1-哌嗪基)-4-氧代-3-喹啉羧酸(10b,n=6),白色粉末物,产率72.8%;1H NMR(400MHz,Acetone-d6):δ 9.71(s,1H),8.47(s,1H),8.01(d,J=13.6Hz,1H),7.68(t,J=4.0Hz,1H),4.34(t,J=6.4Hz,2H),3.78(s,3H,-OMe),3.71~3.76(m,1H),3.95(s,2H),3.31~3.39(m,3H),3.11(t,J=6.8Hz,1H),2.98(t,J=6.4Hz,2H),2.92(d,J=6.4Hz,1H),2.41~2.46(m,2H),1.96(t,J=6.8Hz,2H),1.21~1.37(m,9H),1.52~1.59(m,2H),1.16(t,J=6.4Hz,2H);13C NMR(100MHz,Acetone-d6):δ 175.1(d,4JC-F=2.4Hz),174.5,172.2,155.7(d,1JC-F=253.4Hz),145.3(d,3JC-F=6.4Hz),144.5,130.8(d,2JC-F=24.8Hz),141.3,125.1(d,4JC-F=1.7Hz),124.2,123.1(d,3JC-F=8.0Hz),109.2,106.2(d,2JC-F=24.0Hz),63.8,57.6,56.2,54.5,52.4,51.6,50.9,41.8,33.9,31.5,31.2,26.1,20.7,15.3,9.2,8.9;HRMS(ESI)calcd for C29H39FN7O6[M+H]+,600.6617;found 600.6619。
1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-(4-(N-羟基-8-(4-亚甲基-1,2,3-三氮唑基))-辛酰胺)-3-甲基-1-哌嗪基)-4-氧代-3-喹啉羧酸(10c,n=7),白色粉末物,产率77.1%;1H NMR(400MHz,Acetone-d6):δ 9.75(s,1H),8.52(s,1H),8.05(d,J=13.2Hz,1H),7.67(t,J=4.4Hz,1H),4.32(t,J=6.4Hz,2H),3.94(s,2H),3.78(s,3H,-OMe),3.70~3.76(m,1H),3.32~3.39(m,3H),3.04(t,J=6.4Hz,1H),2.92~2.98(m,3H),2.40~2.46(m,2H),1.94(t,J=6.8Hz,2H),1.55~1.62(m,2H),1.35(t,J=6.4Hz,2H),1.23~1.37(m,9H),1.18(t,J=6.4Hz,2H);13C NMR(100MHz,Acetone-d6):δ 174.9(d,4JC-F=2.2Hz),173.8,172.9,155.3(d,1JC-F=252.7Hz),144.9(d,3JC-F=6.0Hz),144.2,141.1,131.2(d,2JC-F=24.2Hz),125.7(d,4JC-F=2.8Hz),124.8,123.6(d,3JC-F=10.2Hz),109.5,106.7(d,2JC-F=24.3Hz),64.2,57.3,56.7,55.2,52.4,51.8,51.1,41.5,33.2,31.5,31.4,26.1,20.6,9.8,9.3,16.1;HRMS(ESI)calcd for C30H41FN7O6[M+H]+,614.6882;found 614.6887。
2.3.7 加替沙星乙炔酰胺(11)的合成
按照文献报道的方法化合物11[24],产率88.9%;1H NMR(CDCl3,400MHz):δ 8.85(s,1H),7.98(d,J=13.6Hz,1H),6.15(t,J=4.8Hz,2H),4.01~4.05(m,1H),3.77(s,3H,-OMe),3.32~3.41(m,3H),3.18(t,J=6.4Hz,1H),3.01~3.12(m,3H),2.19(t,J=2.4Hz,1H),1.27~1.35(m,2H),1.25(d,J=6.8Hz,3H,-Me),1.16(t,J=6.8Hz,2H)。
2.3.8 羧酸类加替沙星-HDACi(12)的合成
按照文献报道的方法[24],以化合物11和叠氮烷基酸7b为原料,在硫酸铜和L-抗坏血酸钠的催化下制得12。白色固体,729 mg(69.4%);1H NMR(CDCl3,400MHz):δ 8.65(s,1H),7.83(d,J=13.6Hz,1H),6.64(t,J=4.4Hz,1H),5.56(t,J=15.6Hz,2H),4.38(t,J=6.8Hz,2H),3.78(s,3H,-OMe),3.65~3.72(m,1H),3.30~3.37(m,3H),3.02~3.12(m,3H),2.95(d,J=6.8Hz,1H),2.39~2.46(m,2H),1.92(t,J=6.4Hz,2H),1.52~1.59(m,2H),1.22~1.37(m,9H),1.16(t,J=6.8Hz,2H)。
2.3.9 1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-(3-甲基-1-哌嗪基)-4-氧代-3-喹啉-3-((N-羟基-7-(1,2,3-三氮唑基))-庚酰胺基)甲酰胺(13)的合成
按照肟酸9的制备方法制得缀合物13,产率80.6%;1H NMR(CDCl3,400MHz):δ 9.67(s,1H),8.89(s,1H),8.61(s,1H),7.86(d,J=13.2Hz,1H),6.62(t,J=4.4Hz,1H),5.51(t,J=15.2Hz,2H),4.34(t,J=6.4Hz,2H),3.74(s,3H,-OMe),3.68~3.74(m,1H),3.31~3.39(m,3H),3.14(t,J=6.4Hz,1H),2.98(t,J=6.4Hz,2H),2.92(d,J=6.4Hz,1H),2.41~2.46(m,2H),1.99(t,J=6.8Hz,2H),1.49~1.55(m,2H),1.22~1.35(m,9H),1.18(t,J=6.4Hz,2H);13C NMR(100MHz,Acetone-d6):δ176.7(d,4JC-F=2.8Hz),174.2,171.1,122.5(d,3JC-F=8.4Hz),154.2(d,1JC-F=253.1Hz),146.7,144.1(d,3JC-F=7.8Hz),138.8 134.2(d,2JC-F=22.8Hz),124.8(d,4JC-F=2.2Hz),122.1,107.9,106.1(d,2JC-F=22.4Hz),63.3,53.4,52.4,51.4,47.0,45.6,43.5,40.9,32.5,31.9,30.4,28.2,25.6,15.5,9.1,8.9;HRMS(ESI)calcd for C29H40FN8O5[M+H]+,599.6769;found 599.6773。
2.4 HDACs抑制活性实验
使用HDAC试剂盒测试合成的目标化合物对HDAC1、2、6的抑制活性,以SAHA(N-羟基-N'-苯基-辛二酰胺)为阳性对照药[7]。根据文献报道的方法以及试剂盒说明书进行操作[25],测定出每孔的荧光值,并计算出IC50,见表1。
2.5 微管蛋白聚合抑制实验
使用Tubulin Polymerization Assay Kit测试加替沙星-HDACi缀合物抑制微管蛋白聚合的活性,将秋水仙碱(colchine)作为阳性对照。根据文献报道的方法和试剂盒说明书进行操作[24],最后在酶标仪下测定荧光值(图4),并计算出IC50,见图5。
2.6 体外抗增殖活性测试
选择肝癌HepG2、前列腺癌PC-3和DU145细胞、乳腺癌MDA-MB-231、MCF-7这5种肿瘤细胞,应用MTT法对合成的缀合物进行体外抗肿瘤活性测试[26],并计算出IC50,见表2。
3 结果与讨论
3.1 合成部分
加替沙星乙炔化合物6是通过亲核取代反应制备的,为了减少溴代丙炔与加替沙星C-3位羧酸也发生取代反应,在合成目标化合物时通过用硼酸乙酯将加替沙星的羧酸制成螯合物以减少副反应的发生。
在合成加替沙星乙炔酰胺11是通过酰胺化反应制备,我们采用了TBTU和DIPEA做为活化剂将加替沙星的羧基进行活化,制成相应的加替沙星苯并三唑活性酯后,再与炔丙胺反应制得加替沙星乙炔酰胺11,这样提高了反应的选择性和中间体11的产率。
3.2 HDACs抑制活性
表1 目标缀合物抑制HDAC1,HDAC2和 HDAC6的IC50值(±s,n=3)Tab.1 IC50 values of conjugates for inhibition of HDAC1,HDAC2 and HDAC6(±s,n=3)

表1 目标缀合物抑制HDAC1,HDAC2和 HDAC6的IC50值(±s,n=3)Tab.1 IC50 values of conjugates for inhibition of HDAC1,HDAC2 and HDAC6(±s,n=3)
注:SAHA为N-羟基-N'-苯基-辛二酰胺
Compd.IC50/(mmol/L)Selectivity ratio HDAC1 HDAC2 HDAC6 HDAC1/6 HDAC2/6 10a 0.056±0.053 0.105±0.057 0.046±0.023 1.2 2.3 10b 0.032±0.018 0.078±0.014 0.021±0.007 1.5 3.7 10c 0.040±0.014 0.082±0.022 0.032±0.025 1.3 2.6 13 0.037±0.016 0.099±0.017 0.024±0.007 1.5 4.1 SAHA 0.044±0.007 0.016±0.008 0.039±0.004 1.1 0.4
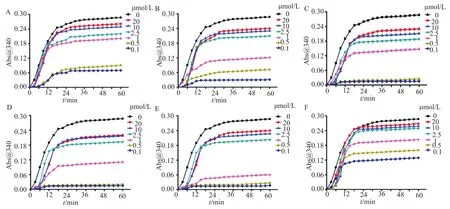
图4 微管蛋白在不同浓度缀合物10a(A)、10b(B)、10c(C)、13(D)、阳性药物秋水仙碱(E)以及加替沙星(F)作用下的聚合-时间变化曲线Fig.4 Tubulin polymerization time-course plots following changes in A340 of reaction in the presence of increasing concentrations of 10a(A),10b(B),10c(C),13(D),colchine(E)and(F)
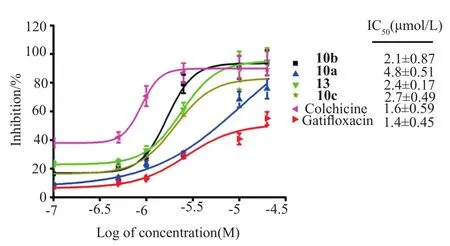
图5 量效曲线计算缀合物的抑制微管蛋白聚合的IC50值Fig.5 Dose-response curves and derived IC50 value for 10a~c,13,colchicine and gatif l oxacin(AM-1155)in the tubulin polymerization assay
从表1中目标缀合物对HDACs的抑制结果可以发现,将加HDACi单元拼接在加替沙星C-7位的侧链上得到的缀合物10a~c对HDAC1、HDAC2和HDAC6均有较强的抑制活性,并对HDAC6的抑制活性强于HDAC1和HDAC2。但是,缀合物中SAHA单元的长度酶抑制活性影响较大,以6个亚甲基(n=6)的缀合物10b活性最佳,其抗HDACs活性与SAHA类似物单元拼接在加替沙星C-3位羧酸上的缀合物13相仿。但是,将缀合物10b疏水连接链长度进行缩短(10a,n=5)或延长(10a,n=7)均减弱HDACs的抑制活性。结果说明目标缀合物对HDACs有较强的靶向性,对HDAC6有选择性,其中SAHA类似物单元在加替沙星上C-3或C-7对HDACs抑制活性影响并不大。这可能是由于发挥抗HDACs活性主要来源于SAHA类似物单元,只要缀合物中含有SAHA类似物单元,均会发挥较强的HDACs抑制活性。
表2 目标化合物对肿瘤细胞株的抗增殖活性(±s,n=3)Tab.2 Whole cell antiproliferative activity of target compounds(±s,n=3)
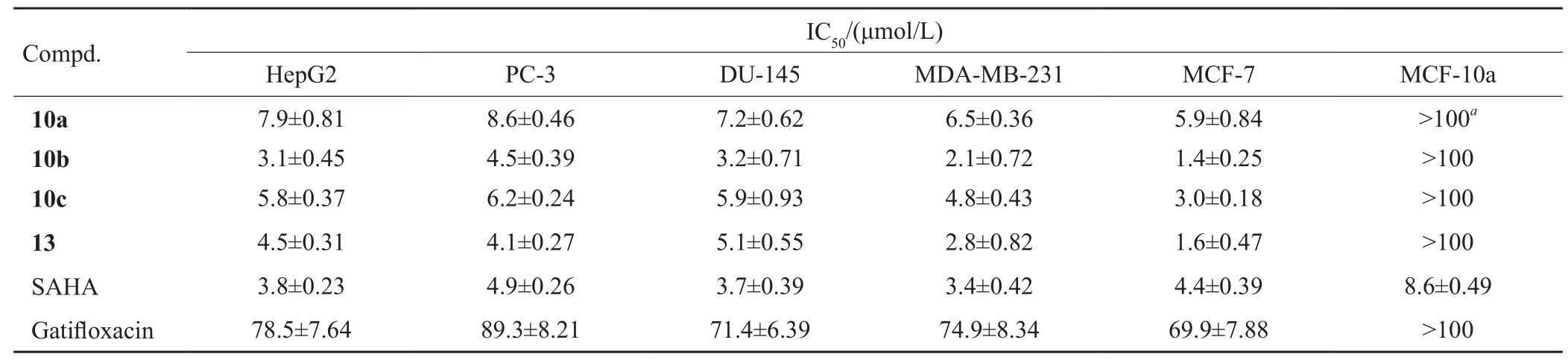
表2 目标化合物对肿瘤细胞株的抗增殖活性(±s,n=3)Tab.2 Whole cell antiproliferative activity of target compounds(±s,n=3)
注:aIC50 not determinable up to highest concentrations tested
Compd.IC50/(μmol/L)HepG2 PC-3 9±0.81 8.6±0.46 1±0.45 4.5±0.39 8±0.37 6.2±0.24 DU-145 MDA-MB-231 MCF-7 MCF-10a 10a 7.7.2±0.62 6.5±0.36 5.9±0.84 >100a 10b 3.3.2±0.71 2.1±0.72 1.4±0.25 >100 10c 5.5.9±0.93 4.8±0.43 3.0±0.18 >100 13 4.5±0.31 4.1±0.27 5.1±0.55 2.8±0.82 1.6±0.47 >100 SAHA 3.8±0.23 4.9±0.26 3.7±0.39 3.4±0.42 4.4±0.39 8.6±0.49 Gatif l oxacin 78.5±7.64 89.3±8.21 71.4±6.39 74.9±8.34 69.9±7.88 >100
3.3 微管蛋白聚合抑制活性
目标缀合物对微管蛋白抑制活性的结果见图4~5。由图4~5可见合成的4个缀合物均能显著地抑制微管蛋白的聚合,其IC50值甚至与秋水仙碱相当。这些结果表明所合成缀合物对微管蛋白也具有靶向性。此外,通过研究这些化合物的构效关系发现其结构中的SAHA单元拼接在加替沙星位置对微管蛋白聚合影响较少,而SAHA单元中链长却对抑制微管蛋白聚合影响较大,以6个亚甲基[10b,IC50=(2.1±0.87)mol/L]连接的活性最佳。
3.5 体外抗肿瘤活性
体外抗肿瘤的测试结果(表2)表明,4个缀合物对HepG2、PC-3、DU145、MDA-MB-231、 MCF-7均展现出了较强的抑制活性,并强于加替沙星(IC50>69mol/L);此外,在5种肿瘤细胞中,缀合物对MCF-7表现出了更强的抑制活性,其中化合物10b~c和13对MCF-7的抑制活性强于阳性药物SAHA。这些结果表明,将SAHA单元引入到加替沙星中能增加其抗肿瘤活性。但是,SAHA类似物单元拼接在加替沙星位置对抗肿瘤活性影响并不大(缀合物10bvs13),而缀合物中SAHA类似物单元的疏水连接链长度却对抗肿瘤活性有较大的影响,也是以6个亚甲基[n=6,缀合物10b,IC50=(1.4±0.25)mol/L]连接的活性最佳,缩短[n=4,缀合物10a,IC50=(5.9±0.84)mol/L]或延长[n=7,缀合物10c,IC50=(3.0±0.18)mol/L]链长均降低抗肿瘤活性。
为了进一步评估缀合物的安全性,我们采用了MTT法测试了缀合物对正常的乳腺上皮细胞MCF-10a的毒性。表2的结果表明,所合成的缀合物毒性较低,但是阳性药物SAHA却表现出了一定的毒性。
综上所述,利用点击化学将SAHA类似物引入到加替沙星中能够提高母体药物的抗肿瘤活性,这对发展新型喹诺酮类抗肿瘤药物具有一定的指导意义。