刺梨多酚氧化酶的提取工艺及其抑制剂研究
俞露,穆波,吉升阳
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
刺梨(Rosa roxburghii Tratt)是蔷薇科蔷薇属落叶灌木,又名缫丝花、文先果、送春归,原产云贵高原[1]。刺梨是富含多种营养元素和高物质能量的植物,具有很高的医学价值,在抗衰老、抗肿瘤、抗动脉粥样硬化、对铅等有害金属排解作用、增加机体免疫力等方面都有很大的功效,在食药开发方向具有广阔前景[2]。目前对刺梨果实的研究仍主要集中在食药价值、产品开发及活性成分提取上,对鲜果贮藏保鲜的研究较少[3]。刺梨在加工贮藏过程中极易发生褐变,其产生的深色物质对果实的外观颜色、风味及其营养价值有极大影响,严重影响果实的商品价值,因此,探索如何防止果实的褐变至关重要。尽管国内外对鲜切果蔬褐变抑制的研究和报道很多,但有关刺梨酶促褐变方面的研究却未见报道。
多酚氧化酶 (polyphenol oxidase,PPO)是酶促褐变的关键酶,与果蔬加工制品的色泽、抗氧化能力密切相关[4]。本文通过研究刺梨中多酚氧化酶的活性,在确定最适提取工艺的基础上,进一步研究抗坏血酸、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、柠檬酸等抑制剂对刺梨PPO酶促反应的影响,以期为刺梨的加工与贮藏等过程中防止酶促褐变提供参考和理论依据。
1 材料与方法
1.1 材料
贵龙5 号刺梨鲜果:贵州省龙里县。
1.2 仪器与试剂
1.2.1 仪器
SynergyH 酶标仪:美国 BioTeK 公司;H1-16KR型高速冷冻离心机:湖南可成仪器设备有限公司;HH-6电热恒温水浴锅:金坛区西城新瑞仪器厂;奥豪斯ohaus ST3100pH 计:北京中创先锋科技有限公司;Eppendorf 移液枪:上海麦尚科学仪器公司;FA2004 精密天平:天津天马衡基仪器有限公司;DW-HL398S 超低温冷冻储存冰箱:上海始恒仪器设备有限公司。
1.2.2 主要试剂
磷酸氢二钠:天津市凯通化学试剂有限公司;一水合柠檬酸、抗坏血酸:国药集团化学试剂有限公司、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、邻苯二酚:天津市科密欧化学试剂有限公司。试剂均为分析纯。
1.3 试验方法
1.3.1 PPO 粗酶液的提取
将10 g 刺梨鲜果捣碎混匀后,准确称取0.3 g 混匀样品,于提前预冷的研钵内,加入3 mL 预冷的0.1 mol/L的磷酸氢二钠-柠檬酸的缓冲液,并加入0.8 g PVP,在冰水浴中研磨2 min 至匀浆,然后将匀浆全部转入离心管,放入冷冻离心机中,在4 ℃、12 000 r/min 件下离心30 min,收集上清液即为刺梨PPO 粗酶液,于4 ℃冰箱储存备用[5-6]。
1.3.2 多酚氧化酶酶活力测定
以邻苯二酚为底物,加入缓冲液和酶液后,用Biotek SynergyH 酶标仪检测反应液在410 nm 处的吸光度值(A 值),依据曲线最初的直线部分计算酶活力[7-9]。以在1 min 内引起吸光度变化0.01 为一个酶活力单位(U)。
1.3.3 单因素试验
1.3.3.1 底物浓度对PPO 活性的影响
取2 mL 浓度为0.1 mol/L 的磷酸氢二钠-柠檬酸缓冲液(pH 6.0)于5 mL 离心管中,分别加入0.25 mL PPO 粗酶提取液及 1 mL 浓度分别为 0.02、0.04、0.06、0.08、0.10、0.12、0.14 mol/L 的邻苯二酚溶液,30 ℃恒温水浴1 min 后,立即将离心管转入90 ℃沸水中终止反应,用酶标仪在410 nm 下测定其吸光度值。
1.3.3.2 反应温度对PPO 活性测定的影响
取2 mL 浓度为0.1 mol/L 的磷酸氢二钠-柠檬酸缓冲液(pH 6.0)于 5 mL 离心管中,分别加入 1.0 mL 浓度为0.12 mol/L 邻苯二酚溶液及0.25 mL PPO 粗酶提取液,不同温度(20、25、30、35、40、45、50、55、60 ℃)恒温水浴1 min 后,立即将离心管转入90 ℃沸水中终止反应[10],用酶标仪在410 nm 下测定其吸光度值。
1.3.3.3 缓冲液pH 值对PPO 活性的影响
取2 mL 不同pH 值的磷酸氢二钠-柠檬酸缓冲液(0.1 mol/L)于5 mL 离心管中,分别加入1.0 mL 浓度为0.12 mol/L 邻苯二酚溶液及0.25 mL PPO 粗酶提取液,30 ℃恒温水浴1 min 后,立即将离心管转入90 ℃沸水中终止反应[11],用酶标仪在410 nm 下测定其吸光度值。
1.3.4 正交试验设计
在单因素试验的基础上,以缓冲液pH 值、底物浓度、反应温度为考察因素,见表1,以刺梨PPO 活性为指标,选用正交表对刺梨PPO 测定工艺进行优化研究,每组试验重复3 次,探寻测定刺梨PPO 活性的最佳条件。
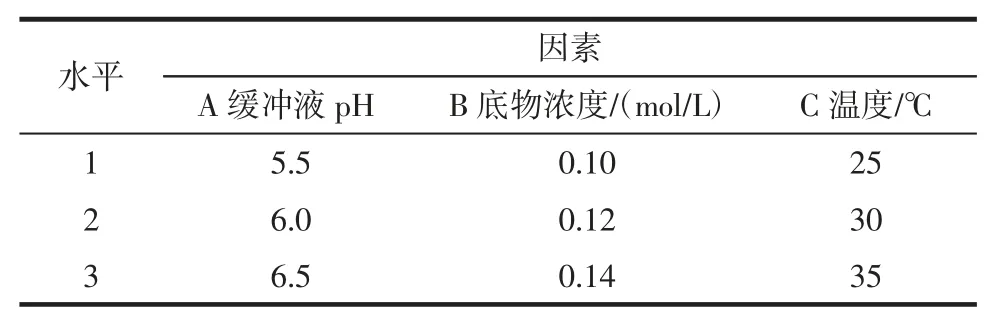
表1 正交试验因子及水平表Table 1 Factors and levels for orthogonal experiment
1.3.5 抑制剂对刺梨PPO 活性的影响
酶是蛋白质的一种,根据抑制剂与酶的作用方式以及抑制的是否可逆,将抑制作用分为不可逆抑制和可逆抑制[11]。常用的可逆抑制剂有柠檬酸、抗坏血酸、苹果酸及其它有机酸混合溶液[12-13],不可逆抑制剂有半胱氨酸、EDTA-2Na 等[14]。根据相关文献[15],本文选取柠檬酸、抗坏血酸、EDTA-2Na 作为刺梨PPO 的酶活抑制剂。
分别取 0.5 mL 配制的浓度为 0.2、0.4、0.6、0.8、1.0 mg/mL 的抗坏血酸、EDTA-2Na、柠檬酸溶液于5 mL离心管中,加入2 mL 浓度为0.1 mol/L 磷酸氢二钠-柠檬酸缓冲液(pH 6.0),然后往每个离心管中分别加入1.0 mL 浓度为0.12 mol/L 的邻苯二酚溶液及0.25 mL PPO 粗酶液,30 ℃恒温水浴1 min 后,立即将离心管转入90 ℃沸水中终止反应,用酶标仪在410 nm 下测定其吸光度值,考察3 种不同抑制剂对刺梨PPO 活性的影响。
2 结果与分析
2.1 缓冲液pH值对PPO活性的影响
缓冲液pH 值对PPO 活性的影响见图1。

图1 缓冲液pH 值对PPO 活性的影响Fig.1 Effect of the buffer pH value on PPO activity
文献报道,不同果蔬品种最适pH 值也不同,砀山酥梨 PPO 的最适 pH 值为 4.5[16],甘薯 PPO 最适 pH 值为4.4[17],无核白葡萄PPO 最适pH 值为5.7[18]。由图1可知,刺梨PPO 活性对缓冲液pH 值的变化较为敏感,其活性随缓冲液pH 值的变化总体呈先上升后下降的趋势,当pH 值从4.0 增加到6.0 时,PPO 活性呈明显上升趋势,且pH 4.0 的PPO 相对活性仅是pH 6.0 时的21.92%;随后,当pH 值从6.0 增加到8.0 时,PPO活性呈逐渐下降趋势。可以看出,测定该刺梨PPO 活性的最适pH 值为6.0。
2.2 底物浓度对PPO活性的影响
底物浓度对PPO 活性的影响见图2。

图2 底物浓度对PPO 活性的影响Fig.2 Effect of the substrate concentration on PPO activity
由图2可知,当底物浓度邻苯二酚浓度小于0.12 mol/L 时,PPO 活性随底物浓度的增加而显著增强,酶活力与底物浓度之间近似呈线性关系,且底物浓度为0.02 mol/L 时PPO 活性仅是浓度为0.12 mol/L时PPO 活性的33.8%。当底物浓度浓度大于0.12 mol/L时,PPO 酶活性逐渐开始缓慢下降,因此,测定该刺梨PPO 活性的最适底物浓度为0.12 mol/L。
2.3 反应温度对PPO活性的影响
反应温度对PPO 活性的影响见图3。
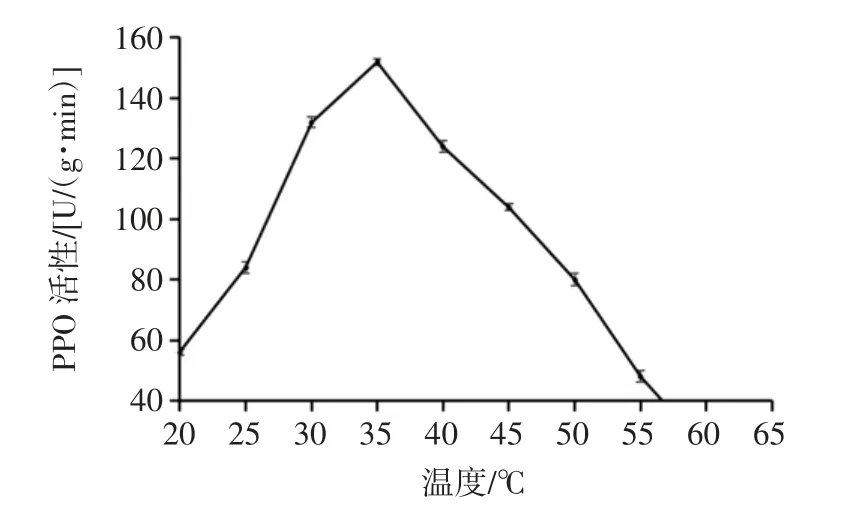
图3 温度对PPO 活性的影响Fig.3 Effect of the temperature on PPO activity
不同物种的PPO 酶促反应的最适温度也不相同,李桂琴等[19]在以邻苯二酚为底物时研究发现鸭梨果肉中多酚氧化酶的最适提取温度是25 ℃;Gisela 等[20]报道曼密苹果的多酚氧化酶最适提取温度为35 ℃,Waliszewski K N 等[21]研究发现香草豆中的PPO 最适反应温度是37 ℃。由图3可知,温度对刺梨鲜果PPO 活性有显著影响,从整个曲线来看,当温度在20 ℃~35 ℃时,PPO 活性呈明显上升趋势,且35 ℃时活性最高。但当温度大于35 ℃以上时,PPO 活性开始迅速下降,当温度升高到60 ℃时,PPO 基本失活。因此,测定该刺梨PPO 活性的最适温度为35 ℃。
2.4 正交试验
在单因素试验结果的基础上,以刺梨PPO 活性为考核指标,进行三因素三水平的正交试验,各试验组合测定3 次,取其平均值,对刺梨PPO 提取工艺条件参数进行优化,其试验结果见表2。
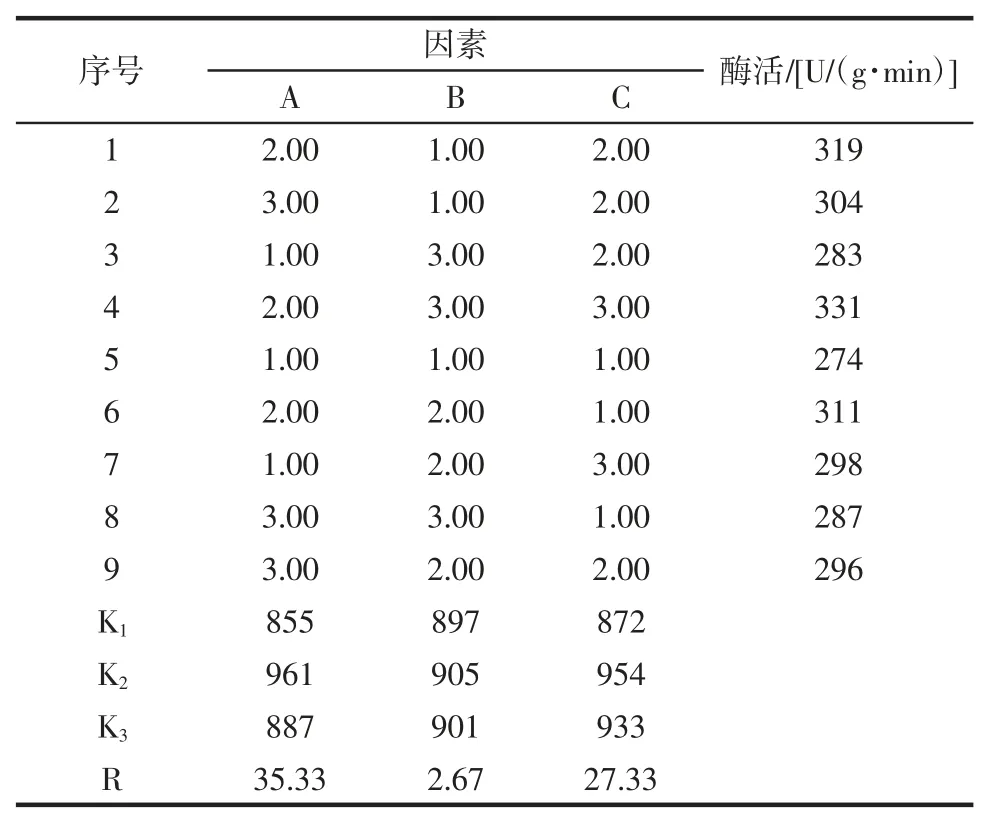
表2 正交试验结果分析Table 2 Analysis of orthogonal test results
由表2可知,经过极差比较分析可知,极差值R越大,说明该因素对刺梨PPO 提取工艺的影响越大,各因素对刺梨PPO 提取工艺条件影响作用的主次关系为A>C>B,即缓冲液pH 值>温度>底物浓度。在试验设计的水平范围内,优化得到刺梨PPO 提取工艺最佳条件为A2B2C2即刺梨PPO 提取工艺最佳条件缓冲液pH 值为6.0、温度为30 ℃、底物浓度为0.12 mol/L。
2.5 方差分析
方差分析见表3。

表3 方差分析Table 3 Analysis of variance
由表3方差分析结果显示,缓冲液pH 值(A)、底物浓度(B)无显著性差异(P>0.05),温度(C)有显著性差异(P<0.05)。R2=0.989,R2adj=0.955.
为了验证正交试验的可靠性,采用得到的最佳提取工艺条件进行刺梨PPO 提取的验证试验。以缓冲液pH 值为6.0,提取温度为30 ℃,底物浓度为0.12 mol/L 为最佳。3 次平行试验得到的PPO 平均活性为342.67 U/(g·min)与理论值相差2.34 U/(g·min)。因此通过正交试验优化得到的刺梨PPO 提取工艺条件是可行的。
2.6 抑制剂对刺梨PPO活性的影响
抑制剂对刺梨PPO 活性的影响见图4。

图4 常用抑制剂对刺梨PPO 酶活力的影响Fig.4 Effect of the different inhibitors on PPO activity
由图4可以看出,刺梨PPO 活性均随各抑制剂浓度的增大而减少,说明抗坏血酸、EDTA-2Na 及柠檬酸对抑制刺梨PPO 的褐变作用与抑制剂浓度呈一定的剂量效应关系。同时,抑制剂对刺梨PPO 酶促褐变抑制的强弱顺序为:抗坏血酸>柠檬酸>EDTA-2Na,其中抗坏血酸对刺梨PPO 酶促褐变的抑制效果最佳。
3 结论与讨论
本文通过正交试验对刺梨PPO 的提取工艺进行了优化,试验研究表明,对刺梨中多酚氧化提取的主要影响因素作用的主次关系为:缓冲液pH 值>温度>底物浓度。刺梨PPO 提取工艺最佳组合条件为A2B2C2即缓冲液pH 为6.0、水浴温度30 ℃、底物浓度为0.12 mol/L。由于pH 值和温度对PPO 活性有较大影响,在实践中可以利用调节pH 值和高温(热烫)钝化酶活,从而减少褐变的发生。
试验结果表明,抗坏血酸、EDTA-2Na 和柠檬酸均能有效抑制刺梨果实PPO 活性,其中抗坏血酸抑制刺梨PPO 活性的效果最佳,当抗坏血酸浓度为1.0 mg/mL时,刺梨PPO 已基本丧失活性。不同抑制剂抑制机理不同[22],柠檬酸中含有的羧基很有可能与多酚氧化酶的酶活性中心部位以外其他亲和集团如氨基等结合,再进一步与底物结合形成酶抑制底物复合物,在酶的作用附近形成了空间位阻,从而阻止酶与底物的结合,从而降低酶的催化反应[23]。EDTA-2Na 与底物竞争性地与多酚氧化酶结合,并且抑制剂结合物不与底物发生催化反应,使酶与底物的结合的浓度下降,从而降低了酶的催化作用[15]。抗坏血酸是近年来食品工业中应用最多的褐变抑制剂,它在酶反应体系中的作用是相当复杂的。它既是还原剂可以还原醌类物质,而且还可以作为铜离子的螯合剂;通过-OH 与多酚氧化酶的辅基Cu2+螯和,也可以直接被多酚氧化酶氧化,起到竞争性抑制作用。同时抗坏血酸的添加量十分关键,添加量过少,不仅不能抑制褐变,反而易与氨基酸反应促进羰氨反应造成非酶褐变;添加量过多,成品在贮存期间,特别是在较高温度下,由于氧化后所形成的酮化合物与氨化合物发生非酶促褐变反应,从而加剧成品的变色[24]。目前,在果蔬防褐处理中,提倡多种抑制剂结合使用以提高抗褐变效果。因此,在对刺梨单因素抑制剂研究的基础上,因此还需在对刺梨抑制剂单因素研究的基础上,对不同抑制剂多种因素协同作用的抑制效应做更加深入的研究。以期更好地提高对刺梨PPO 活性的抑制效果。

