嗜热毛壳菌多糖单加氧酶的性质及协同作用研究
王美霞 惠金聚 陈宸 郭秀娜 李多川


摘要:多糖单加氧酶(polysaccharide monooxygenases,PMOs)可以氧化裂解纤维素,为纤维素酶提供更多的结合位点,对提高纤维素酶的活性具有重要意义。本研究旨在探索嗜热毛壳菌(Chaetomium thermophilum)AA9家族PM05456的氧化方式,以及与不同类型纤维素酶的协同作用。通过对PMO反应产物进行鉴定,确定PM05456具有CI、C4、C6位氧化。设置时间梯度,以PM05456预处理的磷酸膨胀纤维素(PASC)为底物,测定PM05456与嗜热毛壳菌三种纤维素酶EGl、CT2、CBHI的协同作用,结果显示随着PM05456预处理纤维素时间的增加,纤维素酶的活性随之增加。PM05456对三种纤维素酶EGI、CBHl、CT2的降解效率分别提高了3.6、2.2倍和60%。
关键词:嗜热毛壳菌;AA9家族;多糖单加氧酶;氧化方式;协同作用
Study on Properties and Synergistic Effects ofPolysaccharide Monopolygenase from Chaetomium thermophilumWang Meixia, Hui Jinju, Chen Chen, Guo Xiuna, Li Duochuan
Abstract
Polysaccharide monooxygenases ( PMOs) can oxidize cellulose to provide more binding sitesfor cellulase, which is important for improving cellulase activity. This study aimed to explore the oxidativemode of PM05456 0f the AA9 family from Chaetomium thermophilum and its synergistic effect with differenttypes of cellulases. By identifying the PMO reaction products, it was determined that PM05456 had oxidationat the Cl, C4 and C6 positions. The time gradient was set, and the synergistic effects of PM05456 and threecellulases, EGl, CT2 and CBHl, from Chaetomium thermophilum were determined by using PM05456 pre-treated with phosphoric acid - swollen cellulose (PASC) as the substrate. The results showed that with the in-crease of pretreatment time of PM05456, the cellulase activity increased. The degradation efficiencies ofPM05456 for the three cellulases, EGl , CBHl , and CT2 , increased by 3. 6, 2. 2 times and 60% , respectively.
Keywords Chaetomium thermophilum; AA9 family; Polysaccharide monooxygenase; Oxidation mode;Synergy
纖维素是植物细胞壁的主要成分,是地球上丰富的可再生能源[1],而木质纤维素生物质因其B-i,4糖苷键连接的线性多糖结构而难以被降解,这一特性是以纤维素作为二代生物燃料的生物技术产业面临的主要问题之一。能够降解纤维素的酶广泛存在于细菌和真菌中[2-4],然而自然状态下的结晶纤维素需要经过工业、物理或化学预处理才能被纤维素酶降解[5],处理后产生的多种结晶纤维素极易与细胞壁的其他成分相互作用,从而限制了酶与底物的结合,导致酶的降解效率低[6]因此,合理高效的预处理以增加糖苷水解酶与底物的结合是降解纤维素亟待解决的问题。
多糖单加氧酶是一种铜离子依赖酶[7],通过氧化断裂纤维素的糖苷键使纤维素结构更加松散,暴露出更利于纤维素酶结合的位点,利于纤维素酶与底物的结合,提高纤维素酶的活性[8-9]。在降解酶系中,一般认为有三类纤维素酶:内切纤维素酶(内切-1,4-B-葡聚糖酶,EGs,E.C.3.2.1.4),外切纤维素酶(纤维二糖水解酶,cello-biohydrolases,CBHs,E.C.3.2.1.91;糖水解酶,E.C.3.2.1. 74),B-葡萄糖苷酶(BGs,E.C.3.2.1.21)[10]。三种纤维素酶与PMO协同作用促进纤维素降解的进程。
PMO是一类氧化酶,能够氧化葡萄糖苷的C1、C4位和C6位[ll],但是具体家族成员的氧化区域的选择性差异仍有待探究。其中真菌中的多糖单加氧酶AA9( auxiliarv activity 9,AA9)家族受到较多关注[12-13],作用于纤维素的AA9家族是一类胞外酶,可以异源表达。来自嗜热真菌的酶比常温真菌的酶具有更高活性并且具有热稳定性,这一特性将更有利于在工业生产的应用。因此,本研究以嗜热毛壳菌为研究对象,以期为嗜热毛壳菌AA9家族多糖单加氧酶的生产应用提供参考。
1 材料与方法
1.1 试验材料
1. 1.1 菌株与载体 嗜热毛壳菌(Chaetomiumthermophilum)CGMCC3. 17990菌株由本实验室保存;大肠杆菌(Escherichia coli)感受态细胞T1购自北京全式金生物技术有限公司;毕赤酵母(Pichia pastoris)GS115、pPICZαA表达载体购自Invitrogen(美国)公司。
1.1.2PM05456与三种水解酶信息 多糖单加氧酶PM05456与三种纤维素水解酶EG1、CT2 [14]、CBHl [15]相关信息见表1。
1.1.3试验试剂试验所用试剂见表2。
1.2 试验方法
1.2.1 基因克隆 以微晶纤维素诱导培养基培养嗜热毛壳菌3—5d,采用RNA提取试剂盒提取RNA并反转录成cDNA,以cDNA为模板、PM05456 - cF和PM05456 - cR为引物(表3)进行PCR扩增。PCR反应体系:cDNA 2μL,上下游弓I物各2 μL,5×TransStart⑥FastPfu Buffer 10 μL,dNIPs(2.5 mmol/L)5VL,TransStart⑥FastPfu DNAPolymerase lμL,ddH20 28μL。PCR反应程序:950C 1 min;950C 20 s,55C 20 s,720C 40 s,共35个循环;72℃ 5 min,4℃保存。引物设计首先去除PM05456序列的信号肽,然后参照pPICZaA质粒酶切位点和序列进行设计,其中引入Xho I和XbaI两个酶切位点,并添加一个胞嘧啶核苷酸(下划虚线)以保证下游组氨酸标签顺利表达。
1.2.2 重组质粒的构建、鉴定及转化经胶回收的PM05456基因片段与经Xho I和Xba I酶切的pPICZαA质粒连接,构成重组质粒,将重组质粒转入T1感受态中,转化后的感受态细胞涂布在含博来霉素(Zeocin)的低盐LB平板上。经37C培养24 h后挑取生长状态良好的单菌落若干,以5-AOXI( 5- GACTGGTTCCAATTGACAAGC-3')和3- AOXl(5-GGCAAATGGCATTCTGA-CAT -3')作为引物进行PCR扩增,测序选取正确的转化子。PCR反应体系为:悬浮菌液3μL,上下游引物各1.5μL,2×Taq PCR MasterMix 25μL,ddH20 19μL。PCR扩增程序:94℃ 2 min;94℃ 30 s,55C 30 s,72℃30 s,共30个循环;72℃ 10 min,4qC保存。
1.2.3 工程菌的构建培养并提取转化子质粒,质粒经Sac I线性化后回收,经电击转入毕赤酵母感受态GS115中,涂布于含Zeocin的平板上,28℃培养3d,挑取生长良好的单菌落若干,试剂盒提取酵母基因组,以5- AOX1和3-AOX1作为引物进行PCR扩增,具体方法同1.2.2,测序选择正确的酵母转化子作为工程菌用于表达蛋白。
1.2.4 PM05456的表达、分离与纯化 挑取培养的工程菌菌落,无菌环境下接种于BMGY培养基中,24 h后菌体转入BMMY培养基,每12 h添加甲醇诱导表达,每100 mL BMMY加入1 mL甲醇,于28qC、200 r/min培养7d。经硫酸铵沉淀分离蛋白,采用镍柱亲和纯化获得PM05456蛋白。
1.2.5 PM05456可溶性酶解产物分析
(1)可溶性产物薄层色谱(TLC)分析:以1%磷酸膨胀纤维素( PASC)为底物,1 mL PASC中加入1 mL PM05456酶液,加入Vc至终浓度1mmol/L作为还原剂,在pH =5.0环境下50C水浴振荡反应48 h。离心取10 μL上清进行TLC分析,以标准纤维寡糖为参照初步分析产物成分。
(2)可溶性产物MALDI - TOF - MS鉴定:将上述48 h酶解产物离心,取上清20 μL,于北京软隆生物技术有限公司进行基质辅助激光解析电离飞行时间质谱( MALDI-TOF-MS)分析。
(3)产物溴水氧化:每一体积酶解产物上清液中加入三体积饱和溴水,于60C水浴反应30min,经氮吹仪吹干后回溶至产物原体积,进行MALDI-OF-MS鉴定。
1.2.6 协同作用 采用3,5-二硝基水杨酸比色法测定糖苷水解酶活力:1%的PASC加入等体积已纯化的多糖单加氧酶,500C水浴振荡反应,反应时间梯度设置为0、12、24、36、48、72、96 h,分别加入内切纤维素酶、外切纤维素酶和B -葡萄糖苷酶,对照组加入等体积PBS,50C反应20 min后沸水浴10 min终止反应。离心取上清加入等体积DNS,沸水煮10 min后测定OD540值,按照测定的标准曲线计算酶活。
2 结果与分析
2.1 PM05456基因克隆
PCR扩增目的基因如图1。测序结果与已知序列比对,相似性为99.69%。其中两个碱基发生同义突变,氨基酸序列未发生变化。将PCR扩增的PM05456基因片段连接pPICZαA质粒,构成重组质粒pPICZαA - PM05456。
2.2 酵母阳性转化子的筛选验证
对酵母阳性转化子基因组进行PCR扩增(图2),经测序比对,目的片段已成功转入酵母基因组,转化的酵母阳性转化子可用于表达目的蛋白。
2.3 表达纯化及SDS - PAGE分析
PM05456表达纯化后的蛋白经SDS - PAGE分析(图3),蛋白大小约28 kD,比PM05456序列分析的理论分子量(25 kD)略大,可能由于存在糖基化修饰。蛋白条带单一清晰,纯度较好,可用于后续试验。
2.4 产物分析
2.4.1 产物薄层色谱分析经纯化的PM05456降解PASC 48 h后离心取上清,TLC结果(图4)显示,PM05456对PASC具有降解活性。
2.4.2 可溶性产物MALDI-TOF-MS分析 為确定PM05456降解PASC的具体产物组成,对可溶性产物进行MALDI-TOF- MS分析。结果(图5)显示,PM05456降解PASC可溶性产物中含有多种非氧化型寡糖和氧化型寡糖,证明PM05456具有氧化活性,氧化方式是C1(m/z+16)、C4(m/z-2)或C6(m/z-2).
2.4.3 可溶性產物溴水氧化后飞行质谱分析基于MALDI - TOF - MS分析显示PM05456氧化方式是C1、C4或C6,为最终确定是C4还是C6氧化,将产物进行溴水氧化后进一步MALDI - 图5 PM05456酶解产物的MALDI-TOF-MS分析TOF-MS分析。对产物的作用方式最终为:对CI氧化寡糖(m/z+16)不再继续氧化,分子量不会发生改变;对C4氧化寡糖(m/z-2),溴水将其氧化为C1/C4寡糖,分子量增加14;对C4/C6氧化寡糖,经溴水氧化生成C1/C4/C6氧化寡糖,分子量增加28;对C6氧化寡糖(m/z-2),溴水将其氧化为C1/C6氧化寡糖,分子量增加30。溴水氧化后的MALDI-TOF- MS图(图6)显示,PM05456同时存在C1、C4和C6氧化。
2.5 协同作用分析
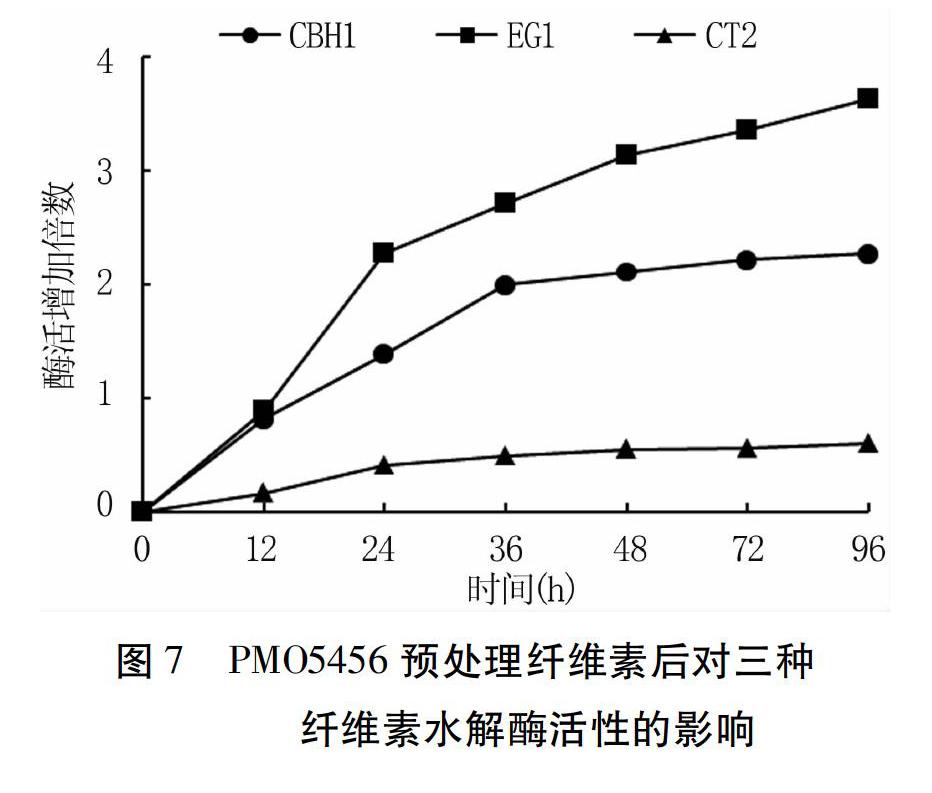
协同作用分析结果(图7)显示,PM05456对三种水解酶的活性提高存在明显差异,并且随着PM05456处理纤维素时间的增加,酶活提高的倍数也随之增加。在0~48b是迅速提高阶段,48h后趋于平缓。PM05456对内切纤维素酶的活性提高最明显,最终提高了3.6倍;外切纤维素酶次之,最终提高了2.2倍;而β-葡萄糖苷酶的酶活提高幅度较低,处理至96h,最终酶活提高了60%。
3 讨论与结论
本研究结果显示PM05456具有C1、C4、C6氧化位点,但三种氧化产物含量存在一定差异,C6氧化产物明显少于另外两种。已确定具有C6氧化的酶都需要较长时间产生C6产物,由此推测这种区域的选择性相互之间可能存在先后联系,因氧化发生的先后顺序而导致产物量的差异。本研究采用饱和溴水氧化产物的方法利用了溴水自身的特性,巧妙避免了带人其他金属离子和杂质,利用溴水的氧化性将产物氧化分析,后又利用溴水的易挥发性将残留的溴完全除去,极大地排除干扰,产物可以直接进行MALDI-TOF-MS分析。
PMO通过在纤维素C1或C4位置加氧引起羟基化作用,造成糖苷键断裂来降解纤维素,这种不同于一般纤维素酶的断键机制,可能更容易从高度结晶的纤维素上分离出葡聚糖链,并且为纤维素酶提供结合位点,从而达到提高纤维素酶解效率的目的。在应用中,降解纤维素是由混合酶系完成,一般认为由三种纤维素酶共同完成,第一步由内切-1,4-β-葡聚糖酶降解产生新的还原端和非还原端,为第二步外切-1,4 -β-葡聚糖酶提供更多的作用位点,最后由β -葡萄糖苷酶水解纤维二糖、海藻糖或龙胆二糖从而释放出葡萄糖[16-18]一三种纤维素水解酶与PM05456协同作用的结果显示内切纤维素酶的酶活提高最高,外切纤维素酶次之,β-葡萄糖苷酶活性影响最小,与混合酶系的反应顺序对应,由此可推测PM05456作用底物后主要提高了内切纤维素酶的结合位点,利于纤维素水解酶的结合,加速了对底物的降解。在工业应用中可利用PMO进行纤维素的预处理,对提高纤维素内切酶和外切酶的水解活性具有显著效果。
参考文献:[1]Ragauskas A J,Williams C K,Davison B H,et al.The pathfonvard for hiofuels and hiomaterials[J].Science. 2006, 311(5760):484 -489.
[2]Dimarogona M,Topakas E,Christakopoulos P. Recalcitrantpolysaccharide degradation hv novel oxidative bioc:atalysts[J].Applied Microbiology&Biotechnology, 2013. 97(19):8455-8465.
[3]Hom S J,Vaaje - Kolstad G,Westereng B,et al.Novel en一zvmes for the degradation of cellulose[J]. Biotechnology forBiofuels. 2012,5(1):45.
[4] Schwarz W.The t:ellulosome and cellulose degradation lly an-aerobic bacteria[J].Applied Microbiology&Biotechnology,2001,56( 5/6):634-649.
[5]MussattoS I,Dragone G,Guimaraes P M R,et al.Technolog-ical trends, glohal market. and challenges of hio - ethanol pro-duction[J].Biotechnology Advances, 2010. 28(6):817-830.
[6]Himmel M E,Ding S Y,Johnson D K,et al.Biomass recalci-trance: engineering plants and enzVmes for biofuels production[J]. Science, 2007, 315 (5813):804 - 807.
[7]Beeson W T,Phillips C M,Cate J H,et al.Oxidative cleav-age of cellulose by fungal copper - dependent polysaccharidemonooxygenases[J]. Joumal of the American Chemical Socie-ty, 2012, 134(2): 890-892.
[8]Aachmann F L,SOrlie M,Skjak-BrEek G,et al.NMR struc-ture of a lytic polysaccharide monooxygenase provides insightinto copper binding, protein dynamics, and suhstrate interac-tions [J] . Proceedings of the National Academy of Sciences ofthe United States of America. 2012, 109 (46) : 18779 -18784.
[9]Quinlan R J. S,N'eeney M D. Lo L L. et al. Insights imo theoxidative degradation of cellulose by a copper metalloenzymethat exploits biomass components[Jl. Proc. Natl. Acad. Sci.USA, 2011, 108 (37) : 15079 - 15084.
[10] Zhang Y H P, Hirumel M E. Mielenz J R. Outlook for cellu-lase iruprovement: screening and selection strategies [J] . Bio-technology Advances . 2006 . 24 (5) : 452 - 481.
[11] Chen C. Chen J, Ceng Z, et al. Regioselectivity of oxidationby a polysacc:haride monooxygenase from Chnetomium t.hfir-i7zophilUm [J] .Biotechnology for Biofuels. 2018. 11 (l) :155.
[12] Patel I, Kracher D, Ma S, et al. Salt - responsive ly fic poly-saccharide monooxygenases from the mangrove fungus Pestalot.i-op.sis sp. NCi6 [J] . Biotechnology for Biofuels, 2016 , 9(1) :108.
[13] Vu V V. Beeson W T,Phillips C M, et al. Determinants of re-gioselective hydroxvlation in the fungal polysaccharide monoox-ygenases[Jl. Journal of the American Chemical Society,2014. 136(2):562-565.
[14] Xu R, Teng F,Zhang C, et al. Cloning of a gene encodingp - glucosidase from Chaetomium thermophilum. CT2 and its ex-pression in Pichia pa.stori,[J].Joumal of Molecular Mit:robiol-ogy&Biotechnology, 2011, 20(1):16-23.
[15]楊志芹.嗜热真菌糖苷水解酶第七家族基因的克隆、表达及分子改造[D].泰安:山东农业大学,2018.
[16] Cota J,Correa T L,Damclsio A R. et al. Comparative analysisof three hyperthermophilic GHI and GH3 family members .vithindustrial potential[J].New Biotechnology, 2015, 32(1):13-20.
[17] Kostylev M,Wilson D.Synergistic interactions in cellulose hv-drolysis[J].Biofuels, 2012,3(1):61-70.
[18] Kinsella J E.Principles of enzvmology for the food sciences[J]. Journal of Dairy Science, 1973, 56(8):1110.

