果糖诱导斑马鱼肝脏脂肪变性的转录组学分析
陈博,张靖溥
果糖诱导斑马鱼肝脏脂肪变性的转录组学分析
陈博,张靖溥
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所药理室/卫生健康委员会抗生素重点实验室
非酒精性脂肪肝(NAFLD)的发病呈低龄化趋势,本研究旨在建立一种模拟低龄人群的高糖诱导的 NAFLD 模型,揭示其基因表达谱特征,为疾病的机制研究和药物筛选提供基础。
采用高果糖饮食诱导斑马鱼产生肝脏脂肪变性,油红 O 染色分析肝脏脂肪变性率,组织病理学方法观察肝脏脂质堆积,并分析肝脏生化指标变化。利用转录组测序观察基因表达谱变化,通过基因与基因组百科全书(KEGG)和基因本体(GO)数据库进行差异基因功能富集,分析其可能影响的信号通路与生物过程。
斑马鱼幼鱼高果糖喂养 10 d 后发生肝脏脂肪变性,肝脏切片 HE 染色和油红 O染色结果发现,果糖喂饲的幼鱼肝脏出现微小脂质空泡,呈大面积红色着色。肝脏甘油三酯、葡萄糖含量显著高于正常对照组。经转录组测序发现果糖喂饲的幼鱼肝脏表达谱发生明显改变,共发现 485 个差异表达基因(变化倍数 > 3,< 0.05)。差异基因 KEGG 分析表明,PPAR 信号通路为显著富集通路,real-time PCR 结果确认 PPAR 通路中 fads2、fabp7b、plin2、adipoqa 基因水平显著上调。下调基因的 GO 分析结果显示,病毒防御为显著富集的生物学过程。
建立了一种果糖诱导的斑马鱼 NAFLD 模型,可应用于斑马鱼幼体肝脏脂肪变性的机制研究和药物筛选。能量代谢相关基因表达的变化可为果糖致 NAFLD 的作用机制研究提供依据。
斑马鱼; 果糖; 非酒精性脂肪肝; 转录组测序
非酒精性脂肪肝(NAFLD)是慢性肝病的主要诱因之一[1]。越来越多的证据表明患有NAFLD 的青少年人群亚临床动脉粥样硬化风险呈上升趋势[2]。鉴于青少年 NAFLD 患病率的升高以及 NAFLD 和心血管疾病的密切相关性,通过改善饮食和生活习惯,同时开发有效的治疗手段是极为必要的。
日常饮食组成成分与 NAFLD 的发生发展密切相关[3]。高热量饮食消耗增加,特别是以果糖为甜味剂的大量使用(如碳酸饮料等)与青少年肥胖流行和 NAFLD 的发病率上升紧密相关[4]。然而目前多数 NAFLD 动物模型主要以模拟成人发病特征为主,而成人与儿童在营养代谢上存在较大差异,儿童期肥胖常常会持续到成年并发展为代谢综合征[5],因此建立一种适用于低龄人群的 NAFLD 动物模型具有重要意义。
在本研究中,我们通过果糖喂饲,诱导斑马鱼幼鱼发生肝脏脂肪变性,用以模拟幼体在果糖刺激下形成的 NAFLD,并通过转录组测序技术寻找关键分子靶标和信号通路,以期为低龄人群 NAFLD 的防治提供分子机制研究的基础。
1 材料与方法
1.1 材料
AP100 幼鱼饲料购自美国Zeigler Bros 公司;总胆固醇、甘油三酯、葡萄糖检测试剂盒购自北京普利莱科技有限公司;Trizol 试剂盒购自美国 Invitrogen 公司;SZX10 型显微镜购自日本Olympus公司;RM2255 型石蜡切片机和CM1950型冰冻切片机均购自德国Leica 公司;LightCycler 96 荧光实时定量 PCR 仪购自瑞士Roche公司。
1.2 方法
1.2.1 斑马鱼饲养 AB 系斑马鱼,饲养温度(28.5 ± 1)℃,14 h 光照/10 h 黑暗循环。斑马鱼胚胎培养至受精后5 d(5 dpf),给予不同饮食喂饲:对照组给予 30 mg/d AP100,果糖组给予 30 mg/d AP100 和 0.25%(w/v)果糖,从 5 dpf 继续培养至 10 dpf。所有斑马鱼在实验结束前禁食过夜。
1.2.2 斑马鱼整体油红 O 染色 参考文献[6]的方法,斑马鱼浸泡在 4% 多聚甲醛中固定过夜,PBS 清洗两次,60% 异丙醇含 0.3% 油红O 染色 1 h,PBS(含 0.1% 吐温 20)再次清洗 2 次,90% 甘油中保存,体式显微镜下观察拍照。
1.2.3 组织学分析 斑马鱼置于 4% 多聚甲醛中固定过夜,石蜡包埋,石蜡切片机4 μm 连续切片。切片经苏木素和伊红(HE)染色。用于冰冻切片的斑马鱼以 OCT 包埋,冰冻切片机8 μm 连续切片,0.5% 油红 O 染色,倒置显微镜观察拍照。
1.2.4 生化分析 分离斑马鱼幼鱼肝脏,肝脏总胆固醇、甘油三酯、葡萄糖含量依据检测试剂盒说明检测,并以组织蛋白含量为内对照。
1.2.5 实时荧光定量 PCR Trizol 法提取组织总 RNA,反转录为 cDNA,以 cDNA 为模板进行real-time PCR。以 β-actin 为内对照,对照组为外对照,2-△△CT方法计算基因相对表达量。引物:fads2 F-CCATCGGCACTTCCAGCATCAC,R-TTTCCCA CCACAAAGGCGTTCAG;fabp7b F-AACACAGA GTACCTTCAAG,R-AGTTTCATCACCATCTTCC;adipoqa F-TTCACATATCACCTCACCATC,R-GAA GCCAAACCTCATCTCC;plin2 F-ACAGCAGCCTC AGTAAAG,R-GAGCAGGTAGTCCATCAC。
1.2.6 RNA测序与分析 总 RNA 提取,样品质量检测,样品检测合格后进行文库构建,Illumina Hiseq 4000 平台测序,原始数据分析由北京康普森生物科技有限公司完成。对获取到的各样本中的转录本 reads 数使用 DESeq 对数据进行标准化,计算差异比较的值和变化倍数,以< 0.05 的差异转录本进行 GO 和 KEGG 富集分析。
1.3 统计学处理
2 结果
2.1 果糖诱导斑马鱼幼鱼肝脏脂肪变性
5 dpf 的幼鱼给予 0.25% 的果糖处理,持续 10 d。结果表明与对照组相比较,果糖处理组幼鱼体重无明显变化,体长显著增加。油红 O 染色结果表明,果糖处理组幼鱼肝脏区域有明显红色着色,提示肝脏产生脂肪堆积。肝脏石蜡切片 HE 染色结果表明,果糖处理组幼鱼肝脏呈现出微小空泡,提示肝脏发生脂肪变性。肝脏生化分析结果表明,果糖处理组幼鱼肝脏的甘油三酯、葡萄糖含量显著升高,胆固醇水平没有明显变化,肝脏脂肪变性率显著升高(图 1)。以上结果表明阶段性果糖喂饲可导致斑马鱼幼鱼肝脏脂肪变性。
2.2 测序数据统计
在果糖处理结束后,我们分别从两组斑马鱼肝脏中提取了总 RNA,利用 RNA-seq 技术进行转录调控分析。首先分别在对照组和果糖处理组读取到了 34 647 769 和 39 055 155 个原始序列,经过滤后得到 33 984 509 和 38 160 017 个序列数。过滤后的总碱基数分别为 10.2 G 和 11.45 G。平均碱基测序错误率小于 0.03%。GC 含量占总碱基数比例分别为 45.23% 和 46.25%。然后通过 STAR 软件与斑马鱼基因组信息比对。两组的唯一比对序列读数分别为 29 996 555 和 34 138 835,配对百分比数相似,分别为 88.27% 和 89.46%。新增序列读数分别为 1 474 890 和 1 672 991,数据质量满足分析要求。
2.3 差异基因表达分析
为研究果糖影响幼鱼肝脏生理的相关机制,我们进一步分析其基因表达模式,聚类分析表明果糖喂饲的斑马鱼展现出明显的差异基因表达谱(图 2A)。与对照组相比较,果糖处理组共发现了 485 个差异表达基因(变化倍数 > 3,< 0.05),其中 283 个基因上调,202 个基因下调(图 2B)。我们分析了已知的差异表达基因中,上调和下调倍数最高的前 20 个基因(图 2C)。其中上调倍数最高的 adipoqa 基因与能量代谢相关的 PPAR 通路和脂肪因子信号通路相关,提示果糖饮食可能诱发体内能量代谢失衡。
2.4 差异基因 KEGG 和 GO 归类分析
分别对差异上调基因、下调基因进行 GO 富集分析。其中上调差异基因富集到的 GO生物过程包括:细胞周期调节、氧气输送、固醇类代谢过程等,提示饮食中的果糖可能影响斑马鱼生长发育。下调差异基因富集到的 GO 生物过程包括:对病毒的防御反应,硫化物转运,硫酸盐、氯离子跨膜转运,草酸转运,细胞 pH 调节能力等,提示果糖喂饲可能影响了斑马鱼对微生物入侵的防御能力(图 3)。

图 1 果糖喂饲对斑马鱼生长及肝脏脂肪变性的影响[A:斑马鱼整体油红O 染色;B:斑马鱼肝脏 HE 染色(40 ×);C:斑马鱼肝脏油红 O 染色(40 ×);D:斑马鱼体长、体重及生化指标;与对照组相比,*P < 0.05,**P < 0.01,***P < 0.001]
Figure 1 The effects of fructose diet feeding on the growth and hepatic steatosis in larval zebrafish [A: Whole body oil red O staining; B: Liver HE staining (40 ×); C: Liver oil red O staining (40 ×); D: Body length, body weight and biochemical factors;*< 0.05,**< 0.01,***< 0.001 compared with the control]
对总的差异基因进行 KEGG 分析,在果糖喂饲的斑马鱼肝脏中,6 个显著差异表达基因归属到 PPAR 信号通路(图 4),包括 fads2、fabp7b、plin2、adipoqa、cyp7a1、cyp27a1.2,这些基因不仅在肝脏表达,还表达在骨骼肌与脂肪组织。PPAR 信号通路与能量代谢密切相关,结果提示果糖可能对肝脏脂质代谢、幼鱼早期脂肪分化产生影响。应用生物信息学方法对以上 6 个基因的相互作用进行预测,发现 fads2、fabp7b、plin2 可能存在间接的调控关系,为进一步研究提供思路(图 5)。
2.5 Real-time PCR 分析 PPAR 通路差异基因
为验证 RNA-seq 的检测结果,我们利用 real-time PCR 对 PPAR 信号通路中 4 个差异表达基因进行检测。结果表明,果糖喂饲组 fads2、fabp7b、plin2、adipoqa 基因表达显著上调,与 RNA 测序结果相似(图 6)。
3 讨论
NAFLD 以肝细胞的脂质过量累积为基本特征,疾病谱涵盖单纯的肝脏脂肪变性乃至非酒精性脂肪肝炎。非酒精性脂肪肝能导致终末期肝病,如肝纤维化、肝癌,同时还与心血管疾病相关[7]。全球非酒精性脂肪肝发病率为 2.8% ~ 46%。近年来,儿童的 NAFLD 发病率呈快速上升趋势,由于其发病较成人更快,已经成为一个日益严重的公共健康问题[8-9]。

Figure 2 Overview of gene expression profiling of liver in control and fructose group (A: Gene clustering base on gene expression profiles; B: The volcano plot of different genes showing log fold change; C: The top 40 of changed DEG between fructose and control group in zebrafish)

Figure 3 Significantly up-regulated (A) and down-regulated (B) genes assigned to GO biological process
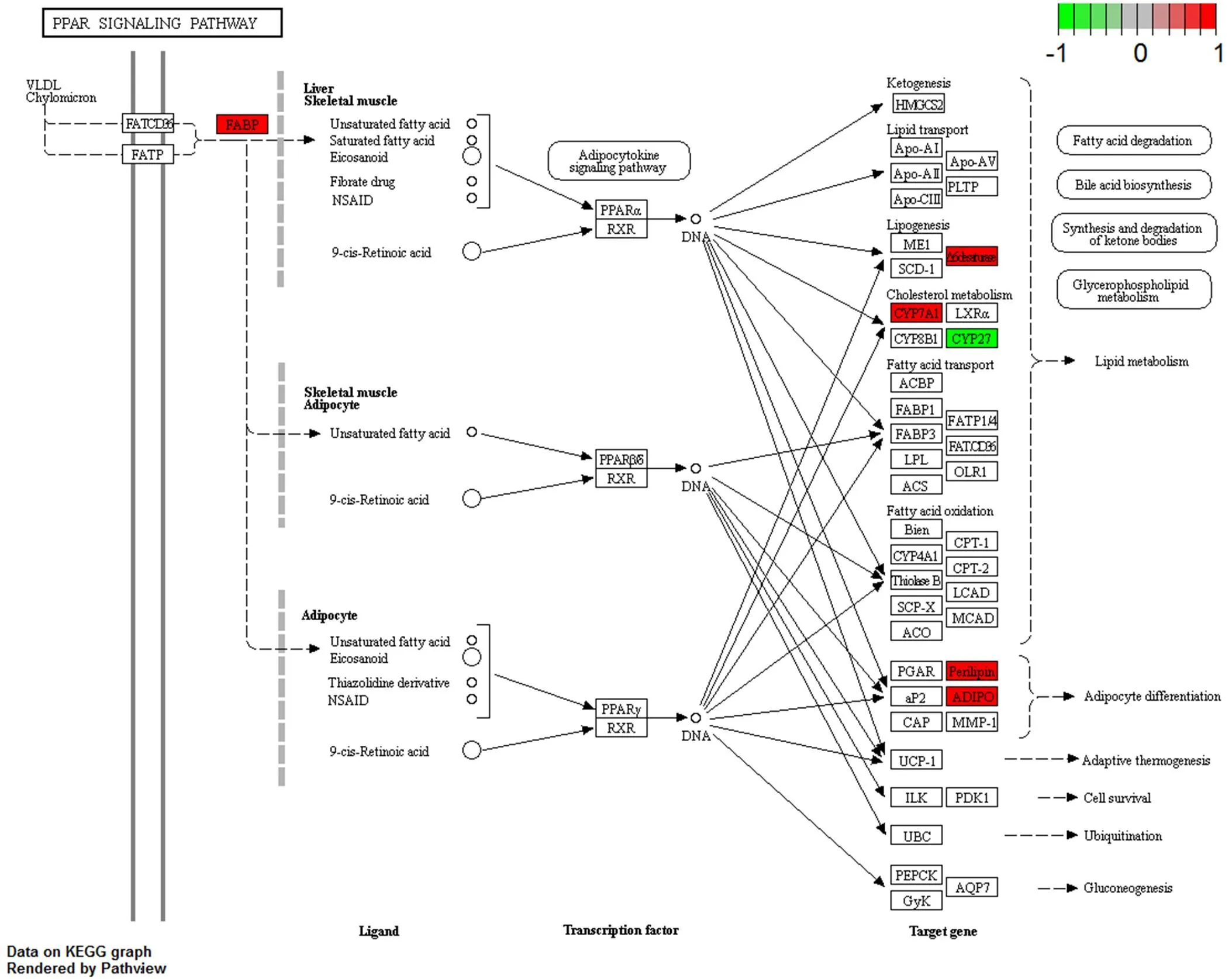
图 4 基于 KEGG 的 PPAR 信号通路的差异表达基因的分析归类(红色:显著上调基因;绿色:显著下调基因)
Figure 4 Significantly differentially expressed genes identified by KEGG as involved in PPAR signaling parthway (Red: Significantly increased expression; Green: Significantly decreased expression)

图 5 生物信息学方法预测基因-基因相互作用
Figure 5 The gene-gene interaction network was forecasted by bioinformatics method

相对 mRNA 水平Relative mRNA level5045403530255 4 3 2 1 0 fads2 fabp7b adipoqa plin2
Figure 6 Validation of four differentially expressed genes selected from PPAR pathway by qRT-PCR (*< 0.05 compared with the control group)
大量研究表明,由于经济水平的提升,我国当代人饮食习惯的改变是导致肥胖率迅速上升的主要原因之一[10]。儿童和青少年是含糖高热量饮食的主要消耗群体。已有研究表明果糖摄入与 NAFLD 发生发展有关[11]。摄入大量果糖的 NAFLD 患者,其果糖激酶基因表达量较普通人更多[4]。在啮齿类动物模型中,果糖摄入增加脂肪生成,脂肪酸氧化降低,增加内质网应激以及损伤胰岛素信号[12]。
斑马鱼已经成为一种公认的研究发育和疾病的模式动物。相较于其他模式动物,其繁殖迅速,在胚胎和幼体时期身体透明,因此适合基于疾病表型的高通量筛选和基础分子机制研究。与人类相比,斑马鱼的肝胆系统在解剖学和分子水平上高度保守,且在受精后第 5 天接近发育完全。斑马鱼的成鱼和幼鱼均可发展为肝脏脂肪变性,病理过程与人类相似[13]。目前已有多种基于药理学和基因技术手段建立的斑马鱼肝脏脂肪变性模型[14]。本研究采用果糖喂饲斑马鱼幼鱼用以模拟低龄人群 NAFLD 早期发展,结果表明,阶段性的果糖喂饲可促进斑马鱼生长,但并未导致肥胖。普通的高脂饮食在诱导肥胖的同时造成肝脏脂质堆积[15],而高果糖饮食可独立诱导斑马鱼肝脏脂肪变性和损伤,促进肝脏脂质堆积。
转录组测序技术是一种高通量测序方法,我们利用该方法观察果糖诱导的斑马鱼脂肪变性的转录组特征,为其发病机制提供分子基础。转录组分析结果表明果糖喂饲后斑马鱼肝脏基因表达谱特征发生明显变化。差异下调基因的 GO 功能注释结果表明,果糖喂饲可能降低幼鱼对病毒和其他生物的防御反应,这可能是摄入高果糖饮食的潜在风险之一。KEGG 分析得到 PPAR 信号通路的显著富集,提示机体能量平衡受影响。模型组肝脏 adipoqa 基因表达水平极显著升高,可能是机体应对果糖压力的代偿性反应,而幼体与成体基因调控差异较大,adipoqa 长期被激活是否会诱发其他疾病还需深入研究。Adipoqa 是人adiponectin 同源基因,与 2 型糖尿病、肥胖、冠心病等密切相关[16]。研究表明,在非酒精性脂肪肝病人中,adiponectin 水平与亚临床动脉粥样硬化事件显著相关[17]。血清 adiponectin 水平的异常变化可能作为儿童 NAFLD 的诊断标志物[18]。这些研究提示本实验所建模型能一定程度模拟临床疾病的病理过程,具有深入研究的价值。
综上,本研究提供了一种以现阶段国民饮食习惯——果糖为诱因的模拟低龄人群 NAFLD 发生发展的动物模型及其主要的基因表达谱特征,为进一步的机制研究或药物筛选提供了基础数据。
志谢 感谢本实验室孟杰老师在斑马鱼饲养过程中的辛勤工作
[1] Wruck W, Graffmann N, Kawala MA, et al. Concise review: current status and future directions on research related to nonalcoholic fatty liver disease. Stem Cells, 2017, 35(1):89-96.
[2] Koebnick C, Getahun D, Reynolds K, et al. Trends in nonalcoholic fatty liver disease-related hospitalizations in US children, adolescents, and young adults. J Pediatr Gastroenterol Nutr, 2009, 48(5):597-603.
[3] Caporaso N, Morisco F, Camera S, et al. Dietary approach in the prevention and treatment of NAFLD. Front Biosci (Landmark Ed), 2012, 17:2259-2268.
[4] Alwahsh SM, Gebhardt R. Dietary fructose as a risk factor for non-alcoholic fatty liver disease (NAFLD). Arch Toxicol, 2017, 91(4):1545-1563.
[5] Assunção SNF, Sorte NCB, Alves CD, et al. Nonalcoholic fatty liver disease (NAFLD) pathophysiology in obese children and adolescents: update. Nutr Hosp, 2017, 34(3):727-730.
[6] Sapp V, Gaffney L, EauClaire SF, et al. Fructose leads to hepatic steatosis in zebrafish that is reversed by mechanistic target of rapamycin (mTOR) inhibition. Hepatology, 2014, 60(5):1581-1592.
[7] Mahfood Haddad T, Hamdeh S, Kanmanthareddy A, et al. Nonalcoholic fatty liver disease and the risk of clinical cardiovascular events: a systematic review and meta-analysis. Diabetes Metab Syndr, 2017, 11 Suppl 1:S209-S216.
[8] Betancourt-Garcia MM, Arguelles A, Montes J, et al. Pediatric nonalcoholic fatty liver disease: the rise of a lethal disease among mexican american hispanic children. Obes Surg, 2017, 27(1):236-244.
[9] Welsh JA, Karpen S, Vos MB. Increasing prevalence of nonalcoholic fatty liver disease among United States adolescents, 1988-1994 to2007-2010. J Pediatr, 2013, 162(3):496-500, e1.
[10] Wang H, Ma L, Yin Q, et al. Prevalence of alcoholic liver disease and its association with socioeconomic status in north-eastern China. Alcohol Clin Exp Res, 2014, 38(4):1035-1041.
[11] Castro GS, Cardoso JF, Vannucchi H, et al. Fructose and NAFLD: metabolic implications and models of induction in rats. Acta Cir Bras, 2011, 26 Suppl 2:45-50.
[12] Jegatheesan P, De Bandt JP. Fructose and NAFLD: the multifaceted aspects of fructose metabolism. Nutrients, 2017, 9(3):E230.
[13] Fang L, Liu C, Miller YI. Zebrafish models of dyslipidemia: relevance to atherosclerosis and angiogenesis. Transl Res, 2014, 163(2):99-108.
[14] Hölttä-Vuori M, Salo VT, Nyberg L, et al. Zebrafish: gaining popularity in lipid research. Biochem J, 2010, 429(2):235-242.
[15] Oka T, Nishimura Y, Zang L, et al. Diet-induced obesity in zebrafish shares common pathophysiological pathways with mammalian obesity. BMC Physiol, 2010, 10:21.
[16] Achari AE, Jain SK. Adiponectin, a therapeutic target for obesity, diabetes, and endothelial dysfunction. Int J Mol Sci, 2017, 18(6): E1321.
[17] Omelchenko E, Gavish D, Shargorodsky M. Adiponectin is better predictor of subclinical atherosclerosis than liver function tests in patients with nonalcoholic fatty liver disease. J Am Soc Hypertens, 2014, 8(6):376-380.
[18] Mohamed AA, Sabry S, Abdallah AM, et al. Circulating adipokines in children with nonalcoholic fatty liver disease: possible noninvasive diagnostic markers. Ann Gastroenterol, 2017, 30(4):457-463.
Transcriptomic analysis of fructose induced liver steatosis in larval zebrafish
CHEN Bo, ZHANG Jing-pu
Department of Pharmacology, Key Laboratory of Biotechnology of Antibiotics, the National Health CommissionThe Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
The prevalence of nonalcoholic fatty liver disease (NAFLD) is increasing in young people. The purpose of this study was to establish a sugar-induced NAFLD model and reveal the characteristics of its gene expression profile for the mechanism studies of NAFLD and drug screening in youth.
Zebrafish larvae were fed with a high fructose diet or normal diet respectively. The liver steatosis was analyzed by hepatic lipid accumulation and biological indexes. Transcriptome sequencing was employed to observe the changes of gene expression profile, and the functional enrichment of differentially expressed genes was conducted by Kyoto Encyclopedia of Genes and Genomes (KEGG) and Gene Ontology (GO) database.
Zebrafish larvae were fed with a high fructose diet for 10 days developed liver steatosis. The results of pathological showed that lipid vacuoles appeared in the liver of the fructose fed larvae with red staining. The triglyceride and glucose contents of liver were significantly increased in fructose group compared with the control group. Transcriptome sequencing showed significant changes of gene expression profile in fructose-fed larvae. A total of 485 differentially expressed genes were identified (change fold > 3,< 0.05). Analysis of the differentially expressed genes by KEGG showed that PPAR signaling pathway was significantly enriched. Four genes involved in PPAR pathway were validated by real-time PCR. The GO analysis from down-regulated gene showed that GO term: defense response to virus was significantly enriched.
This study has established a fructose-induced zebrafish NAFLD model. Particularly, variant expression of energy metabolism related genes in fatty livers supports a role of fructose diet in NAFLD pathology and provides a foundation for mechanism studies and drug screening of NAFLD.
Zebrafish; Fructose; Nonalcoholic fatty liver disease; RNA-seq
ZHANG Jing-pu, Email: zhangjingpu@imb.pumc.edu.cn
国家自然科学基金青年科学基金(81603172);协和青年科研基金(3332016064)
张靖溥,Email:zjp5577@126.com
10.3969/j.issn.1673-713X.2019.04.004
2019-04-08

