基于TiO2@Fe3O4纳米材料的盐酸阿霉素磁性热敏脂质体制备及其理化特性、磁效应和光热效应考察
祝侠丽 张慧娟 王莎莎 李玲华 贾永艳





中圖分类号 R943 文献标志码 A 文章编号 1001-0408(2019)20-2752-06
DOI 10.6039/j.issn.1001-0408.2019.20.04
摘 要 目的:制备一种包载盐酸阿霉素(DOX)的磁性热敏脂质体(MTSL),考察其理化性质、磁效应和光热效应,为肿瘤的化疗及光热/光动力治疗提供基础。方法:以DOX为模型药物,以纳米二氧化钛-纳米四氧化三铁复合材料(TiO2@Fe3O4)作为光敏剂和磁性材料,采用薄膜分散法制备DOX-TiO2@Fe3O4-MTSL。观察该脂质体的形态和分散性、粒径及Zeta电位,采用超滤-离心法结合高效液相色谱法考察其包封率;采用磁强针考察其顺磁性。与DOX溶液比较,采用透析法考察该脂质体的体外释放行为,并比较在不同温度(37、43 ℃)下的释放曲线。采用808 nm近红外激光照射,考察该脂质体的光热转换效应以及对人乳腺癌MCF-7细胞中活性氧(ROS)产生的影响。结果:制备的DOX-TiO2@Fe3O4-MTSL为棕黑色,水分散性好;电镜下呈类圆球形,大小较均匀;平均粒径为250.6 nm,多分散性指数为0.107,Zeta电位为(-7.76±3.41)mV;包封率为(92.3±3.2)%;在外加磁场下可定向移动,具有明显的顺磁性。与DOX溶液比较,该脂质体释药速度较慢,具有明显的缓释特性;与37 ℃条件比较,该脂质体在43 ℃条件下的释药速度明显加快。随激光(808 nm)照射时间的增加,该脂质体的温度持续升高,具有明显的光热转换效应,并可使MCF-7细胞中ROS的产生明显增加。结论:成功制备了DOX-TiO2@Fe3O4-MTSL,其外观形态均匀、理化性质良好;具有明显的顺磁性、缓释作用和光热转换性能,能在808 nm近红外激光照射下增加MCF-7细胞中ROS的含量。
关键词 纳米二氧化钛;纳米四氧化三铁;TiO2@Fe3O4复合纳米材料;磁性热敏脂质体;盐酸阿霉素;光热治疗;光动力治疗;光热效应;磁靶向性
ABSTRACT OBJECTIVE: To prepare Adriamycin hydrochloride (DOX) magnetic thermosensitive liposome (MTSL), investigate its physicochemical properties, magnetic effect and photothermal effect, so as to provide reference for tumor chemo- therapy and photodynamic/photothermal therapy. METHODS: Using DOX as model drug, TiO2@Fe3O4 as photosensitizers and magnetic materials, DOX-TiO2@Fe3O4-MTSL was prepared with membrane dispersion method. The morphology and dispersibility were observed; particle size and Zeta potential were detected; encapsulation efficiency of the liposome were determined by centrifugal ultrafiltration and HPLC. Its paramagnetism property was also detected by magnetometer. Compared with DOX solution, in vitro release behavior of the liposome was investigated by dialysis method, and the release curves at different temperatures (at 37, 43 ℃) were compared. The photothermal conversion effect of the liposome and the production of reactive oxygen species (ROS) in human breast cancer MCF-7 cells were investigated by near infrared laser irradiation at 808 nm. RESULTS: Prepared DOX-TiO2@Fe3O4-MTSL was brown-black with good water dispersion, and was spherical in shape and uniform in size under electron microscopy. Average particle size was 250.6 nm; polydispersity index was 0.107; Zeta potential was (-7.76±3.41)mV; encapsulation efficiency was (92.3±3.2)%. Under the external magnetic field, the liposome could move in a directional direction and had obvious paramagnetism. Compared with DOX solution, the liposomes released slowly and showed obvious sustained- release characteristics. Compared with at 37 ℃, the drug release of liposome speeded up significantly at 43 ℃.With the increase of laser (808 nm) irradiation time, the temperature of the liposome kept rising, which had obvious photothermal conversion effect and could induce the increase of ROS in MCF-7 cells. CONCLUSIONS: DOX-TiO2@Fe3O4-MTSL is prepared succe- ssfully, which has uniform appearance, good physical and chemical properties. It has obvious paramagnetism sustained release effect and photothermal conversion efficiency, and can promote ROS production in MCF-7 cells under near infrared laser irradiation at 808 nm.
KEYWORDS Nano-titanium dioxide; Nano-ferroferric oxide; TiO2@Fe3O4 nano materials; Magnetic thermo-sensitive liposomes; Adriamycin hydrochloride; Photothermal therapy; Photodynamic therapy; Photothermal effect; Magnetic targeting
光疗是目前一种新兴的肿瘤治疗方法,其中最具代表性的是光热治疗(Photothermal therapy,PTT)和光动力治疗(Photodynamic therapy,PDT)[1],其原理是在700~1 100 nm近红外激光照射下,利用某些纳米材料对光的强吸收作用而产生的高热量或活性氧(ROS)直接或间接杀死肿瘤细胞[2],在恶性肿瘤的综合治疗方面具有良好的应用前景。其中,PTT是采用具有较强组织穿透能力的近红外光作为光源,辐照具有光热转化能力的纳米材料使其产热,从而发挥杀灭肿瘤细胞的治疗作用[3];PDT的治疗基础则是一种光敏化反应,即通过特定波长的光源照射光敏剂,光敏剂被激活后可产生ROS,从而诱导肿瘤细胞凋亡乃至死亡[4-5]。
纳米二氧化钛(TiO2)作为新兴光敏剂的代表,具有催化活性高、稳定性好、毒性较低、容易获取等优点,已在PTT和PDT抗肿瘤领域表现出了巨大潜力[6]。但TiO2具有在水中稳定性较差、在生理条件下容易发生聚沉、难以实现在肿瘤部位的靶向递送等不足[7]。近年来,纳米四氧化三铁(Fe3O4)作为一种纳米级磁性材料,因可在外加磁场作用下定向迁移,从而被广泛应用于生物医学和生物技术领域[8]。本课题组在前期研究中通过化学合成将TiO2包覆在Fe3O4表面,制得一种磁性纳米级复合材料TiO2@Fe3O4,该复合材料既可作为光敏剂,同时又能结合外加磁场实现定向分布;但同时也发现,TiO2@Fe3O4纳米材料表面光滑、载药率极低,其本身难以作为药物载体来实现抗肿瘤药物在肿瘤部位的控制释放[9]。
磁性热敏脂质体(Magnetic thermo-sensitive liposomes,MTSL)是在热敏脂质体中加入磁性物质制成的一种新型脂质体,是近年发展起来的一类重要的靶向型制剂[10]。其具有较高的载药能力以及比普通脂质体更强的组织靶向和控释性能[11],可在外加磁场和实体瘤的高通透性及滞留效应的共同作用下,随血液循环靶向聚集到肿瘤组织,同时结合局部高温,可控制其包载的药物在肿瘤组织迅速释放[12]。
基于此,本课题以TiO2@Fe3O4纳米材料作为光敏剂和磁性材料,以盐酸阿霉素(Doxorubicin hydrochloride,DOX)为模型药物,制备一种同时包载TiO2@Fe3O4和DOX的磁性热敏脂质体(DOX-TiO2@Fe3O4-MTSL),并对其进行理化表征和体外释放特性考察;同时,结合808 nm波长的近红外激光照射,考察DOX-TiO2@Fe3O4-MTSL的光热转换效应,并考察在光辐照条件下其对人乳腺癌MCF-7细胞中ROS产生的影响,从而为将DOX- TiO2@Fe3O4-MTSL应用于肿瘤的化疗及PTT/PDT联合治疗提供实验基础。
1 材料
1.1 仪器
AE240型电子天平(德国Mettler-Toledo公司);N-1100-OSB-2100型旋转蒸发仪(上海爱郎仪器有限公司);92-IIN超声波细胞粉碎机(含超声波探头,宁波新芝生物科技股份有限公司);JEM-1400型透射电镜(日本JEOL公司);Nano-ZS90型电位及粒度分析仪(英国Malvern公司);MPMS SQUID XL-7型振动样品磁强计(美国Quantum 公司);MW-GX-808/3000mW型激光器(中科院长春激光所);SHA-C型水浴振荡器(巩义市予华仪器有限责任公司);TGL-16G型离心机(上海安亭科学仪器厂);1100 型高效液相色谱(HPLC)仪(含2475 FLR型荧光检测器,美国Agilent公司);E191型细胞培养箱(美国Corning公司);CKX41型倒置显微镜(日本Olympus公司)。
1.2 药品与试剂
DOX原料药(大连美伦生物技术有限公司,批号:25316-40-9,纯度:≥99%);TiO2@Fe3O4纳米材料(本课题组制备,批号:20180915);二棕榈酸磷脂酰胆碱(DPPC,瑞士 Corden Pharma公司,批号:850355P-1G-A-321);胆固醇(郑州奇华顿化工产品有限公司,批号:20150527); RPMI 1640培养基(北京勃宝莱生物科技有限公司,批号:20180326);无噬菌体胎牛血清(北京四季青生物科技有限责任公司,批号:18090506); ROS试剂盒(上海碧云天生物技术研究所,批号:20180420);柠檬酸(天津市科密欧化学试剂有限公司,批号:20160412);磷酸氢二钠(天津市风船化学试剂科技有限公司,批号:20170805);磷酸二氢钾(天津市光复科技发展有限公司,批号:2017121);氯仿、甲醇、无水乙醇等其他试剂均为分析纯或实验室常用规格;水为超纯水。
1.3 细胞
人乳腺癌MCF-7细胞购自中国科学院细胞庫。
2 方法与结果
2.1 DOX-TiO2@Fe3O4-MTSL的制备
采用逆相蒸发法制备DOX-TiO2@Fe3O4-MTSL[13]。精密称取DOX原料药6 mg、TiO2@Fe3O4 12 mg,加入柠檬酸缓冲液(pH 4.0)6 mL中,超声(功率:500 W,频率:40 kHz,以下同)处理5 min使其溶解,作为水相。另精密称取DPPC 50 mg、胆固醇10 mg,置于茄形瓶中,加入氯仿10 mL、甲醇5 mL,轻轻振摇使其溶解,作为有机相。将水相加入有机相,超声处理15 min使两者乳化均匀,然后在45 ℃、0.04 MPa的条件下旋转蒸发除去有机相,再在上述条件下继续旋转蒸发2 h后,加入0.2 mol/L磷酸氢二钠缓冲液(pH 8.0)调节pH至7.0;在60 ℃、0.04 MPa条件下旋转蒸发除去水分,直至溶液体积浓缩为约6 mL后,以超声波探头超声(功率:250 W,频率:25 kHz)处理60 s,即得DOX-TiO2@Fe3O4-MTSL。
参照上述步骤,将水相替换为柠檬酸缓冲液(pH 4.0)6 mL,同法制备空白脂质体;将水相替换为含12 mg TiO2@Fe3O4的檸檬酸缓冲液(pH 4.0)6 mL,同法制备载有光敏剂和磁性材料的空白脂质体(即TiO2@Fe3O4- MTSL)。
2.2 DOX-TiO2@Fe3O4-MTSL的表征
2.2.1 外观形态和分散性 取空白脂质体、TiO2@Fe3O4- MTSL、DOX-TiO2@Fe3O4-MTSL各适量,肉眼观察。结果,三者外观分别为半透明的乳白色、浅黄色、棕黑色,体系均较为均匀,且无明显聚沉现象,水分散性良好。
另取TiO2@Fe3O4、DOX-TiO2@Fe3O4-MTSL适量,用水稀释分散后,滴至铜网上,用3%磷钨酸溶液染色,自然晾干,置于透射电镜下观察。结果显示,TiO2@Fe3O4和DOX-TiO2@Fe3O4-MTSL均呈类圆形,大小较为均匀,粒径分别约为10、250 nm,详见图1。
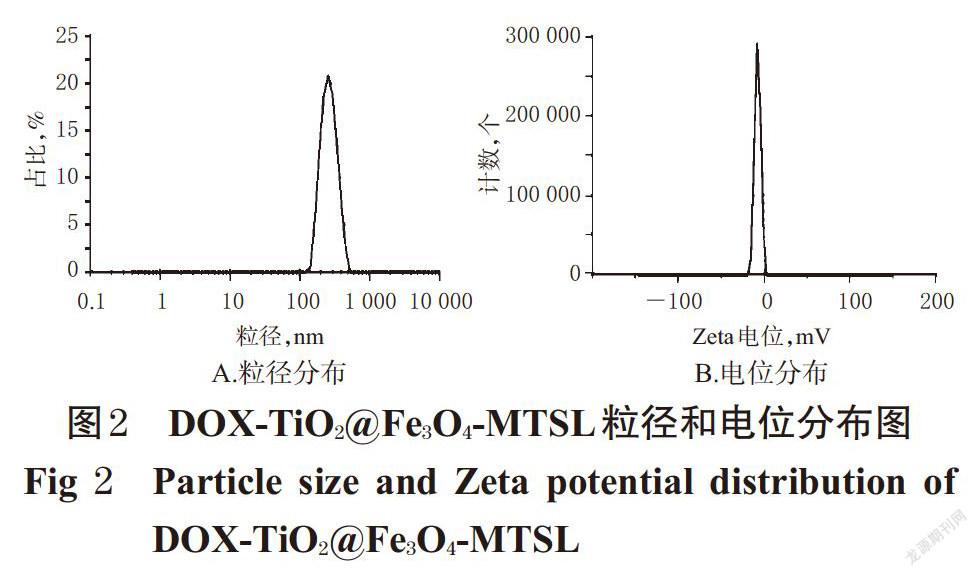
2.2.2 粒径与电位 取DOX-TiO2@Fe3O4-MTSL适量,用水稀释分散后,采用电位及粒度分析仪测定其粒径分布和Zeta电位。结果显示,DOX-TiO2@Fe3O4-MTSL的平均粒径为250.6 nm,且大小较为均匀,多分散性指数(PDI)为0.107;Zeta电位为(-7.76±3.41)mV,表明体系较为稳定,详见图2。
2.2.3 包封率 采用超滤-离心法结合HPLC法测定包封率[14]。精密量取DOX-TiO2@Fe3O4-MTSL 0.2 mL,置于超滤管(30 kDa)中,以4 000 r/min离心1.5 h,采用HPLC法[色谱条件[15]:色谱柱为Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm),检测器为荧光检测器(激发波长为480 nm,发射波长为582 nm),流动相为甲醇-pH 4.0的磷酸氢二钾缓冲液(75 ∶ 25,V/V),流速为0.8 mL/min,柱温为(30±0.2)℃,进样量为10 μL]测定,并计算游离DOX的质量(W游);另精密量取DOX- TiO2@Fe3O4-MTSL 0.2 mL,加入甲醇1.8 mL破乳后,采用上述方法测定并计算DOX总质量(W总)。按公式计算包封率:包封率(%)=(W总-W游)/W总×100%。结果显示,DOX-TiO2@Fe3O4-MTSL中DOX的包封率为(92.3±3.2)%。
2.2.4 磁滞回线及磁定向性 称取TiO2@Fe3O4适量,采用振动样品磁强计测定其磁矩(μ)随外加磁场强度(H)的变化值, H范围设置为-20 000~20 000 Oe[16]。以磁场强度(H,Oe)为横坐标、单位质量的磁矩(μ,emu/g)为纵坐标,采用Origin 8.5软件绘制磁滞回线,结果显示,TiO2@Fe3O4纳米材料和Fe3O4[17]具有相似的顺磁性,详见图3。另取 DOX-TiO2@Fe3O4-MTSL适量,置于西林瓶中,在一枚圆柱形强力磁铁(直径:5 mm,高度:10 mm)的外加磁场下,与未加磁铁时对比,考察其磁定向性。结果显示,未外加磁铁时,DOX-TiO2@Fe3O4-MTSL呈现较为均匀的棕黑色;外加磁铁后,其体系中的棕黑色物质定向移动,并集中分布在外加磁铁的位置,详见图4。这表明DOX-TiO2@Fe3O4-MTSL具有明显的顺磁性,可在外加磁场下定向移动,可为该脂质体的磁靶向性研究提供基础。
2.3 DOX-TiO2@Fe3O4-MTSL的体外释放度考察
精密量取DOX溶液(1 mg/mL,以水为溶剂配制)、DOX-TiO2@Fe3O4-MTSL各1 mL,置于透析袋 (截留分子量:12 kDa)中,释放介质为水100 mL,设定恒温振荡器的温度为 37 ℃、转速为 100 r/min[18]。分别于透析0.5、1、2、4、6、12、24 h时取样,每次取样后补充等温、同体积的水。按“2.2”项下HPLC法测定取样液中DOX的浓度(c,mg/mL),按公式计算累积释放率:累积释放率(%)=(c×V)/W总×100%,其中,V为释放介质体积(mL),W总为DOX的总量(mg)。另取DOX-TiO2@Fe3O4- MTSL适量,其他条件不变,设定恒温振荡器的温度为 43 ℃[13],按上述同样方法进行释放度试验。以时间(t,min)为横坐标、累积释放率(Q,%)为纵坐标,采用Origin 8.5软件绘制释药曲线,结果见图5。
由图5A可见,在37 ℃条件下,DOX溶液中药物释放速度较快,DOX-TiO2@Fe3O4-MTSL释药速度较慢,表明后者具有明显的缓释特性。由图5B可见,在43 ℃条件下,DOX-TiO2@Fe3O4-MTSL的释药速度明显高于其在37 ℃条件下的释药速度;在第24 h时,其在37、43 ℃条件下的累积释放率分别为12.3%、36.7%,表明其体外释药行为具有温度依赖性,即在人体温(37 ℃)条件下释放较慢,而当温度升高至其相变温度(43 ℃)时则释药速度明显加快。
2.4 DOX-TiO2@Fe3O4-MTSL的光热转换性能考察
取DOX-TiO2@Fe3O4-MTSL适量,加入5倍体积水稀释后,精密量取3 mL,置于石英比色池,采用808 nm激光以2.0 W/cm2的强度进行照射,每分钟记录温度[19]。以时间(t,min)为横坐标、温度(T,℃)为纵坐标,采用Origin 8.5软件绘制光-热转换曲线。结果显示,随激光照射时间的增加,DOX-TiO2@Fe3O4-MTSL的温度持续升高,详见图6。这表明TiO2@Fe3O4-MTSL具有明显的光热转换特性,可为该脂质体用于肿瘤的PTT治疗提供基础。
2.5 DOX-TiO2@Fe3O4-MTSL对MCF-7细胞中ROS产生的影响考察
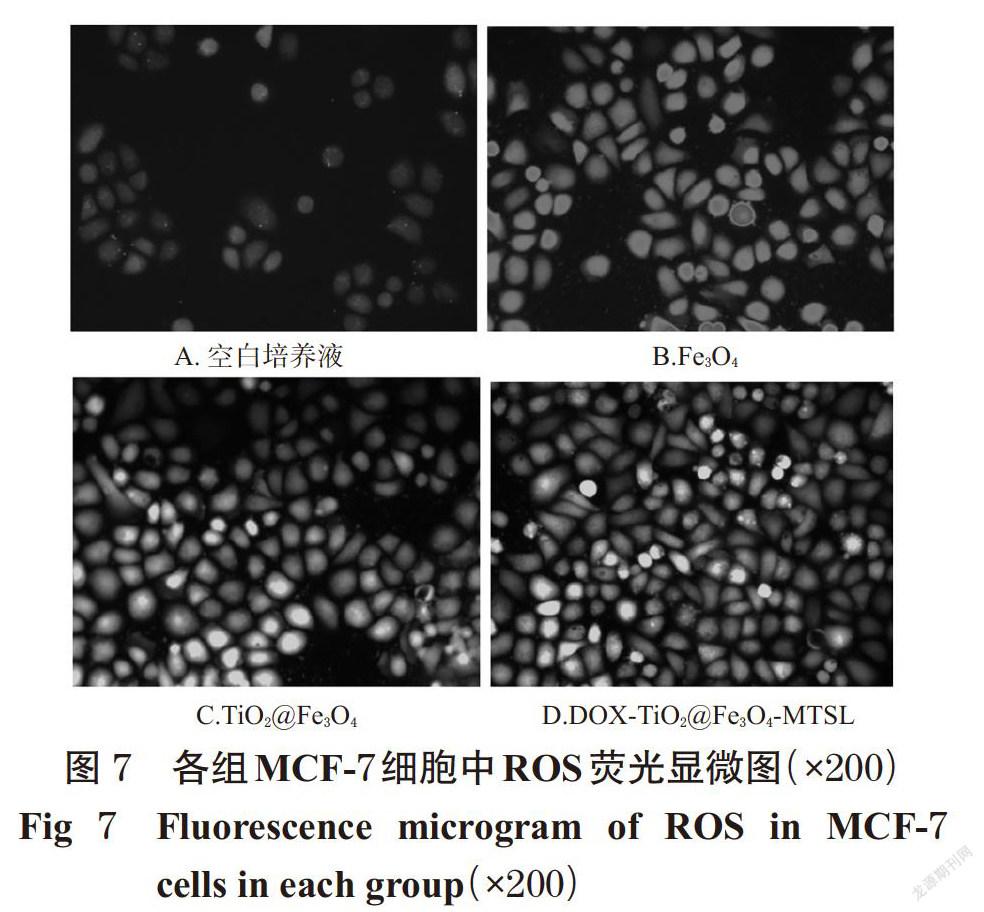
以MCF-7细胞为模型,考察DOX-TiO2@Fe3O4-MTSL对细胞中ROS产生的影响。将细胞接种于含100 μg/mL青霉素、100 μg/mL链霉素、10%胎牛血清的RPMI 1640培养基(以下简称“培养液”),在37 ℃、5% CO2培养箱中培养。待细胞生长至对数期时,按5×104个/孔铺于6孔板(6 孔板底部铺上无水乙醇处理过的载玻片)。当细胞融合度达到70%时,弃去原培养基,分别加入空白培养液以及含Fe3O4或TiO2@Fe3O4或DOX-TiO2@ Fe3O4-MTSL的培养液(20 μg/mL,均以Fe3O4的量计算,给药浓度参照预试验结果制定)2 mL,继续培养4 h。各组细胞采用808 nm激光以2.0 W/cm2的强度照射 5 min,然后加入ROS试剂盒,于37 ℃下避光孵育30 min;弃去培养液,以pH 7.2的磷酸盐缓冲液冲洗3次后,取出细胞爬片,在倒置显微镜下观察细胞中ROS的产生情况(绿色荧光越强,则表示ROS量越多)[20],结果见图7。
由图7可见,与空白对照组比较,Fe3O4、TiO2@Fe3O4 和DOX-TiO2@Fe3O4-MTSL在808 nm激光照射下均能产生一定量的ROS,但Fe3O4组细胞ROS荧光信号较弱,TiO2@Fe3O4和DOX-TiO2@Fe3O4-MTSL组细胞中ROS的荧光信号则明显增强。这表明DOX-TiO2@Fe3O4-MTSL结合近红外激光照射可使MCF-7细胞中ROS的含量明显增多,可为该脂质体用于肿瘤的PDT治疗提供基础。
3 讨论
磁性纳米材料在MTSL中主要起导向和定位作用,理想的磁性纳米材料应具备较小的粒径(10~20 nm)、较好的磁场响应性、优良的安全性和生物相容性[10]。本课题组前期研究中合成的TiO2@Fe3O4纳米材料大小较为均匀,直径约为10 nm,和Fe3O4具有相似的顺磁性[17];以该纳米材料制成的DOX-TiO2@Fe3O4-MTSL平均粒径为250.6 nm,大小均匀(PDI=0.107),可在外加磁场下定向移动,表明以TiO2@Fe3O4为磁性纳米材料制备的DOX-TiO2@Fe3O4-MTSL具有磁靶向分布特征。
光敏剂的选择是肿瘤PTT和PDT综合治疗的关键。TiO2作为新一代的抗肿瘤光敏剂,具有良好的生物相容性及化学稳定性、较高的光催化活性、安全无毒等诸多优点,已成为近年来医学领域的研究热点[21]。本课题组制备的TiO2@Fe3O4兼具光敏性和磁靶向性,以其制备的DOX-TiO2@Fe3O4-MTSL在808 nm近红外激光照射下表现出明显的光热转换特性;同时,该热效能不仅可促进DOX-TiO2@Fe3O4-MTSL中药物的释放,而且可使MCF-7细胞中产生更多ROS。这为DOX-TiO2@Fe3O4-
MTSL用于肿瘤的PTT和PDT综合治疗提供了一定的基础。
由于人体对温度的耐受程度是有限的,超过45 ℃的高温会对人体造成伤害[22],因此本研究选择DPPC为热敏磷脂,其相变温度为42~43 ℃[23]。为考察DOX- TiO2@Fe3O4-MTSL的温度控释特性,本研究分别在人体体温(37 ℃)和DPPC相变温度(43 ℃)的条件下进行了体外释放度试验。结果显示,与DOX溶液比较,DOX- TiO2@Fe3O4-MTSL具有明显的缓释特性,且在43 ℃下的释药速度明显高于其在37 ℃条件下的释药速度,表明其释药行为具有温度依赖性。本课题组曾考虑采用808 nm激光照射透析袋内的DOX-TiO2@Fe3O4-MTSL,以考察其因光热转换特性产生局部高温后对药物释放的影响,但由于释放试验是在恒温振荡条件下进行,激光照射不便操作,故将介质温度设置为43 ℃,以间接反映808 nm激光的热效应。下一步拟在细胞和动物实验中采用808 nm激光照射制造局部高温环境,直接考察光热转换效应对药物释放的影响。
综上所述,本研究以前期合成的TiO2@Fe3O4作为光敏剂和磁性材料,包载抗肿瘤药物DOX,成功制备了一种磁性热敏脂质体DOX-TiO2@Fe3O4-MTSL。该脂质体外观形态均匀、理化性质良好;具有明显的顺磁性,可在外加磁场下定向移动;具有明显的缓释作用,并能在热效应下加快释药速度;具有明显的热转换性能,能在808 nm近红外激光照射下使MCF-7细胞中ROS的产生明显增加。本研究可为肿瘤的化疗以及PTT/PDT联合治疗提供一定的实验基础,后续拟一步进行该脂质体的体內研究。
参考文献
[ 1 ] 陈倩倩.基于二氧化钛和多壁碳纳米管递药系统的构建及用于肿瘤光疗的初步研究[D].郑州:郑州大学,2014.
[ 2 ] 田野,杨武利.透明质酸/cypate复合纳米粒子在肿瘤光疗中的应用[C]//中国化学会,中国机械工程学会,中国材料研究学会.2016年全国高分子材料科学与工程研讨会论文摘要集.桂林,2016:470.
[ 3 ] 赵承志,李万万.无机纳米材料用于肿瘤光热治疗的研究进展[J].肿瘤,2017,37(3):289-294.
[ 4 ] 肖竦,刘怀志.肿瘤光动力疗法[J].实用癌症杂志,2005,20(2):214-216.
[ 5 ] 郎月红,李黎波.光动力治疗三要素及肿瘤光动力治疗后复发问题的探索[J].中国激光医学杂志,2019,28(2):100-106.
[ 6 ] ZHANG X,WANG H,YANG C,et al. Preparation,cha- racterization of Fe3O4 at TiO2 magnetic nanoparticles and their application for immunoassay of biomarker of exposure to organophosphorus pesticides[J]. Biosens Bioelectron,2013,41(1):669-674.
[ 7 ] BASINA G,MOUNTRICHAS G,DEVLIN E,et al. Synthesis and magnetic properties of Fe3O4 nanoparticles coated with biocompatible double hydrophilic block copolymer[J]. J Nanosci Nanotech,2009,9(8):4753-4759.
[ 8 ] 郭海玲.磁靶向多功能药物载体的制备及协同抗肿瘤研究[D].合肥:安徽大学,2018.
[ 9 ] 冀嫣丹.基于纳米磁性二氧化钛抗肿瘤药物递送系统的构建及体内外研究[D].郑州:郑州大学,2016.
[10] 陈召红,刘皈阳.磁性热敏脂质体的研究进展[J].中国药理学与毒理学杂志,2012,26(2): 247-250.
[11] PRADHAN P,GIRI J,RIEKEN F,et al. Targeted temperature sensitive magnetic liposomes for thermo-chemotherapy[J]. J Control Release,2010,142(1):108-121.
[12] CHEN KJ,CHAUNG EY,WEY SP,et al. Hyperthermia-mediated local drug delivery by a bubble-generating liposomal system for tumor-specific chemotherapy[J]. ACS Nano,2014,8(5):5105-5115.
[13] ZHU X,XIE Y,ZHANG Y,et al. Thermo-sensitive liposomes loaded with doxorubicin and lysine modified single-walled carbon nanotubes as tumor-targeting drug delivery system[J]. J Biomater Appl,2014,29(5):769-779.
[14] 杨红艳,陈子明,黄丽平,等.盐酸莫西沙星脂质体的制备及包封率测定方法研究[J].中国医院药学杂志,2018,38(10):36-40.
[15] 李桂云.荧光分析法测定注射用盐酸阿霉素的含量[J].中国药物与临床,2013,13(S1):26-27.
[16] 冯本珍.铁磁材料磁滞回线的研究[J].中国科技信息,2006,5(22):307-308.
[17] ZHU X,HUANG H,ZHANG Y,et al. Cit/CuS@Fe3O4- based and enzyme-responsive magnetic nanoparticles for tumor chemotherapy,photothermal,and photodynamic therapy[J]. J Biomater Appl,2017,31(7):1010-1025.
[18] 欧婷.脂质体释放度检查方法的标准化研究[D].北京:中国食品药品检定研究院,2017.
[19] ZHU X,ZHANG Y,HUANG H,et al. Folic acid-modified and functionalized CuS nanocrystal-based nanoparticles for combined tumor chemo- and photothermal therapy[J]. J Drug Target,2017,25(5):1-19.
[20] ZHANG H,HOU L,JIAO X,et al. Transferrin-mediated fullerenes nanoparticles as Fe2+-dependent drug vehicles for synergistic anti-tumor efficacy[J]. Biomaterials,2015,37(1):353-366.
[21] 徐麗霜,隋丽丽,葛欣,等.纳米二氧化钛抗癌光敏剂灭杀肿瘤细胞的研究进展[J].沈阳医学院学报,2019,21(1):87-89.
[22] 祝侠丽.碘海醇定位洛莫司汀温度敏感脂质体的研究[D].济南:山东大学,2006.
[23] 吴燕,吴诚,梅兴国,等.盐酸表柔比星长循环热敏脂质体的处方优化及体外释药考察[J].中国药学杂志,2010,45(9):677-681.
(收稿日期:2019-05-08 修回日期:2019-08-28)
(编辑:段思怡)

