瑶药糯米风醇提物的化学成分研究
梁爽 马雯芳 梁可文 赵立春 邓刚 谢冬养
中图分类号 R284.1 文献标志码 A 文章编号 1001-0408(2019)20-2835-05
DOI 10.6039/j.issn.1001-0408.2019.20.19
摘 要 目的:研究瑶药糯米风醇提物的化学成分。方法:采用硅胶柱、SephadexLH-20凝胶柱、AB-8大孔树脂柱等对糯米风75%乙醇提取物的石油醚、乙酸乙酯和正丁醇部位進行分离纯化,根据理化性质和波谱(质谱、氢谱、碳谱)数据分析鉴定所得化合物的结构。结果与结论:从糯米风75%乙醇提取物中共分离鉴定出12个化合物,其中从石油醚部位获得β-谷甾醇(Ⅰ)、豆甾醇(Ⅱ),从乙酸乙酯部位获得对羟基苯甲酸(Ⅲ)、β-胡萝卜苷(Ⅳ)、原儿茶酸(Ⅴ)、6β-羟基-艾里莫芬-7(11)-烯-12,8β-内酯(Ⅵ)、10β-羟基-7(11)-烯-8,12-艾里莫酚内酯(Ⅶ)、10β-羟基-7(11),8(9)-二烯-8,12-艾里莫酚内酯(Ⅷ)、槲皮素(Ⅸ)、金丝桃苷(Ⅹ)、4α-hydroxy-eudesman-11-ene(Ⅺ),从正丁醇部位获得槲皮素-3-O-洋槐糖苷(Ⅻ)。化合物Ⅰ~Ⅻ均为首次从该植物中分离得到。本研究可为糯米风的药理活性研究提供物质基础。
关键词 糯米风;化学成分;分离鉴定;结构鉴定
ABSTRACT OBJECTIVE: To study the chemical constituents of ethanol extract from Yao medicine Cissampelopsis spelaeicola. METHODS: The petroleum ether, ethyl acetate and n-butanol fraction from 75% ethanol extract of C. spelaeicola were isolated and purified by silica gel, SephadexLH-20 gel column and AB-8 macroporous resin column, etc. The structures of the compounds were analyzed and identified by physicochemical properties and spectral data (mass spectrometry, hydrogen spectrum, carbon spectrum). RESULTS & CONCLUSIONS: Twelve compounds were isolated and identified from 75% ethanol extract of C. spelaeicola. β-sitosterol(Ⅰ) and Stigmasterol(Ⅱ) were isolated from petroleum ether fraction; p-hydroxybenzoic acid(Ⅲ), β-daucossterol(Ⅳ), protocatechuic acid(Ⅴ), 6β-hydroxyeremophi-7(11)-en-12,8β-olide(Ⅵ), 10β-hydroxyeremophil-7(11)-en-8,12-olide(Ⅶ), 10β-hydroxyeremophi-7(11),8(9)-dien-8,12-olide(Ⅷ), Quercetin(Ⅸ), Hyperin(Ⅹ) and 4α-hydroxy- eudesman-11-ene(Ⅺ) were isolated from ethyl acetate fraction; quercetin-3-O-robinobioside(Ⅻ) was isolated from n-butanol fraction. Compounds Ⅰ-Ⅻ are isolated from C. spelaeicola for the first time. The study can lay material foundation for activity stady of C. spelaeicola.
KEYWORDS Cissampelopsis spelaeicola; Chemical constituents; Isolation and identification; Structure identification
糯米风又称岩穴藤菊,为菊科植物岩穴千里光[Cissampelopsis spelaeicola (Vant) C. Jeffrey et Y. L. Chen]的干燥地上部分,主要分布于广西、四川、贵州、云南等地,主产于广西瑶族地区,为传统瑶药[1]。糯米风在民间使用的历史悠久,较早被收载于《广西瑶族习用药材质量标准》中。其味辛、微苦,性微温,具祛风除湿、通经活络之功,可用于风湿痛、类风湿性关节炎、肌腱痉挛、小儿高热抽搐、小儿麻痹、小儿麻痹后遗症及跌打损伤等症的治疗[1]。本课题组前期研究发现,糯米风75%乙醇提取物得率最高,故为了解其化学成分、挖掘其药理作用的物质基础,本研究采用硅胶柱色谱、SephadexLH-20凝胶柱色谱、重结晶、大孔树脂柱色谱等方法,对糯米风70%乙醇提取物的成分进行分离、纯化及鉴定,以期为该药材的进一步开发利用提供依据。
1 材料
1.1 仪器
1100型液相色谱仪(美国Agilent公司);Eaquire HCT型质谱仪、AVANCE-500 MHz型超导核磁共振波谱仪(美国Bruker Daltonics公司);YRT-3型熔点仪(天津市精拓仪器科技有限公司);RE-52AA型旋转蒸发仪(上海亚荣生化仪器有限公司)。
1.2 药材与试剂
糯米风药材于2014年10月采于广西凭祥市,经广西健丰药业有限公司梁可文副研究员鉴定为菊科植物岩穴千里光[C. spelaeicola (Vant) C. Jeffrey et Y. L. Chen]的地上部分。标本保存于桂林益天成生物科技有限公司。
SephadexLH-20凝胶(18~111 μm,美国Pharmacia公司);硅胶(100~200、200~300目,青岛海洋化工厂);AB-8大孔树脂(0.3~1.25 mm,大連美仑生物科技有限公司);聚酰胺(30~60、80~100目,国药集团化学试剂有限公司);β-胡萝卜苷对照品(批号:474-58-8,纯度:98%)、β-谷甾醇对照品(批号:83-46-5,纯度:98%)均购自上海广锐生物科技有限公司;其余试剂均为分析纯,水为纯化水。
2 提取与分离
取干燥的糯米风药材10 kg,粉碎,加入10倍量(L/kg)75%乙醇回流提取3次,每次2 h,过滤,合并提取液,减压回收溶剂,得醇提物浸膏1 035 g。浸膏加水搅拌、混悬,依次用石油醚(60~90 ℃,下同)、乙酸乙酯、正丁醇各萃取3次,分别合并各萃取部位,回收溶剂,得石油醚部位185 g、乙酸乙酯部位235 g、正丁醇部位126 g。
取石油醚部位100 g,拌样于200 g硅胶(100~200目),经硅胶柱(200~300目,下同)色谱分离,以石油醚-丙酮(10 ∶ 1、8 ∶ 1、4 ∶ 1、6 ∶ 4、1 ∶ 1,V/V)梯度洗脱,经薄层色谱法(TLC)鉴别后合并,得5个流分(即S1~S5)。其中,流分S2有白色结晶析出,将其以石油醚反复重结晶,得化合物Ⅰ(22 mg);流分S4经硅胶柱色谱,以石油醚-乙酸乙酯(50 ∶ 1,V/V)洗脱,得化合物Ⅱ(19 mg)。
取乙酸乙酯部位150 g,拌样于200 g硅胶(100~200目),经硅胶柱色谱分离,以石油醚-丙酮(100 ∶ 0、50 ∶ 1、20 ∶ 1、8 ∶ 1、5 ∶ 1、1 ∶ 1,V/V)梯度洗脱,经TLC鉴别后合并,得12个流分(即H1~H12)。取流分H3(750 mg)经硅胶柱色谱,以石油醚-乙酸乙酯(50 ∶ 1~5 ∶ 1,V/V)梯度洗脱,得72个流分,经TLC鉴定后合并,得浸膏92 mg;将上述浸膏经硅胶柱色谱,以乙酸乙酯-甲醇(50 ∶ 1~3 ∶ 1,V/V)梯度洗脱,其中以乙酸乙酯-甲醇(5 ∶ 1,V/V)洗脱得化合物Ⅲ(16 mg)。流分H4(900 mg)经硅胶柱色谱,以氯仿-甲醇(50 ∶ 1~5 ∶ 1,V/V)梯度洗脱,经TLC鉴定后合并,回收溶剂,得亚流分C1~C4;亚流分C2经硅胶柱色谱,以乙酸乙酯-甲醇(1 ∶ 1,V/V)洗脱,得化合物Ⅳ(17 mg);亚流分C3经硅胶柱色谱,以乙酸乙酯-甲醇(5 ∶ 1,V/V)洗脱,得化合物Ⅴ(12 mg)。流分H5(670 mg)经Sephadex LH-20柱色谱,以氯仿-甲醇(1 ∶ 1,V/V)洗脱,得亚流分A1~A5;亚流分A1经硅胶柱色谱,以石油醚-乙酸乙酯(6 ∶ 1,V/V)洗脱,得化合物Ⅵ(13 mg)和化合物Ⅶ(20 mg);亚流分A3经聚酰胺薄层色谱,以氯仿-甲醇(8 ∶ 1,V/V)为展开剂,得化合物Ⅷ(9 mg)。流分H6(1 200 mg)经硅胶柱色谱,以氯仿-甲醇(50 ∶ 1~1 ∶ 1,V/V)梯度洗脱,得亚流分M1~M4;亚流分M2经Sephadex LH-20柱色谱,以氯仿-甲醇(1 ∶ 1,V/V)洗脱,得化合物Ⅸ(15 mg);亚流分M2经聚酰胺柱色谱,以二氯甲烷-甲醇(100 ∶ 0~3 ∶ 1,V/V)梯度洗脱,其中二氯甲烷-甲醇(20 ∶ 1,V/V)洗脱液中析出淡黄色结晶,经甲醇重结晶后,得化合物Ⅹ(17 mg)。流分H8(700 mg)经Sephadex LH-20柱色谱,以氯仿-甲醇(1 ∶ 1,V/V)洗脱,洗脱组分再经硅胶柱色谱,以氯仿-甲醇(100 ∶ 1~1 ∶ 1,V/V)梯度洗脱,得亚流分D1~D3;亚流分D3经硅胶柱色谱,以石油醚-丙酮(20 ∶ 1,V/V)洗脱,再经聚酰胺薄层色谱,以乙醇-水-甲酸(4 ∶ 1 ∶ 0.1)为展开剂,得化合物Ⅺ(18 mg)。
取正丁醇部位100 g,经AB-8大孔树脂柱色谱,以水和95%乙醇依次洗脱以除糖,得浸膏46 g。将上述浸膏经硅胶柱色谱,以氯仿-甲醇(100 ∶ 1~0 ∶ 1,V/V)梯度洗脱,经TLC鉴别后合并,得7个流分(即D1~D7)。其中,流分D2(900 mg)经硅胶柱色谱,以氯仿-甲醇(8 ∶ 1,V/V)洗脱,洗脱液析出淡黄色结晶(106 mg),该结晶再进聚酰胺薄层色谱,以甲醇-甲酸(100 ∶ 2,V/V)为展开剂,得化合物Ⅻ(10 mg)。
3 结构鉴定
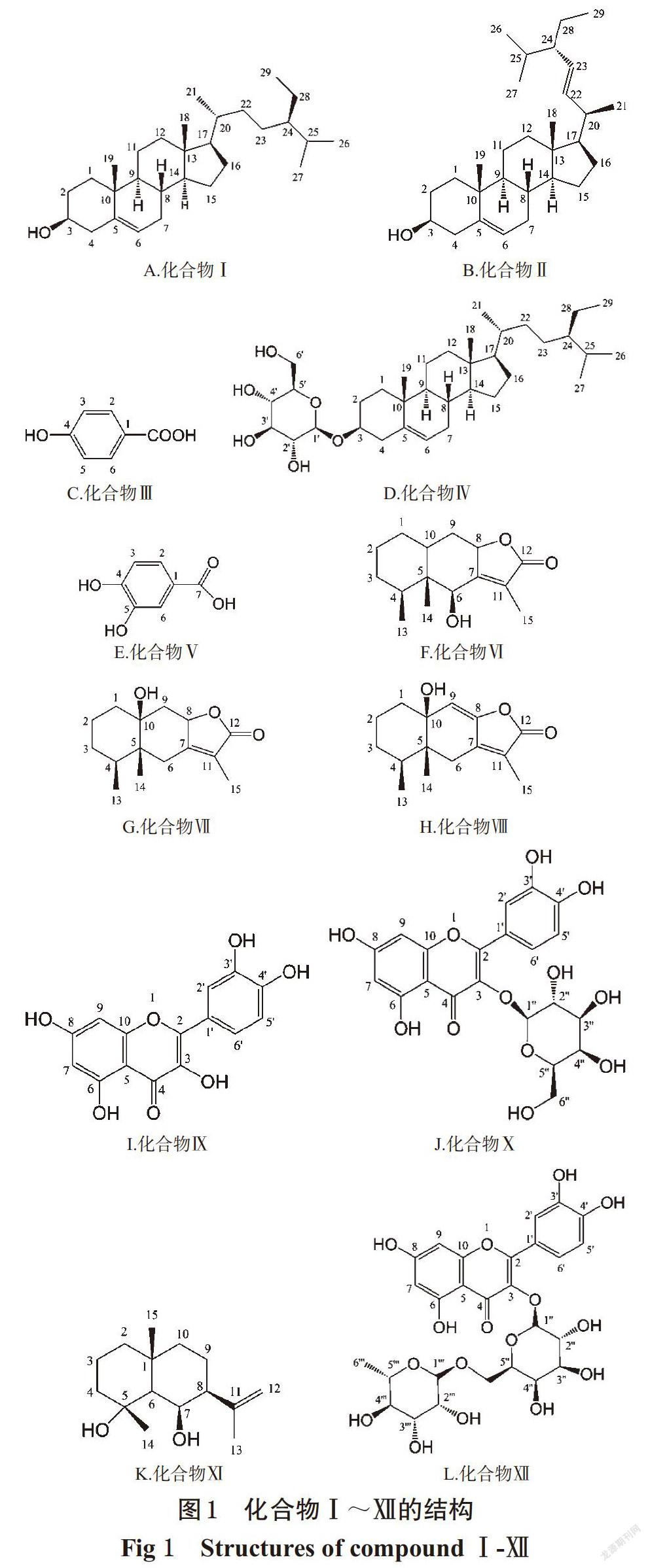
化合物Ⅰ~Ⅻ的结构见图1。
化合物Ⅰ:白色结晶(石油醚),熔点(mp):136~137 ℃。分子式:C29H50O,电喷雾质谱(ESI-MS):m/z 413.3[M-H]-。Liebermen-Buchard反应呈阳性,与β-谷甾醇对照品共行TLC,经3种不同极性展开系统[石油醚-乙酸乙酯(4 ∶ 1,V/V)、石油醚-二氯甲烷-丙酮(10 ∶ 1 ∶ 1,V/V)、石油醚-二氯甲烷-乙酸乙酯(6 ∶ 1 ∶ 1,V/V)]展开后比移值(Rf)均一致,混合后mp不下降,故鉴定该化合物为β-谷甾醇。
化合物Ⅱ:白色粉末(石油醚),mp:144~145 ℃。分子式:C29H48O,ESI-MS:m/z 413[M+H]+。1H-NMR(CDCl3,500 MHz)δ:3.53(1H,m,H-3),5.14(1H,m,H-6),0.66(3H,s,13-CH3),1.01(3H,s,20-CH3),0.98(3H,s,10-CH3),5.15(1H,dd,J=15.2,7.8 Hz,H-22),5.01(1H,dd,J=15.2,7.8 Hz,H-23),0.84~0.81(6H,m,H-26,27),0.83(3H,t,J=7.2 Hz,H-29)。13C-NMR(CDCl3,125 MHz)δ:37.2(C-1),31.7(C-2),71.8(C-3),42.2(C-4),140.6(C-5),121.7(C-6),31.7(C-7),31.9(C-8),50.1(C-9),36.6(C-10),21.0(C-11),39.7(C-12),42.3(C-13),56.9(C-14),24.3(C-15),28.7(C-16),56.4(C-17),12.1(C-18),19.2(C-19),40.3(C-20),19.8(C-21),138.3(C-22),129.2(C-23),51.1(C-24),31.6(C-25),19.5(C-26),18.8(C-27),25.2(C-28),12.3(C-29)。以上数据与文献[2]基本一致,故鉴定该化合物为豆甾醇。
化合物Ⅲ:白色结晶(丙酮),mp:213~214 ℃。分子式:C7H6O3,ESI-MS:m/z 121[M-OH]+。1H-NMR(CD3OD,500 MHz)δ:7.96(2H,d,J=8.0 Hz,H-2,6),6.94(2H,d,J=8.0 Hz,H-3,5)。13C-NMR(CD3OD,125 MHz)δ:122.9(C-1),163.7(C-4),131.6(C-2,6),115.8(C-3,5),169.4(1-C=O)。以上数据与文献[3]基本一致,故鉴定该化合物为对羟基苯甲酸。
化合物Ⅳ:白色粉末(吡啶),mp:286~287 ℃。分子式:C35H60O6,m/z:577[M+H]+。Liebermann-Burchard反应呈阳性,Molish反应呈阳性,与β-胡萝卜苷对照品共行TLC,经3种不同极性展开系统[氯仿-甲醇(10 ∶ 1,V/V)、二氯甲烷-甲醇(6 ∶ 1,V/V)、乙酸乙酯-甲醇(7 ∶ 1,V/V)]展开后Rf值均一致,混合后mp不下降,故鉴定该化合物为β-胡萝卜苷。
化合物Ⅴ:白色粉末(甲醇),mp:200~201 ℃。分子式:C7H6O4,ESI-MS:m/z 153[M-H]+。1H-NMR(CD3OD,500 MHz)δ:7.43(1H,d,J=1.8 Hz,H-2),7.51(1H,dd,J=8.0,1.5 Hz,H-6),6.77(1H,d,J=8.4 Hz,5-OH)。13C-NMR(CD3OD,125 MHz)δ:123.9(C-1),117.5(C-2),147.1(C-3),152.5(C-4),117.1(C-5),124.3(C-6),169.6(C-7)。以上数据与文献[4]基本一致,故鉴定该化合物为原儿茶酸。
化合物Ⅵ:无色结晶(石油醚-乙酸乙酯),mp:177~178 ℃。分子式:C15H22O3,ESI-MS:m/z 251[M+H]+。1H-NMR(CD3OD,500 MHz)δ:4.93(1H,s,H-6),4.91(1H,m,H-8),1.96(3H,s,H-13),0.91(3H,s,H-14),1.06(3H,d,J=6.5 Hz,H-15)。13C-NMR(CD3OD,125 MHz)δ:28.1(C-1),19.5(C-2),28.3(C-3),32.1(C-4),45.1(C-5),71.1(C-6),162.9(C-7),77.5(C-8),35.2(C-9),35.4(C-10),122.9(C-11),176.0(C-12),9.1(C-13),20.4(C-14),15.0(C-15)。以上数据与文献[5]基本一致,故鉴定该化合物为6β-羟基-艾里莫芬-7(11)-烯-12,8β-内酯。
化合物Ⅶ:无色结晶(石油醚-乙酸乙酯),mp:170~171 ℃。分子式:C15H22O3,ESI-MS:m/z 251[M+H]+。1H-NMR(CD3OD,500 MHz)δ:1.80(3H,s,H-13),0.92(3H,s,H-14),0.81(3H,d,J=6.0 Hz,H-15),2.65(1H,d,J=14.6 Hz,H-6a),2.48(1H,d,J=14.6 Hz,H-6b),2.09(1H,dd,J=7.0,12.3 Hz,H-9a),1.88(1H,dd,J=10.9,13.8 Hz,H-9b)。13C-NMR(CD3OD,125 MHz)δ:36.1(C-1),22.6(C-2),28.7(C-3),33.0(C-4),45.2(C-5),30.8(C-6),161.9(C-7),78.5(C-8),41.3(C-9),74.7(C-10),121.2(C-11),174.6(C-12),8.8(C-13),14.2(C-14),16.5(C-15)。以上数据与文献[6]基本一致,故鉴定该化合物为10β-羟基-7(11)-烯-8,12-艾里莫酚内酯。
化合物Ⅷ:无色粉末(石油醚-乙酸乙酯),mp:169~171 ℃。分子式:C15H20O3,ESI-MS:m/z 249[M+H]+。1H-NMR(CD3OD,500 MHz)δ:1.78(2H,m,H-1),1.24(2H,m,H-2),2.09(2H,m,H-3),4.11(2H,m,H-6),1.61(1H,m,H-4),2.32(1H,brd,J=13.2 Hz,H-6b),2.38(1H,d,J=13.2 Hz,H-6a),1.69(3H,s,H-15),0.88(3H,s,H-13),0.93(3H,s,H-14)。13C-NMR(CD3OD,125 MHz)δ:27.1(C-1),30.9(C-2),32.6(C-3),44.4(C-4),47.1(C-5),36.2(C-6),147.2(C-7),149.3(C-8),120.5(C-9),77.6(C-10),123.7(C-11),170.9(C-12),7.9(C-13),15.8(C-14),17.3(C-15)。以上数据与文献[6]基本一致,故鉴定该化合物为10β-羟基-7(11),8(9)-二烯-8,12-艾里莫酚内酯。
化合物Ⅸ:黄色结晶(甲醇),mp:313~315 ℃。分子式:C15H10O7,ESI-MS:m/z 303[M+H]+。1H-NMR(CD3OD,500 MHz)δ:6.15(1H,d,J=2.0 Hz,6-OH),6.35(1H,d,J=2.0 Hz,8-OH),7.69(1H,d,J=2.0 Hz,H-2′ ),7.71(1H,d,J=8.2 Hz,H-5′ ),7.59(1H,dd,J= 8.4,2.0 Hz,H-6′)。13C-NMR(CD3OD,125 MHz)δ:147.3(C-2),175.2(C-4),156.7(C-5),99.2(C-6),164.5(C-7),93.8(C-8),160.3(C-9),104.1(C-10),122.3(C-1′),116.4(C-2′),145.2(C-3′),147.9(C-4′),115.1(C-5′),121.8(C-6′)。以上數据与文献[7]基本一致,故鉴定该化合物为槲皮素。
化合物Ⅹ:黄色粉末(甲醇),mp:225~226 ℃。分子式:C21H20O12,ESI-MS:m/z 465[M+H]+。1H-NMR(CD3OD,500 MHz)δ:6.19(1H,d,J=1.8 Hz,6-OH),6.38(1H,d,J=1.8 Hz,8-OH),7.54(1H,d,J=1.8 Hz,H-2′),6.82(1H,d,J=8.2 Hz,H-5′),7.66(1H,dd,J=8.2,2.0 Hz,H-6′),5.22(1H,d,J=7.3 Hz,H-1″)。13C-NMR(CD3OD,125 MHz)δ:157.1(C-2),135.7(C-3),179.2(C-4),160.5(C-5),100.5(C-6),166.3(C-7),94.3(C-8),158.2(C-9),105.5(C-10),123.3(C-1′),116.2(C-2′),145.6(C-3′),150.1(C-4′),117.9(C-5′),123.7(C-6′),104.3(C-1″),72.9(C-2″),75.2(C-3″),70.5(C-4″),77.3(C-5″),61.8(C-6″)。以上数据与文献[8]基本一致,故鉴定该化合物为金丝桃苷。
化合物Ⅺ:白色结晶(石油醚-乙酸乙酯),mp:181~183 ℃。分子式:C15H27O2,ESI-MS:m/z 240[M+H]+。1H-NMR(CD3OD,500 MHz)δ:4.66(1H,brs,H-12a),4.68(1H,brs,H-12b),1.74(3H,s,H-13),1.16(3H,s,H-14),0.88(3H,s,H-15)。13C-NMR(CD3OD,125 MHz)δ:41.5(C-1),19.5(C-2),42.8(C-3),72.6(C-4),54.4(C-5),25.7(C-6),46.5(C-7),26.2(C-8),44.1(C-9),35.2(C-10),150.6(C-11),110.2(C-12),21.8(C-13),23.1(C-14),18.1(C-15)。以上數据与文献[9]基本一致,故鉴定该化合物为4α-hydroxy-eudesman-11-ene。
化合物Ⅻ:棕黄色结晶(甲醇),mp:193~200 ℃。分子式:C27H30O16,ESI-MS:m/z 611[M+H]+。1H-NMR(CD3OD,500 MHz)δ:7.87(1H,d,J=2.0 Hz,H-2′),7.60(1H,dd,J=8.2,2.0Hz,H-6′),6.83(1H,d,J=8.2 Hz,H-5′),6.17(1H,d,J=1.6 Hz,6-OH),6.36(1H,d,J=1.6 Hz,8-OH),5.05(1H,d,J=7.0 Hz,H-1″)。13C-NMR(CD3OD,125 MHz)δ:158.6(C-2),136.9(C-3),177.3(C-4),160.9(C-5),99.3(C-6),165.1(C-7),94.0(C-8),156.8(C-9),105.2(C-10),123.7(C-1′),116.1(C-2′),145.1(C-3′),149.6(C-4′),116.7(C-5′),122.7(C-6′),104.7(C-1″),73.4(C-2″),75.1(C-3″),70.7(C-4″),74.6(C-5″),67.0(C-6″),101.6(C-1[′][″] ),71.3(C-2[′][″] ),72.1(C- 3[′][″] ),73.7(C-4[′][″] ),70.3(C-5[′][″] ),18.5(C-6[′][″] )。以上数据与文献[10]基本一致,故鉴定该化合物为槲皮素-3-O-洋槐糖苷。
4 讨论
瑶药糯米风所含成分复杂,目前对其活性成分及药理作用的研究尚未见相关报道。有文献指出,千里光属为菊科植物最大的属,该属植物主要含有萜类、生物碱类、酚酸类、黄酮类等化合物,其中以倍半萜和生物碱类化合物为主要活性成分;另外,该属植物具有抗菌、抗病毒、抗肿瘤、抗炎、抗氧化、清除自由基、增强免疫力等作用,可用于眼部疾病、皮肤病、肠炎、痢疾、上呼吸道感染、泌尿生殖系统等疾病的临床治疗[6,11]。本研究对瑶药糯米风75%乙醇提取物的化学成分进行了分析,共分离得到12个化合物,分别鉴定为β-谷甾醇(Ⅰ)、豆甾醇(Ⅱ)、对羟基苯甲酸(Ⅲ)、β-胡萝卜苷(Ⅳ)、原儿茶酸(Ⅴ)、6β-羟基-艾里莫芬-7(11)-烯-12,8β-内酯(Ⅵ)、10β-羟基-7(11)-烯-8,12-艾里莫酚内酯(Ⅶ)、10β-羟基-7(11),8(9)-二烯-8,12-艾里莫酚内酯(Ⅷ)、槲皮素(Ⅸ)、金丝桃苷(Ⅹ)、4α-hydroxy-eudesman-11-ene(Ⅺ)、槲皮素-3-O-洋槐糖苷(Ⅻ)。上述成分分别属于萜类、酚酸类、黄酮类等,与该属化合物的基本特征相符[6,11-12]。此外,药理学研究指出,豆甾醇具有抗肿瘤、抗炎、抗氧化、降低胆固醇和改善记忆等作用[13],金丝桃苷具有抗急性肝损伤、抗抑郁、抗炎、抗血栓、抗肿瘤、抗菌等药理作用[14],后续药理学研究可以此为参考展开。本研究所得化合物Ⅰ~Ⅻ均为首次从该植物中分离得到,可为瑶药糯米风抗炎、抗病毒等药理活性的研究提供物质基础。
参考文献
[ 1 ] 广西壮族自治区食品药品监督管理局.广西瑶族习用药材质量标准:第1卷[M].南宁:广西科学技术出版社,2014:157.
[ 2 ] 何达海,梁天宇,丁克毅,等.黄苞南星的化学成分研究[J].西南民族大学学报(自然科学版),2017,43(3):263-267.
[ 3 ] 林建斌,赵立春,郭建忠,等.金荞麦地上部分化学成分的研究[J].中草药,2016,47(11):1841-1844.
[ 4 ] 靳鑫,时圣明,张东方,等.穿心莲化学成分的研究:Ⅱ[J].中草药,2014,45(2):164-169.
[ 5 ] 苏日娜.药用植物菊状千里光化学成分研究[D].北京:中央民族大学,2012.
[ 6 ] 李笑颜.藏药川西千里光化学成分研究[D].兰州:兰州理工大学,2010.
[ 7 ] 李运,王晓丽,宋家玲,等.栀子叶化学成分[J].中国实验方剂学杂志,2016,22(13):68-70.
[ 8 ] 徐方辉,丁宇翔,王强.黄海棠乙酸乙酯部位的化学成分研究[J].中药材,2016,39(2):322-325.
[ 9 ] 魏宏博.菊科植物密齿千里光化学成分研究[D].兰州:兰州大学,2013.
[10] 李汝鑫,程锦堂,焦梦娇,等.钩藤叶化学成分研究[J].中草药,2017,48(8):1499-1505.
[11] 卢鹏. 3种民族地区菊科植物的化学成分研究[D].北京:中央民族大学,2010.
[12] 陶金华,段金廒,钱大玮,等.菊属药用植物资源化学研究进展[J].中国现代中药,2016,18(9):1212-1219、1229.
[13] 周志远,卢群,刘洋,等.豆甾醇的研究及开发进展[J].中国当代医药,2015,22(24):15-17.
[14] 李锦松,陈剑鸿,孟民杰.金丝桃苷药理作用及其作用机制的研究进展[J].广东药学院学报,2015,31(2):269- 272.
(收稿日期:2019-02-01 修回日期:2019-08-01)
(编辑:张元媛)

