重金属污染胁迫下接种AMF对玉米生长和镉铅含量的影响
游义红 李博 李明锐 秦丽 湛方栋



摘 要:通过盆栽试验,以会泽铅锌矿区污染土壤为供试土壤,玉米为宿主植物,接种会泽铅锌矿周边农田土著丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)与优势种群摩西管柄囊霉(Funneliformis mosseae),研究AMF对玉米生长、矿质营养、镉铅含量与累积的影响,结果表明:接种土著AMF和F.mosseae均显著增加玉米的株高和生物量,提高植株磷钾含量与氮、磷、钾吸收量;增加玉米根际土壤球囊霉素相关蛋白(Glomalin-related soil protein,GRSP)含量,降低土壤有效态镉、铅的含量与植株镉、铅的含量,但对玉米镉、铅累积量没有显著的影响。相关分析表明,土壤速效磷、钾含量与玉米磷、钾含量呈显著正相关,玉米磷、钾含量又与植株生物量呈显著正相关;玉米根际土壤GRSP含量与有效态铅含量呈极显著负相关,根际有效态镉、铅的含量与植株镉、铅含量呈显著正相关。可见,接种AMF改善宿主作物矿质营养,促进植株的生长;降低土壤镉铅有效态含量,从而减少作物体内镉铅的含量。结果可为重金属污染土壤的作物生产安全与农业安全利用提供理论和实践依据。
关键词:丛枝菌根真菌;矿质营养;生物有效性;镉铅含量;生态效应
中图分类号:X172
文献标识码:A
文章编号:1008-0457(2019)03-0038-08 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.03.008
Abstract:A pot experiment was conducted to inoculate arbuscular mycorrhizal fungi and dominant population Funneliformismosseae from farmland around Huize Lead-Zinc Mine. We used contaminated soil from Huize Lead-Zinc Mine as test soil and maize as the host plant to understand the effects of AMF on maize growth,mineral nutrition,cadmium (Cd) and Plumbum (Pb) content. The experimental results showed that native AMF and F. mosseae inoculation significantly increased plant height and biomass,and increased the content of nitrogen,phosphorus and potassium in plant phosphorus and potassium uptake. The inoculation also increased the maize rhizosphere soil Glomalin related protein (GRSP) content. Besides,the application of native AMF and F. mosseae reduced soil available Cd and Pb and the content of Pb and Cd in plants. Correlation analysis showed that the content of soil available phosphorus and potassium had a positive correlation with maize phosphorus and potassium content. The content of P and K in maize presented a notable positive correlation with plant biomass. GRSP content in maize rhizosphere soil was extremely negatively correlated with available Pb content,and the content of available Cd and Pb in rhizosphere was positively correlated with the content of Cd and Pb in the plant. It can be seen that the inoculation of AMF could improve mineral nutrition of host crops and promote plant growth. And then the decreasing available content of Cd and Pb in soil could further reduce the content of Cd and Pb in crops. These results can provide a theoretical and practical basis for crop production safety and safe agricultural utilization of heavy metal contaminated soil.
Key words:arbuscular mycorrhizal fungi; mineral nutrition; bioavailability; Cd and Pb content; ecological effects
隨着工业化和城市化的快速发展,土壤重金属污染已成为不容忽视的环境问题。2014年,由环境保护部和国土资源部联合发布的《全国土壤污染状况调查公报》显示,我国农田土壤点位超标率为19.4%,其中最为突出的是Cd、Ni和Cu等重金属污染状况[1]。土壤重金属污染日益严重导致土壤肥力退化、农作物产量和品质下降,严重影响环境质量和经济的可持续发展,威胁到人们的食品安全[2]。矿业开发、工业排放、农用化学品(化肥、农药等)投入、污水灌溉等输入土壤的镉与地球化学高背景叠加,造成西南喀斯特地区土壤镉累积效应明显 [3]。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是自然界分布最广泛的一类植物共生真菌,约能与80%的陆地植物形成菌根[4]。在重金属胁迫下AMF与植物仍能形成共生体,改善植物的矿质营养与光合生理,促进植物生长 [5],丛枝菌根真菌被认为具有提高植物对重金属污染的抗性、加快矿区等废弃地的植被恢复等作用[6-8],关于 AMF 在植物上的应用已有很多报道,一些试验证实 AM 微生物侵入植物根系后,能够改变根系构型,提高光合作用,促进植物对营养元素的吸收利用,并能提高植株对病原菌、重金属、高盐和弱碱的适应性,AMF在植物适应重金属污染中发挥着重要的作用[9-12],AMF不仅可以通过改变根系形态和根际理化状况来保护植物少受重金属毒害,还能通过自身的螯合作用和过滤作用把重金属固定在孢子和菌丝中[13],尤其是根外菌丝[14-15]。利用AMF与植物共生体系有助于在废弃土地上建立土壤的基本功能,帮助植物从土壤中吸收更多的矿质元素和水分,改善植物营养状况,增强宿主对重金属的耐性,改良土壤结构[16]。同时AMF产生的土壤球囊霉素相关蛋白是土壤的一个重要碳库,可以增强土壤团聚体的稳定性,改善土壤结构和质量[17]。
云南矿产资源丰富,素有“有色金属王国”之称,铅锌矿储量居全国首位,由于铅锌矿的大量开采,所以相较于其他省,云南省土壤重金属污染的问题较为突出[19],本研究以云南省会泽县矿区冶炼厂周围废弃的农田土壤为供试土壤,以不接种为对照(CK),以接种土著AMF(arbuscular mycorrhizal fungi)和摩西管柄囊霉(Funneliformis mosseae)为处理,进行盆栽试验,测定玉米的生长(株高、生物量)、生理(Cd、Pb含量)等指标,研究接种AMF对玉米生长的影响及Cd、Pb含量和累积量的影响,并分析其原因。本研究对铅锌矿区重金属污染农田的作物生产、农业安全利用有重要的意义。
1 材料与方法
1.1 供试土壤
供试土壤采自云南省会泽县者海镇玛色卡村,E 103o38′12.9″,N 26o34′21.1″,平均海拔2130 m,为高原山地红壤,土壤有机质含量为21.8 g/kg,全氮、全磷和全钾含量分别为1.54 g/kg、1.75 g/kg和7.44 g/kg,碱解氮、速效磷和速效钾含量分别为38.1 mg/kg、71.4 mg/kg、614.3 mg/kg,土壤Cd和Pb含量分别4.59 mg/kg和392 mg/kg,pH值6.11。土壤风干后过2 mm筛,于高压蒸汽灭菌锅中,121℃灭菌2 h,灭菌后取出置于室内敞开环境放置5 d,晾干待用。
1.2 供试植物及无菌苗培育
供试植物:玉米会单4号,为铅锌矿区主栽的玉米品种之一。挑选50粒经过表面消毒,大小一致且籽粒饱满的玉米种子作为试验材料。玉米种子用75%乙醇和10%次氯酸钠表面消毒,消毒后的玉米种子用无菌水漂洗3次,放入垫有浸湿滤纸已灭菌的培养皿中,在 25℃温度下恒温培养3 d,待种子萌发形成幼苗时,挑选无污染且生长一致的幼苗备用。
1.3 供试菌种
土著AMF源自云南省会泽县者海镇玛色卡村农田土壤,以玉米为宿主植物,扩繁AMF,每克土壤含有25~30个孢子,主要种群有球囊霉属(Glomus)、盾巨孢囊霉属(Scutellospora)、巨孢囊霉属(Gigaspora)、原囊霉属(Archaeospora)、近明囊霉属(Claroideoglomus)和其他属群,其中Glomus的相对丰度为61.8%,为优势种群。摩西管柄囊霉(Funneliformis mosseae,BGC YN05)由北京市农林科学院植物营养与资源研究所丛枝菌根真菌种质资源库提供。以玉米为宿主植物,扩繁摩西管柄囊霉,每克土壤含有25~30个孢子。
1.4 试验设计
盆栽试验于2016年5月至7月在云南农业大学试验农场大棚内进行,每个盆栽土量为3.0 kg,露白种子每盆移栽3株,试验处理设对照(CK)、接种土著AMF、接种F.mosseae 3个处理,每个处理重复4次。先将2.5 kg土壤装入花盆中,施加100 g菌剂平铺于移栽玉米种子下面,再铺上0.5 kg灭菌土壤盖住AMF菌剂和玉米种子。在试验的过程中每周每盆施加200 mL霍格兰营养液,采用自然光照,试验过程中控制土壤含水量保持在田间持水量的60%~70%。
1.5 收获与测定
玉米种植 60 d后,測量株高,按照地上部和地下部分别收获。 植物分别经过自来水、去离子水清洗后晾干。随机取1 g新鲜的根系样品放入FAA固定液中浸泡,浸泡后再用去离子水冲洗干净,用滤纸吸干水分用曲利苯蓝-直线截获法测定菌根侵染率[20]。
土壤AMF孢子数测定:采集根际土壤,采用湿筛倾析-蔗糖离心法测孢子数[21]。
土壤球囊霉素相关蛋白含量测定:在121℃、103 kPa条件下,采用焦磷酸钠溶液提取根际土壤球囊霉素相关蛋白(glomalin-related soil protein,GRSP),考马斯亮蓝法染色,分光光度法(595 nm)测定GRSP含量[22]。
土壤有效态重金属的测定:参照鲍士旦《土壤农化分析》[23]方法测定土壤重金属有效态含量,称取过2 mm孔径尼龙筛的风干土25.0 g,置于150 mL具塞三角瓶中,加DTPA-TEA(二乙三胺五乙酸-三乙醇胺)浸提液20 mL,将瓶塞盖紧,于25℃,以180 rpm震荡频率下震荡2 h后,过滤定容至50 mL,采用石墨炉-原子吸收光谱法测定溶液Cd的浓度,火焰-原子吸收光谱法测定Pb的浓度。
植物样品粉碎过100目筛,用于植物Cd、Pb含量以及植株N、P、K的测定。Cd、pb测定:经硝酸-高氯酸(高氯酸∶硝酸=5∶1)消解后,采用火焰原子吸收法测定植株地上部和地下部Cd、Pb含量,累积量为重金属含量与对应干重的乘积; N、P、K测定:参照鲍士旦《土壤农化分析》[23]。
1.6 数据处理
试验数据采用Microsoft Excel和SPSS 21.0数据处理软件进行统计分析,计算平均值和标准差,用LSD法检验各处理平均值在0.05和0.01水平上的差异显著性。
2 结果与分析
2.1 菌根侵染及植株生长情况
由表1可见,对照处理没有检测到孢子和菌根侵染结构,接种土著AMF和F.mosseae均能对玉米根系形成有效侵染,侵染率分别为31.35%、47.44%,接种F.mosseae的侵染率显著高于接种土著AMF的侵染率。接种F.mosseae和土著AMF的孢子数分别为22个/g、43個/g,接种F.mosseae土壤中孢子数显著大于土著AMF,说明F.mosseae的产孢率在重金属胁迫下高于土著AMF,与CK相比接种土著AMF和F.mosseae处理的球囊霉素相关蛋白(GRSP)含量均显著增加,分别增加了54%和90%,F.mosseae处理显著高于土著AMF处理。
2.3 AMF对土壤-玉米体系养分含量的影响
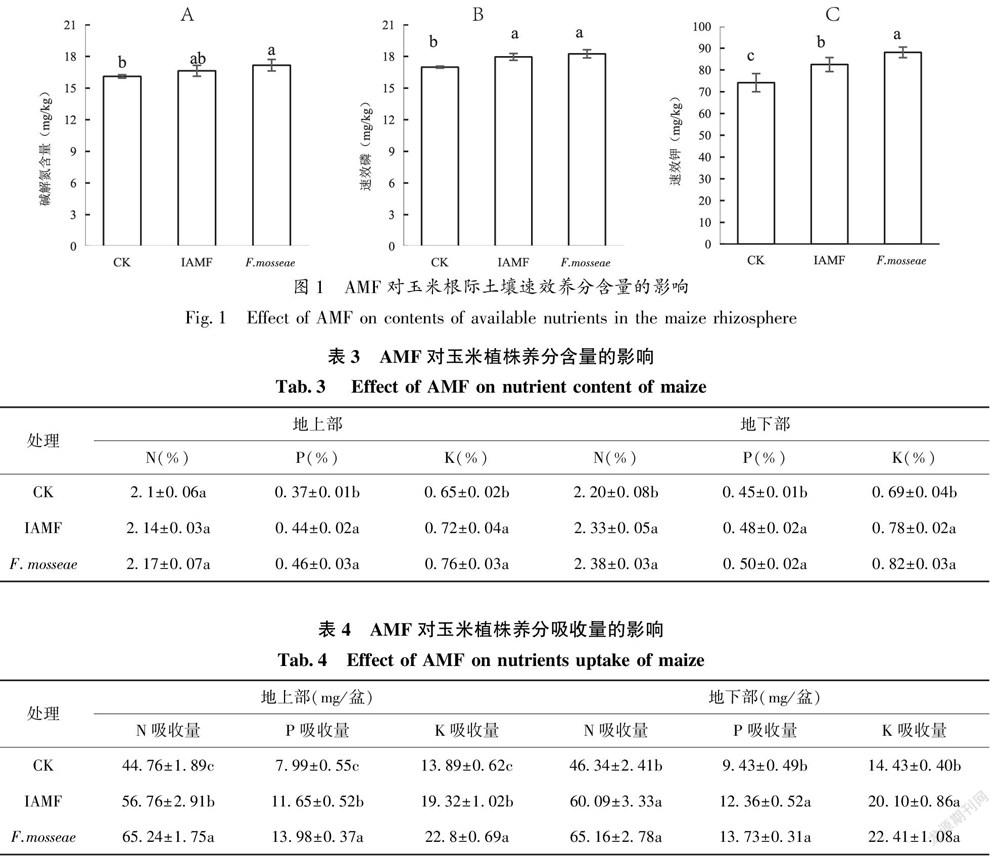
图1可知,接种F.mosseae处理显著增加土壤中碱解氮含量,接种土著AMF变化不显著;接种土著AMF和接种均显著增加了土壤中速效P和速效K含量,其中接种F.mosseae含量最高。并且接种F.mosseae处理土壤速效K含量显著高于接种土著AMF。可见接种F.mosseae处理土壤速效养分的增幅最大。
2.4 AMF对土壤-玉米体系镉铅含量的影响
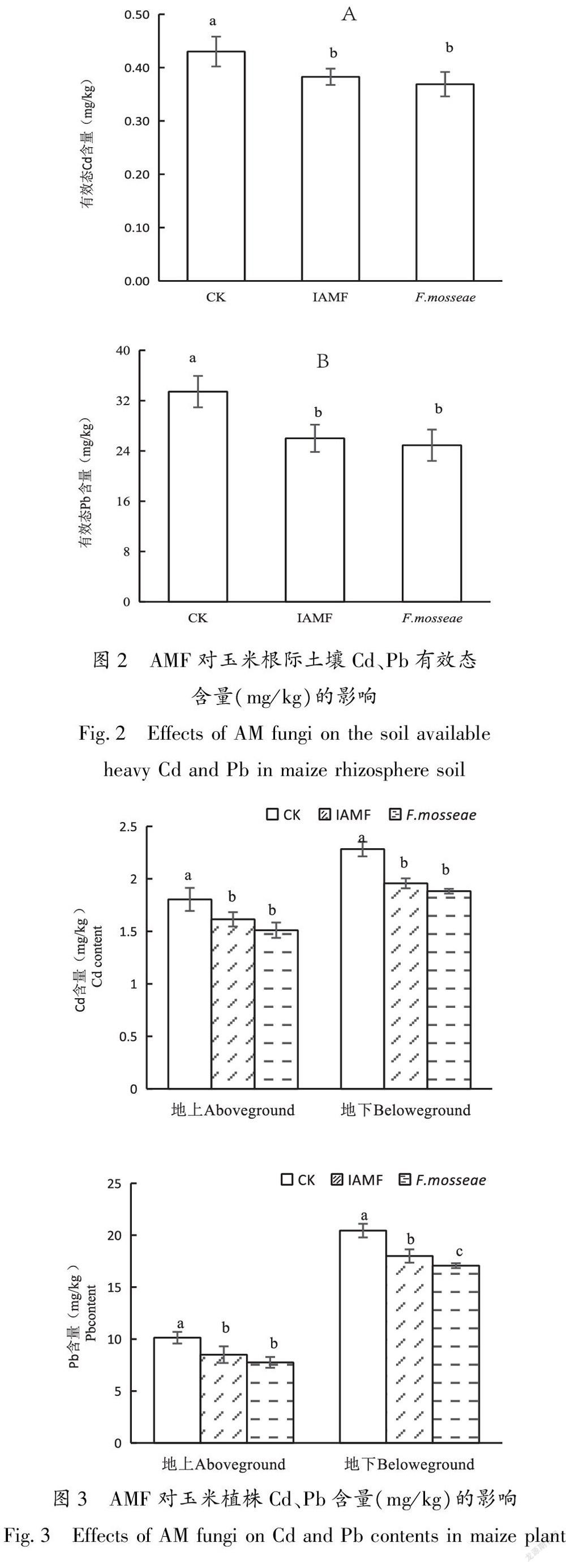
由图2可知,接种土著AMF和摩西管柄囊霉处理均显著降低土壤有效态Cd和Pb的含量,两接种处理之间没有显著差异。接种土著AMF和摩西管柄囊霉降低土壤有效态Cd降幅分别为11.63%和13.95%;对于土壤有效态Pb的降幅分别为14%和25%,接种摩西管柄囊霉处理下土壤有效态重金属的含量最低。
2.5 相关性分析
由表5可知,土壤碱解氮含量与植株含氮量相关性不显著,但速效磷、速效钾与植株磷、钾含量均呈显著正相关关系;由表6可知,除去地上部氮含量与植株氮含量相关性不显著外,植株的磷、钾含量均与植株生物量呈显著正相关关系。
3 结论与讨论
研究表明,AMF能够提高宿主植物在各种胁迫(如干旱、病虫害、重金属等)环境下的生存能力 [19]。总体来说,过量的 Cd 、Pb会导致植物细胞膜系统、蛋白质、核酸等生物大分子受到损害,从而抑制植物的生长和光合作用[24-27]。本研究中,无论接种摩西管柄囊霉还是土著AMF均显著提高了重金属胁迫下玉米的生物量,表明AMF提高了玉米对重金属胁迫的耐受性,促进植株的生长。AMF促进植株对矿质营养的吸收,AMF具有庞大的菌丝网,根外菌丝的延伸作用,使植株能从根系不能到达的区域吸收矿质营养,以满足自身生长的营养需求从而促进植株的生长[28]。同时接种AMF还能促进植株的光合作用,AMF 通过促进植株的电子传递速率,提高PSⅡ反应中心的反应效率和能量利用效率,从而促进植株光合作用[29]。
本研究中接种AMF增加了土壤玉米植株N、P、K含量和累积量,说明接种AMF能够促进植株矿质营养的吸收。通过相关性分析发现土壤速效P、K的含量与植株P、K含量和生物量呈显著正相关,说明AMF通过改变土壤速效养分的含量从而影响植株对N、P、K的吸收和累积。AMF促进植株对N、P、K的吸收和累积主要有两方面的因素,首先庞大的菌丝网络,能够扩大植物吸收养分的面积,增加土壤矿质营养的空间有效性[30-31];其次菌根分泌物的活化作用,能够提高土壤中N、P、K的有效性,AMF可以促进根际难溶性矿质营养的溶解,有利于难溶矿质元素的活化利用[32-33]。本研究发现接种AMF能够显著提高土壤中速效养分的含量,土壤中速效养分的含量,均是接种摩西管柄囊霉高于土著AMF,研究表明土壤中速效养分的的含量与菌根侵染率显著相关,且接种摩西管柄囊霉的侵染率显著高于土著AMF,这些结果与王瑾等[34]的研究结果一致。
本研究中无论是接种摩西管柄囊霉还是土著AMF都显著降低了植株地上部和地下部的Cd、Pb含量,根际土壤中有效态重金属的含量会影响植株对重金属的吸收和转运,AMF通过改变根际土壤有效态重金属的含量,从而影响植株对重金属的吸收。本研究中接种土著AMF和摩西管柄囊霉显著降低了根际土壤中有效态Cd、Pb的含量,通过相关性分析发现土壤球囊霉素相关蛋白(GRSP)与土壤有效态镉、铅含量呈负相关,有效态Cd、Pb含量与植株Cd、Pb呈显著正相关,说明AMF通过产生土壤球囊霉素来减少根际土壤Cd、Pb有效态含量,影响植株对于重金属的吸收,从而影响植株重金属的含量。
AMF影响土壤中重金属有效性主要有两种途径:首先AMF有庞大的根外菌丝网络可以吸附和吸收重金属,降低重金属的有效性,减少其进入植物体内的量。菌丝表面具有较强的吸附作用,菌丝体细胞壁中的几丁质、纤维素、土壤球囊霉素、游离氨基酸、羧基和羟基官能团等能固定重金属 [35-36];菌丝能够吸收重金属,根外菌丝可以扩大吸收重金属的面积 [37-38],重金属进入菌丝细胞体内,细胞内特定的重金属络合蛋白、有机酸能与重金属结合,形成重金属晶体或沉淀[39-40]。 其次AMF会影响植物的根系分泌物,且其自身也可向土壤分泌粘液、聚磷酸盐、有机酸等与重金属离子结合[41],或者通过改变根际土壤pH,间接改变土壤重金属的有效性[42]。重金属胁迫下,现有研究关于AMF对植物重金属吸收的影响有三种观点,接种AMF增加、降低、不影响植物体内的重金属含量[43-45]。影响AMF对植物吸收重金属效果的因素有很多,重金属污染的类型、不同宿主植物的种类和根际土壤AMF的种类以及植物生长的环境条件[46],都会影响AMF对植物吸收重金属的效应。
本研究中无论是接种土著AMF还是摩西管柄囊霉均能提高植株的生物量,降低植株Cd、Pb含量,这对于会泽铅锌矿区重金属污染土壤的农业生产具有重要意义。玉米在一定重金属污染程度的土壤中仍能生存,表明其具有一定的重金属耐性,我国耕地少,将重金属污染的农田闲置的代价过高,可以在重金属污染农田种植生长迅速且快熟的玉米[47-48]、甘蔗[49]等能源作物。接种AMF可以缓解重金属对植物生长的胁迫,提高其生物量。
接种土著AMF和摩西管柄囊霉均不同程度的减缓了Cd、Pb对玉米的毒害作用,AMF能够促进玉米植株的生长,接种处理显著增加了玉米地上、地下部以及总的生物量;接种处理显著增加了植株P、K的含量以及植株N、P、K的累积量;接种处理降低了玉米植株地上部和地下部的重金属含量。
参 考 文 献:
[1] 陈卫平,杨 阳,谢 天,等.中国农田土壤重金属污染防治挑战与对策[J].土壤学报,2018,55(2):261-272.
[2] 蔡美芳,李开明,谢丹平,等.我国耕地重金属污染现状与污染防治对策研究[J].環境科学与技术,2014,37(S2):223-230.
[3] 刘鸿雁,涂 宇,顾小凤,等.地球化学高背景农田土壤重金属镉的累积效应及环境影响[J].山地农业生物学报,2018,37(05):1-6.
[4] Wang B,Qiu Y L. Phylogenetic distribution and evolution of mycorrhizas in land plants[J].Mycorrhiza,2006,16(5):299-363.
[5] Amna Ali N,Masood S,Mukhtar T,Kamran MA,et al. Differential effects of cadmium and chromium on growth,photosynthetic activity,and metal uptake of Linum usitatissimum in association with Glomus intraradices [J]Environ Monit Assess,2015,187(6):311.
[6] Bedini S,Turrini A,Rigo C,et al. Molecular characrterization and gloma in production of arbuscular mycorrhizal fungi colonizing heavy metal pollute dash disposal island,downtown Venice [J]Siol Biology and Biochemistry,2010,42(5):758-765.
[7] Chen B D,Zhu Y G,Smith F A. Effects of arbuscular mycorrhizal inoculation on uranium and arsenic accumulation by Chinese brake fern(Pteris vittata L.)from a uranium mining-impactedsoil[J]Chemosphere,2006,62(9):1464-1473.
[8] Wang F Y,Lin X G,Yin R,et al. Effects of arbuscular mycorrhizal inoculation on the growth of Elsholtzia splendens and Zea mays and the activities of phosphatase and urease in amulti-metal-contaminated soil under sterilized conditions[J]Applied Soil Ecology,2006,31(1):110-119.
[9] 蔡柏岩,葛菁萍,接伟光,等.黄檗根围丛枝菌根真菌菌群组成[J].菌物学报,2009,28(4):512-520.
[10] Elsen A,Gervacio D,Swennen R,et al. AMF-induced biocontrol against plant parasitic nematodes in Musa sp.:a systemic effect[J].Mycorrhiza,2008,18(5):251-256.
[11] Colla G,Rouphael Y,Cardarelli M,et al.Alleviation of salt stress byarbuscular mycorrhizal in zucchini plants grown at low and high phosphorus concentration[J].Biology and Fertility of Soils,2008,44(3):501-509.
[12] Carvalho L M,Cacador I,Martins-Loucao M A,Arbuscular mycorrhizal fungi enhance root cadmium and copper accumulation in the roots of the salt marsh plant Aster tripolium L[J].Plant and Soil,2006,285(1):161-169.
[13] Chen B,Christie P,Li X. A modified glass bead compartment cultivation system for studies on nutrient and trace metal uptake by arbuscular mycorrhiza[J].Chemosphere,2001,42(2):185-192.
[14] Joner E J,Briones R,Leyval C. Metal-binding capacity of arbuscular mycorrhizal mycelium[J].Plant and Soil,2000,226(2):227-234.
[15] Gonzalez-Chavez C,D’haen J,Vangronsveld J,et al. Copper sorption and accumulation by the extraradical mycelium of different Glomus spp.(arbuscular mycorrhizal fungi)isolated from the same polluted soil[J].Plant and Soil,2002,240(2):287-297.
[16] 赵 昕,吴子龙,吴运东,等.丛枝菌根真菌-植物修復矿区重金属污染土壤的研究进展[J].化工环保,2018,38(04):369-372.
[17] 郭雄飞. 生物炭和AM真菌对重金属污染下土壤养分及望江南生长的影响[J].草业学报,2018,27(11):150-161.
[18] 李少朋,毕银丽,陈昢圳,等.外源钙与丛枝菌根真菌协同对玉米生长的影响与土壤改良效应[J].农业工程学报,2013,29(01):109-116.
[19] 刘 芳,景戍旋,胡 健,等.镉污染和接种丛枝菌根真菌对紫花苜蓿生长和氮吸收的影响[J].草业学报,2017,26(02):69-77.
[20] 刘 敏,峥 嵘,白淑兰,等.内蒙古大青山土庄绣线菊根围丛枝菌根真菌群落垂直分布特征[J].菌物学报,2017,36(03):292-301.
[21] Gerdemann JW,Nicolson TH. Spores of mycorrhizal Endogone,species extracted from soil by wet sieving and decanting [J].Transactions of the British Mycological Society,1963,46(2):235-244.
[22] 鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,2000.
[23] Smith S E,Read D J. Mycorrhizal symbiosis[M].Cambridge:Academic press,2008.
[24] 刘 芳,景戍旋,胡 健,等.镉污染和接种丛枝菌根真菌对紫花苜蓿生长和氮吸收的影响[J].草业学报,2017,26(02):69-77.
[25] 张金彪,黄维南. 镉对植物的生理生态效应的研究进展[J].生态学报,2000,20(5):514-523.
[26] Sharma P,Dubey RS. Plumbum toxicity in plants[J].Brazilian Journal of Plant Physiology,2005,17:35-52.
[27] 王 立,安广楠AMF 对镉污染条件下水稻抗逆性及根际固定性的影响[J].农业环境科学学报2014,33(10):1882-1889.
[28] 郑舜怡,郭世荣,张 钰,等.丛枝菌根真菌对辣椒光合特性及根际微生物多样性和酶活性的影响[J].西北植物学报,2014,34(4):800-809.
[29] 吴洁婷,杨东广,王 立,等.植物-菌根真菌联合修复重金属污染土壤[J].微生物学通报,2018,45(11):2503-2516.
[30] 王 琦,王丽萍,尹宁宁,等.AMF接种的复垦土壤中有机碳形成的研究现状与发展[J].煤炭科学技术,2018,46(08):220-226.
[31] 张玉风,冯 固,李晓林. 丛枝菌根真菌对三叶草根系分泌的有机酸组分和含量的影响[J].生态学报,2003,23(1):30-37.
[32] 李少朋,毕丽银,彭 星,接种丛枝菌根对矿井水回灌玉米生长的影响[J].江苏农业科学,2016,44(5):112 -115.
[33] 王 瑾,毕银丽,邓穆彪.丛枝菌根对采煤沉陷区紫穗槐生长及土壤改良的影响[J].科技导报,2014,32(11):26-32.
[34] González-Chávez MC,Carrillo-González R,Wright SF,The role of glomalin,aprotein produced byarbuscular mycorrhizal fungi,in sequestering potentially toxic elements[J].Environmental Pollution,2004,130:317-323.
[35] Zhou JL. Zn biosorption by Rhizopus arrhizus and other fungi[J].Applied Microbiology Biotechnology,1999,51:686-693.
[36] 黄 晶, 凌婉婷,孙艳娣,等.丛枝菌根真菌对紫花苜蓿吸收土壤中镉和锌的影响[J].农业环境科学学报,2012,32(1):99-105.
[37] 班宜辉,徐舟影,杨玉荣,等.不同程度铅锌污染区从枝菌根真菌和深色有隔内生真菌侵染特征[J].西北植物学报,2012,32(11):2336-2343.
[38] González-Guerrero M,Azcón-Aguilar C,Ferrol N. GintABC1 and GintMT1 are involved in Cu and Cd homeostasis in Glomus intraradices [R].5th International Conference on Mycorrhiza,“Mycorrhiza for Science and Society,” Granada,Spain,2006.
[39] Jankong P,Visoottiviseth P. Effects of arbuscular mycorrhizal inoculation on plants growing on arsenic contaminated soil[J].Chemospher,2008,72:1092-1097.
[40] 王发园,林先贵,周健民. 从枝菌根真菌与土壤修复[J].土壤2008,36(3):251-257.
[41] Rufyikiri G,Thiry Y,Declerck S. Contribution of hyphae and roots to uranium uptake and translocation by arbuscular mycorrhizal carrot roots under root-organ culture conditions[J].New Phytologist,2003,158(2):391-399.
[42] Liang CC,Li T,Xiao YP. Effects of inoculation with arbuscular mycorrhizal fungi on maize grown in multi-metal contaminated soils[J].International Journal of Phytoremediation,2009,11(8):692-703.
[43] Vogel-Mikus K,Pongrac P,Kump P. Colonisation of a Zn,Cd and Pb hyperaccumulator Thlaspi praecox Wulfen with indigenous arbuscular mycorrhizal fungal mixture induces changes in heavy metal and nutrient uptake[J].Environ Pollut,2006,139(2):362-371.
[44] Wang F Y,Lin X G,Yin R. Effect of arbuscular mycorrhizal fungal inoculation on heavy metal accumulation of maize grown in a naturally contaminated soil[J].Phytoremediation,2007,9(4):345-353.
[45] 單明娟,秦 华,陈俊辉,等.从枝菌根真菌侵染及多氯联苯去除的影响[J].应用与环境生物学报,2018,24(03):470-477.
[46] 刘宛如,张 磊,杨惟薇,等.外源有机酸对红蛋植物吸收和转运镉的影响[J].土壤通报,2014,45(1):205-209.
[47] Meers E,Van Slycken S,Adriaensen K,et al. The use of bio- energycrops(Zea mays)for phytoattenuation of heavy metals on moderately contaminated soils:A field experiment[J].Chemosphere,2010,78(1):35-41.
[48] Arbaoui S,Evlard A,Mhamdi MEW,et al. Potential of kenaf(Hibiscus cannabinus L.)and corn(Zea mays L.)for phytoremediation of dredging sludge contaminated by trace metals[J].Biodegradation,2013,24(4):563-567.
[49] Akkajit P,Desutter T,Tongcumpou C. Effects of sugarcane waste-products on Cd and Zn fractionation and their uptake by sugarcane(Saccharum officinarum L.)[J].Environmental Science:Processes &Impacts,2014,16(1):88-93.

