一个新型的药物递送系统
——红细胞膜仿生纳米粒
黄际薇,姜彩云,罗宇燕,郭喆霏,张永明
(中山大学附属第三医院药剂科,广东 广州 510630)
人体内存在大量丰富的红细胞,红细胞作为药物输送的载体已经被人们广泛研究[1]。它具备许多优势使得其成为优良的药物输送载体,如良好的生物相容性、超长的体内循环时间、可以延缓药物的释放等[2]。但是由于红细胞的活动范围仅限于血管内部,使得其众多的优良特性在治疗中存在一定的局限性[3]。为此,近年来采用天然红细胞膜作为外壳来包载合成的纳米粒内核,使其伪装成内源性物质,制备得到核壳结构的红细胞膜纳米载体,能够减少网状内皮系统的摄取和免疫识别[4-5]。本研究制备红细胞膜仿生纳米粒(red blood cell membranes biomimetic nanoparticles,RBCM-NP),具有红细胞膜(red blood cell membranes,RBCM)作为药物输送的优点,提高药物稳定性[6]。本研究通过调整挤压次数、纳米粒与红细胞膜的比例来制备不同处方的RBCM-NP,优化处方红细胞膜能够完全包裹住纳米粒,构建一个新型的药物递送系统——RBCM-NP递药体系。
1 材料与仪器
1.1 试剂与动物
聚乙二醇-聚(乳酸-乙醇酸)共聚物(PEG2000-PLGA3.8万,济南岱罡生物工程有限公司);50~60 d SPF级SD雄性大鼠(120~140 g,广东省医学实验动物中心,SCXK(粤)2013-0002);生物素化PEG-PLGA(Biotin-PEG2000-PLGA3.8万,厦门研科生物技术有限公司);链霉亲和素(streptavidin,ST)(S9170,北京索莱宝);其他试剂均为分析纯。
1.2 仪器
SL16/40 ( R) 冷冻离心机 (美国Thermo公司);92SM-202A电子天平(瑞士Precisa公司);Mastersizer 2000 激光粒度仪 (英国马尔文仪器有限公司);透射电子显微镜(日本Jeol Jem-1230)。
2 方 法
2.1 NP体系的构建
采用反溶剂法制得NP:PEG-PLGA 25 mg溶于2.5 mL丙酮,逐滴加入5 mL泊洛沙姆溶液(w=0.25%)中,减压除去有机溶剂,超滤管离心收集,磷酸盐缓冲液(phosphate buffer,PB)中再分散,即得空白NP。
2.2 NP体系的表征
2.2.1 粒径和Zeta电位 取上述制备所得的NP于室温下用粒度测定仪测定粒径和Zeta电位。
2.2.2 透射电镜表征NP的形态 测试样品滴至透射电镜专用铜网,孵育后滤纸吸去残留液体,再用2 g/L磷钨酸染色液染色。
2.2.3 稳定性 NP分散在4 ℃ PB中,形成5 mg/mL的质量浓度于0,3 ,9 d测定NP的粒径。
2.3 RBCM-NP体系的构建
2.3.1 RBCM的制备 制备红细胞悬液: 取大鼠腹主动脉血,收集血液,离心,525 r/min×20 min×4 ℃;吸弃血浆和白膜层。等渗 PB(300 mOsm/L)洗3次,等体积300 mOsm/L PB重悬制成红细胞悬液备用。溶血:取2 mL红细胞悬液加至28 mL低渗PB (20 mOsm/L);混匀后离心,10 500 r/min×40 min×4 ℃; 弃上清,重复上述操作3次,得RBCM。
2.3.2 RBCM-NP的构建 采用脂质体挤压法,将RBCM使用脂质体挤压器挤压过400 nm孔径的膜,21次。将制备好的RBCM与NP进行混合,使用脂质体挤压器挤压过200 nm孔径的膜数次,得到RBCM-NP。
2.4 RBCM-NP的表征
2.4.1 粒径和Zeta电位 取上述制备所得的RBCM-NP用粒度测定仪测定粒径和Zeta电位。
2.4.2 RBCM覆盖程度 生物素化纳米粒(biotinylated nanoparticle, BTNP),制备方法见2.1。RBCM仿生BTNP(red cell membranes biomimetic biotinylated nanoparticle,RBCM-BTNP),制备方法见2.3。利用BTNP与ST孵育会发生聚集反应来研究红细胞膜的覆盖程度。BTNP和RBCM-BTNP分别与ST孵育30 min后,检测BTNP和RBCM-BTNP的粒径。
3 结 果
3.1 NP的表征
采用反溶剂法制得NP,重复性良好,粒径分布均一,为(101.80 ± 2.55) nm,Zeta电位为((-12.87)±(-0.25)) mV,多分散指数为0.045。检测NP在0,3 ,9 d的粒径变化情况,没有显著性差异(见图1和图2)。

图1 NP粒径分布图Fig.1 Diameter distribution of NP
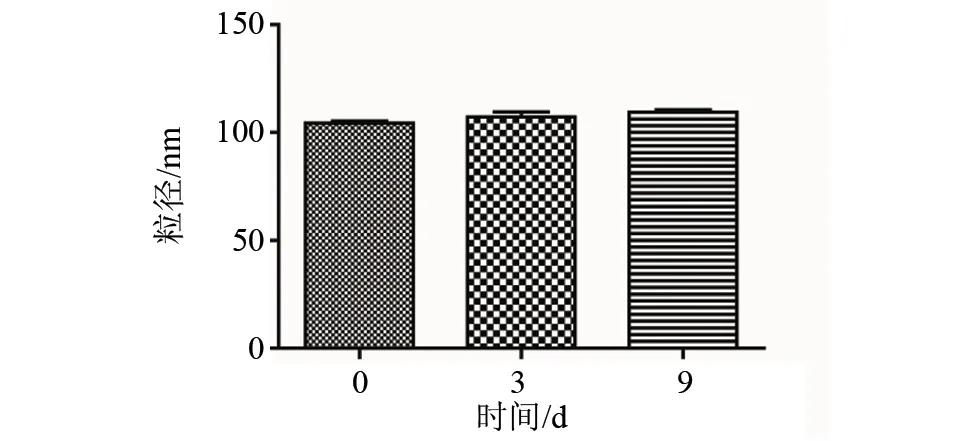
图2 NP的粒径变化 (NP分散在PB中,于0,3,9 d测定NP的粒径,n=3)Fig.2 Changes of size of NP(NP are dispersed in PB, and the diameter size is measured at 0 , 3 and 9 d, n=3)
3.2 RBCM-NP的处方优化
采用脂质体挤压法,制备RBCM-BTNP,在透射电镜下能够发现外周包裹了一层膜结构,而单独NP是没有的(见图3)。
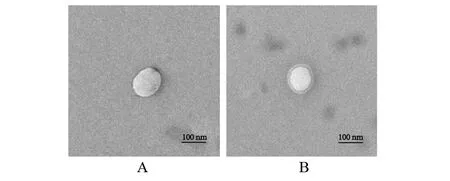
图3 NP和RBCM-NP的透射电镜图(A: NP;B: RBCM-NP)Fig.3 TEM of NP and RBCM-NP(A: NP;B: RBCM-NP)
为了进一步优化处方,按照不同配比采用脂质体挤压法制备不同处方的RBCM-NP。取不同体积的血液提取RBCM,最终用0.5 mL的等渗PB稀释备用,采用脂质体挤压法,将0.5 mL RBCM溶液使用脂质体挤压器挤压过400 nm孔径的膜,21次。同时取不同浓度的NP溶液0.1 mL,将制备好的的RBCM与NP进行混合,再使用脂质体挤压器挤压过200 nm孔径的膜数次,具体配比参照表1进行制备。
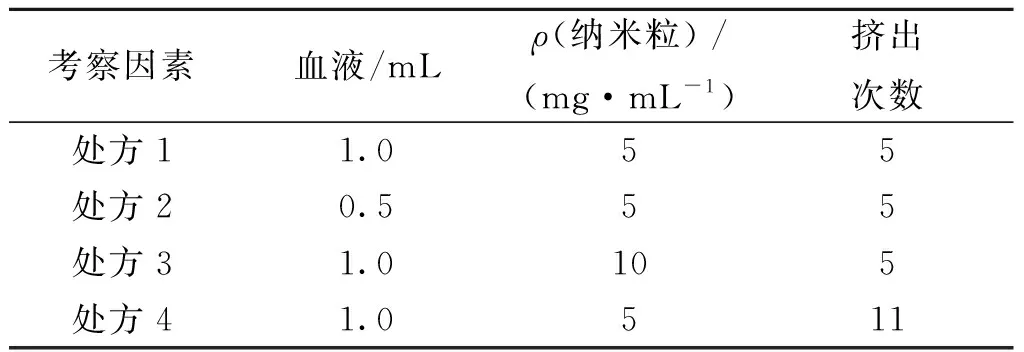
表1 不同处方制备红细胞膜纳米粒Table 1 RBCM-NP by different prescriptions
在电镜的视野下,处方1和处方2视野相对比较清晰。处方4视野比较杂乱,散乱的细胞膜比较多(见图4)。同时检测了四个处方的Zeta电位,Zeta电位的绝对值越高说明该处方越稳定,相对于处方1,处方4的Zeta电位的绝对值较高(P< 0.05),处方2和处方3较低(P< 0.01),见图5。结合上述结果,处方1相对其他处方较好。处方1制备的RBCM-NP,粒径分布均一(粒径:(110.8 ± 2.29) nm, Zeta电位:((-18.87)±(-0.67)) mV,多分散指数:0.048),为优化处方(见图6)。

图4 不同处方的RBCM-NP的透射电镜图(A:处方1;B:处方2;C:处方3;D:处方4;细箭头代表RBCM-NP;粗箭头代表RBCM)Fig.4 TEM of RBCM-NP by different formulations(A: formulation 1; B: formulation 2; C: formulation 3; D: formulation 4; the thin arrows represent RBCM-NP;the bold arrows represent RBCM)
按照优化处方制备了RBCM-NP和NP,RBCM-NP的Zeta电位明显高于NP(P< 0.01),见图7。
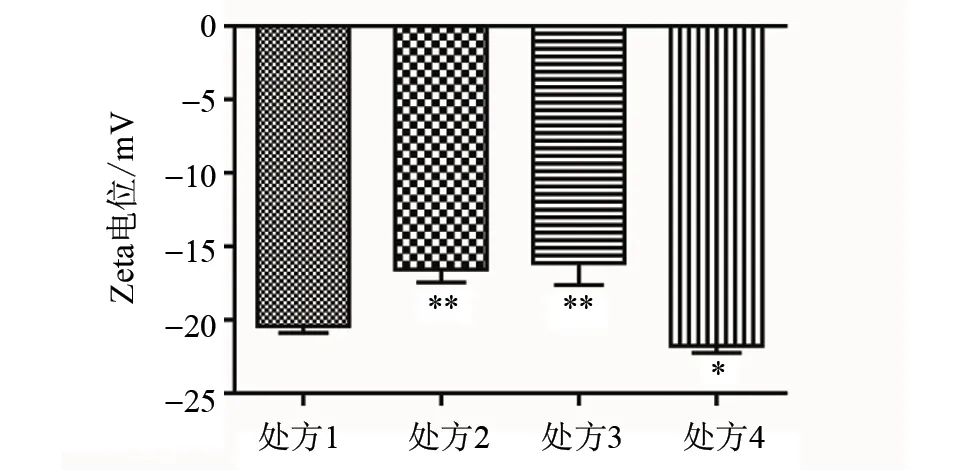
图5 不同处方RBCM-NP的Zeta电位(相对于处方1,*P < 0.05,**P < 0.01;n=3)Fig.5 Zeta potential of RBCM-NP by different formulations (The significant differences are compared to prescription 1, at *P < 0.05, and **P< 0.01; n=3)
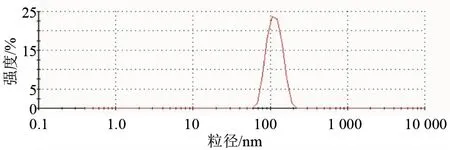
图6 RBCM-NP(处方1)粒径分布图Fig.6 Diameter distribution of RBCM-NP by formulation 1
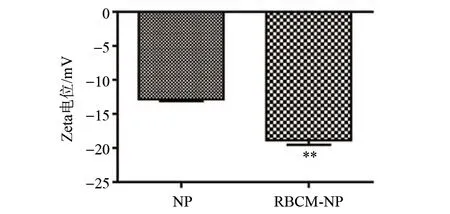
图7 优化处方(处方1)制备RBCM-NP和NP的Zeta电位(相对于NP,**P < 0.01,n=3)Fig.7 Zeta potential of RBCM-NP by formulation 1 (The significant differences are compared to NP, at **P < 0.01; n=3)
3.3 RBCM-NP包载程度的研究
BTNP和按照处方1制备的RBCM-BTNP分别与ST孵育30 min后,分别检测粒径。孵育前后RBCM-BTNP的粒径没有显著性差异,孵育前后BTNP的粒径有显著性差异(P< 0.01)见图8、图9。
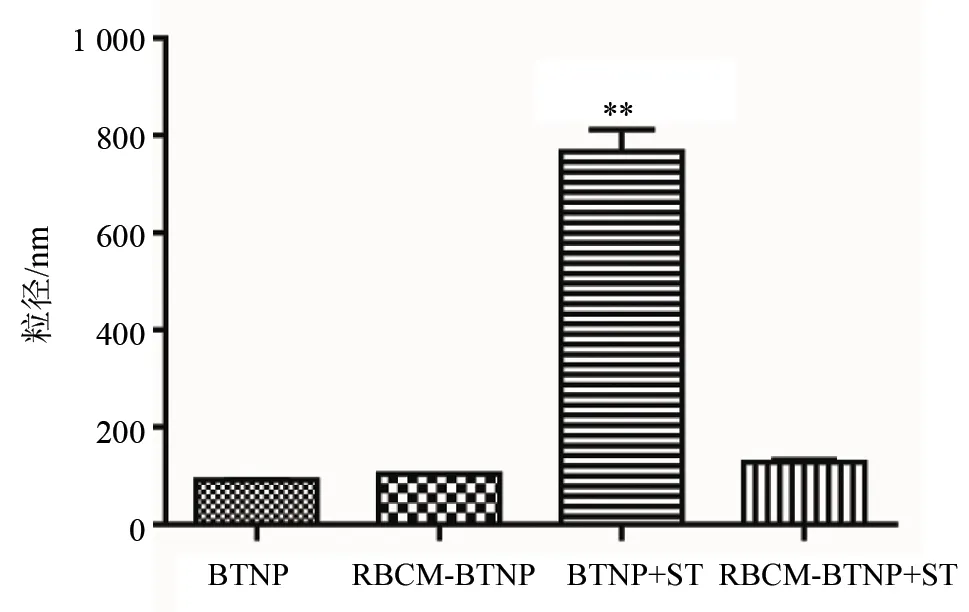
图8 优化处方(处方1)制备RBCM-BTNP和BTNP分别与ST孵育前后的粒径(RBCM-BTNP + ST,BTNP + ST分别代表RBCM-BTNP孵育后和BTNP孵育后;相对于BTNP,**P < 0.01;n=3)Fig.8 The sizes of RBCM-BTNP and BTNP by formulation 1 before and after incubation with ST (RBCM-BTNP + ST:RBCM-BTNP after incubation;BTNP + ST:BTNP after incubation;the significant differences are compared to BTNP, at **P < 0.01; n=3)
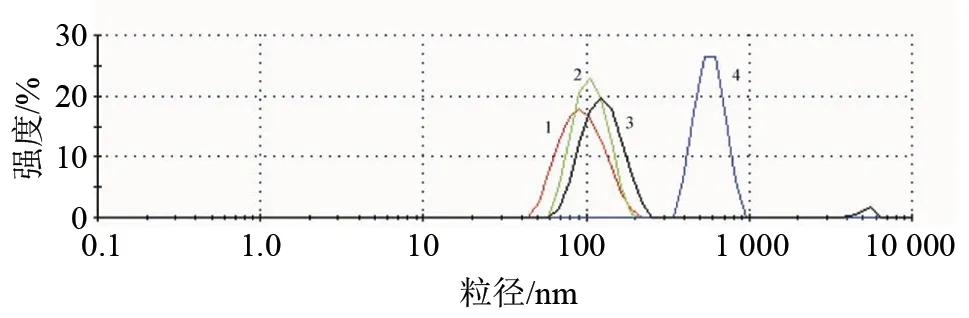
图9 RBCM-BTNP(优化处方:处方1)和BTNP分别与ST孵育前后的粒径分布图(1:BTNP 孵育前;2:RBCM-BTNP 孵育前;3:RBCM-BTNP 与ST孵育后;4:BTNP 与ST孵育后)Fig.9 Diameter distribution of RBCM-BTNP and BTNP by formulation 1 before and after incubation with ST (1 : RBCM-BTNP before incubation; 2 : RBCM-BTNP before incubation; 3 : RBCM-BTNP after incubation with ST; 4 : BTNP after incubation with ST)
4 讨 论
本研究构建一个新型的药物递送系统——RBCM-NP递药体系。本研究采用反溶剂法制得PEG-PLGA的NP粒径分布均一,稳定性好。近年来以PLGA等相关材料作为载体制得的NP在具有良好生物相容性的同时,更能实现药物的可控释放,延长药物的作用时间,减少给药次数,降低药物的毒副作用,改善患者的依从性和治疗效果。然而,NP的表面电荷粒径、形状都可影响其被单核-巨噬细胞摄取[7-8],导致全身给药时到达作用组织的药量减少。
近年来,细胞膜仿生纳米粒在生物与医学领域得到了极大的关注。采用天然细胞膜作为外壳来包载合成的纳米粒内核,使其伪装成内源性物质,不仅减少网状内皮系统的摄取[5],而且能减少免疫识别[9]。 细胞膜的结构与功能,尤其是细胞膜表面的特异性功能蛋白得以保留,得到的细胞膜纳米粒具有合成纳米材料的高度可调的物理化学性质,及宿主细胞膜的高度复杂的功能,制备工艺也相对简单。此外,双层膜结构的包载为跨膜蛋白的锚定提供了绝佳的场所,使制备功能强大的仿生纳米粒成为可能[10]。本研究采用脂质体挤压法将RBCM使用脂质体挤压器挤压过400 nm孔径的膜,21次。将制备好的RBCM与NP进行混合,再使用脂质体挤压器挤压过200 nm孔径的膜数次,成功制备了RBCM-NP,在透射电镜下,可以发现与NP相比,RBCM-NP外周包裹一层膜结构。
为了进一步优化RBCM-NP,我们改变了RBCM与NP的配比和最后挤出次数,通过透射电镜拍摄4个不同的处方。处方4由于挤出次数变多,使细胞膜受到多次冲击,导致细胞膜的破碎,因此处方4视野比较杂乱。处方1为优化处方制备的RBCM-NP粒径分布均一,同时包载了RBCM的NP要比没有膜结构的NP更稳定。处方3由于纳米粒浓度增加,部分纳米粒没有完全被细胞膜包裹,因此处方3的Zeta电位较低,稳定性较差。
本研究构建一个新型的药物递送系统——RBCM-NP递药体系,NP和RBCM-NP粒径均一,优化处方RBCM能够完全包裹住NP,重现性良好,为后期仿生纳米粒的研究提供了理论基础。

