鲤春病毒血症病毒糖蛋白酵母表面展示系统的建立
林婧楠 赵景壮 刘 淼 任广明 卢彤岩 徐黎明
(1. 中国水产科学研究院黑龙江水产研究所, 哈尔滨 150070; 2. 上海海洋大学水产与生命学院, 上海 201306)
鲤春病毒血症(Spring Virernia of Carp, SVC)是由鲤春病毒血症病毒(Spring Virernia of Carp Virus,SVCV)引起的, 可造成多种鲤科鱼类高死亡率的一种病毒病[1]。该病常暴发于春季, 可引起鲤科鱼类出现食欲减退、行为迟缓、体表发黑、腹腔积水、皮肤肌肉出现出血点等临床症状。该病我国动物疫病分类名录中的一类动物疫病, 易感染一龄以上的鲤, 死亡率可达70%以上[2]。SVCV是典型的弹状病毒科(Rhabdoriridae), 水泡性病毒属(Vesiculorius)的单股负链RNA病毒[3]。该病毒编码5种结构蛋白, 分别为核蛋白(Nuclear protein, N)、磷蛋白(Phosphoprotein, P)、基质蛋白(Matrixprotein, M)、糖蛋白(Glycoprotein, G)和RNA聚合酶(RNA polymerase, L)等。其中, 糖蛋白因其表面含有抗原决定簇, 具有很强的免疫原性可诱导免疫应答。因此,糖蛋白成为现阶段SVCV病毒检测、抗体制备以及疫苗研制的热点[4]。根据糖蛋白基因序列, 可将SVCV分为Ia、Ib、Ic和Id四个基因型, 我国SVCV分离株的基因型均为Ia[5]。目前, SVC是我国水生动物疫病监测计划的主要疫病之一, 对于该病尚无有效的防治方法。
对于病毒病的防控, 疫苗一直是最理想的选择。酿酒酵母作为GRAS (Generally recognized as safe)生物, 在生产过程中不会产生内毒素且在表达外源基因时, 对目的蛋白具有一定程度的折叠以及糖基化的修饰的能力[6]。其作为基因表达的宿主菌已在疫苗研制方面取得了成功, 第一个商品化的重组疫苗-乙肝疫苗即来源于酿酒酵母细胞[7]。酵母表面展示系统是将目的蛋白编码基因整合在特定的酵母表面展示载体, 最终将目的蛋白展示于酵母表面的一种真核表达系统, 主要包括a凝集素和α凝集素两种展示系统[8]。a凝集素展示系统是目前较常用的酵母展示系统, 该系统的原理是将目的蛋白基因插入酵母展示载体中Aga2基因下游, 经过半乳糖诱导, 酵母细胞内大量表达目的蛋白-Aga2融合蛋白, 在信号肽的作用下, 该融合蛋白被运送至酵母细胞外。随后, Aga2亚基通过二硫键与酵母表面的Aga1亚基相结合间接的将目的蛋白锚定在酵母细胞表面[9,10](图 1)。目前该系统已经被Zhao等[11]应用到口服疫苗研发领域, 并且取得了一定的疗效。
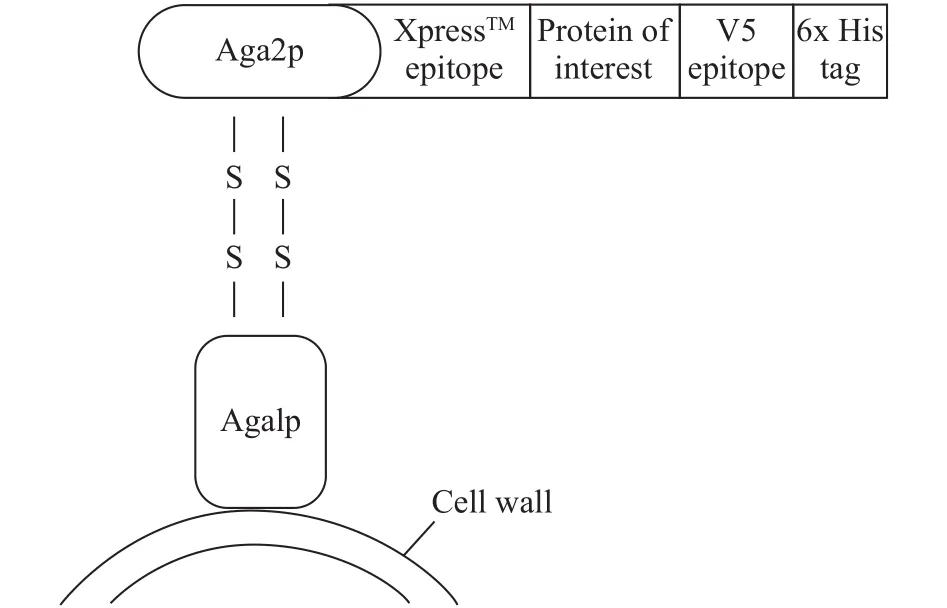
图 1 a凝集素酵母表面展示系统Fig. 1 a-agglutinin-based display system
根据当前我国SVCV基因型, 结合近年来我国北方地区鲤鱼养殖场SVCV的检出情况, 本研究以基因型为Ia的黑龙江地区SVCV分离毒株shlj1为研究对象, 利用a凝集素表面展示系统, 成功将G蛋白高效展示于酵母细胞表面, 旨在为SVCV新型口服疫苗的研制奠定前期基础。
1 材料与方法
1.1 材料
SVCV-shlj1分离株由本课题组分离保存, 其病毒滴度为106.28TCID50/mL[12]; 鲤上皮瘤细胞(Epitheliomapapulosum cyprini, EPC)由中国水产科学研究院长江水产研究所曾令兵教授惠赠; 酿酒酵母EBY100菌株和酵母展示载体pYD1由中国水产科学研究院黄海水产研究所黄倢研究员惠赠; 鼠抗SVCV G蛋白血清由本实验室制备。
大肠杆菌(E. coli) DH5α、克隆载体pMD18-T simple、T4 DNA连接酶、限制性内切酶、DNA Marker DL2000、DL15000购自TaKaRa公司, 质粒DNA提取试剂盒、胶回收试剂盒购自OMEGA公司, Goat Anti-Mouse IgG antibody H&L (Cy3)购自Abcam公司, 亮氨酸((2R)-2-amino-3, 3-dimethylbutanoic acid)、山梨醇(D-Sorbitol)、醋酸锂(LiAc)购自纳川生物技术有限公司。
1.2 引物设计
根据SVCV-shlj1(NCBI登录号: KX911973)分离株糖蛋白基因序列, 利用Primer Premier 5.0设计引物, 同时参照pYD1酵母展示载体上的酶切位点,分别在上下游引物中插入BamHⅠ(GGATCC)或XhoⅠ(CTCGAG)酶切位点, 上游引物F: 5′-GGATCCATGTCTATCATCAGCTACATCGCAT-3′, 下游引物R: 5′-CTCGAGTCAAACGAAGGAC CGCATTTCGTG-3′, 引物由长春库美生物公司合成。
1.3 酵母展示载体PYD1-G质粒的构建
采用Trizol法提取SVCV-shlj1毒株的总RNA[13],利用TaKaRa公司的One Step RT-PCR Kit试剂盒扩增G基因, 通过胶回收试剂盒进行回收, 回收产物克隆至pMD18-T simple载体。在转化后, 对菌液进行PCR鉴定, 鉴定为阳性的单菌落送至测序公司, 测序结果正确的菌液, 提质粒命名为pMD18-T-G。将pMD18-T-G和表达载体pYD1分别用BamHⅠ、XhoⅠ限制性内切酶进行消化、回收, 在T4 DNA连接酶的作用下进行连接, 转入大肠杆菌(E. coli)DH5α中。待出现菌落后, 挑取单菌落, 进行PCR鉴定。将阳性重组质粒命名为pYD1-G, 同时进行菌种保存。
1.4 酵母感受态的制备以及电转化
将-80℃冻存的酿酒酵母EBY100在YPD平板中进行30℃培养活化, 2—4d后挑取单菌落放入液体培养基, 30℃扩大培养。当菌液A600=1.3—1.5时,制备酿酒酵母感受态[14]。向制备好的EBY100酵母感受态细胞中加入5—10 μg的pYD1-G质粒进行电转化, 转化后用1 mL预冷的1 mol/L山梨醇冲洗电击杯, 将含有质粒的山梨醇洗液放入EP管。经30℃孵育1h后, 将山梨醇(含pYD1-G质粒)涂布于Minimal Dextrose (含亮氨酸)平板中筛选阳性转化子。
1.5 阳性转化子的鉴定
随机挑取单菌落, 注明序号, 用10 μL的无菌水溶解菌体, 采用反复冻融和水煮的方法对其破壁。取1 μL处理后的样品进行菌液PCR的鉴定, 利用凝胶电泳观察条带大小, 挑选出条带大小相符的阳性转化子, 命名为EBY100-PYD1-G进行诱导表达。
1.6 EBY100-pYD1-G的诱导表达
将挑取的阳性单菌落接种于含2%葡萄糖YNB-CAA液体培养基中, 30℃培养, 直至A600=2—5时, 离心收集菌落(5min, 30000 r/min)并将其悬浮于2%半乳糖YNB-CAA液体培养基中, 使菌液A600=0.5—1。将酵母菌在20℃培养, 在0—72h内,每24h取2 mL样品4℃保存。
1.7 免疫荧光分析
离心收集诱导0、24h、48h和72h的酵母细胞(5min, 30000 r/min, 4℃), 用PBS清洗菌体, 加入鼠抗G蛋白抗体(1:1000稀释)作为一抗, 混匀后, 37℃孵育1h。用PBS再次清洗菌体后, 向其中加入羊抗小鼠G蛋白H&L (Cy3)作为二抗(1:500稀释), 避光37℃孵育1h后离心。最后用PBS对菌体进行清洗,加入20%甘油(PBS稀释)重悬菌体, 滴于载玻片中,进行免疫荧光镜检, 同时利用Image J软件分析免疫荧光镜检视野(n=10)中阳性酵母细胞比例。
1.8 流式细胞仪检测
离心收集诱导0、24h、48h和72h的酵母细胞(5min, 30000 r/min, 4℃)。用PBS反复冲洗菌体并重悬, 加入鼠抗血清G蛋白抗体作为一抗(1:1000),孵育1h, PBS洗3次, 再加入羊抗小鼠G蛋白H&L(Cy3)作为二抗(1:500)孵育1h, PBS洗3次, 用500 μL PBS重悬菌液, 利用BD FACS Aria II流式细胞仪进行荧光强度检测。
2 结果
2.1 糖蛋白酵母展示系统pYD1-G质粒构建
以SVCV-shlj1为模板, F和R分别为上下游引物, 利用TaKaRa公司的One Step RT-PCR Kit扩增SVCVG基因, 经1%琼脂糖凝胶电泳分析, 结果显示为单一特异性条带, 与目的基因大小相符(1530 bp,图 2)。选择测序结果正确的质粒, 利用BamHⅠ和XhoⅠ酶切位点将G基因连接至酵母展示载体pYD1, 对其进行转化。挑取单菌落进行PCR鉴定,结果显示菌液PCR产物与目的基因大小相符(图 3),将阳性重组质粒命名为pYD1-G。
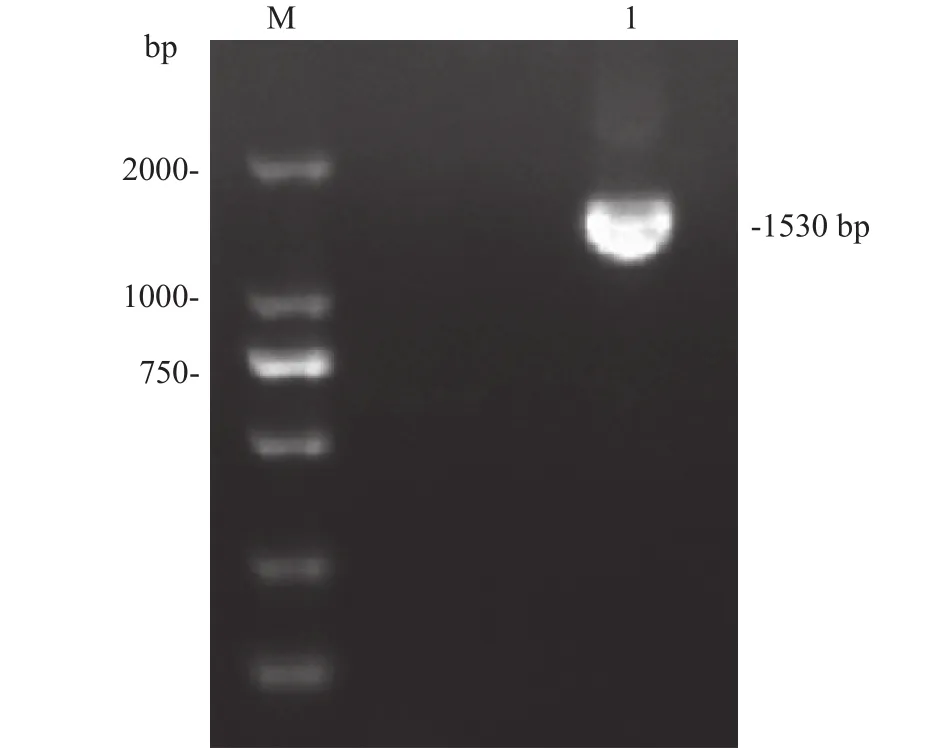
图 2 G基因PCR扩增产物Fig. 2 PCR of G gene
2.2 酵母的电击转化及鉴定
将pYD1-G质粒和pYD1电转入酵母EBY100感受态细胞中, 涂布于Minimal Dextrose (含亮氨酸)的选择培养基中, 30℃培养直至产生单菌落, 挑取单菌落进行PCR鉴定, 结果显示出现了与目的条带大小相符合的单一特异性条带(1530 bp, 图 4), 阳性重组子命名为EBY100-pYD1-G。
2.3 重组酵母免疫荧光检测
将诱导0、24h、48h和72h的酵母菌体离心进行免疫荧光检测以鉴定SVCV G蛋白的酵母表面展示情况。结果显示, 在2%半乳糖诱导下, EBY100-pYD1-G出现特异性的红色荧光, 并且随着诱导时间的增长, 红色荧光酵母细胞所占比例不断增加,而阴性对照组(诱导0)未见任何特异性红色荧光。利用Image J软件对免疫荧光镜检视野(n=10)进行分析可知, 诱导0、24h、48h和72h阳性酵母细胞所占比例平均值分别为8.38%、24.20%、55.30%和72.41%, 且各组之间阳性酵母比例差异显著(P<0.05, 图 5)。
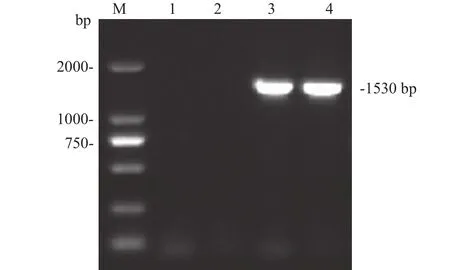
图 3 pYD1-G重组质粒菌液PCR鉴定Fig. 3 PCR identification of pYD1-G recombinant plasmid
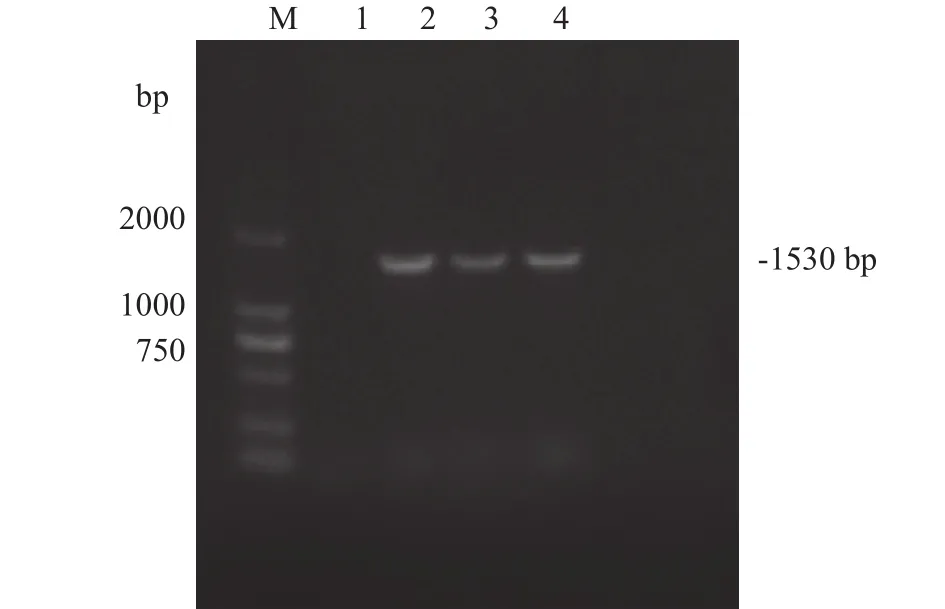
图 4 EBY100-pYD1-G菌液PCR鉴定Fig. 4 PCR identification of yeast EBY100 transformed with pYD1-G
2.4 重组酵母的流式细胞仪检测
将诱导不同时间的酵母细胞进行流式细胞仪检测以鉴定SVCV G蛋白的酵母表面表达情况(图6)。结果显示, 诱导0、24h、48h和72h时, 酵母细胞平均荧光强度分别为2112、7086、10236和10554。由此可知, 随着诱导时间的增加, 酵母细胞表面G蛋白含量随之增加, 因此体现在荧光强度的逐渐增加。但是, 与诱导48h的酵母细胞相比较, 当诱导时间延长至72h时, 酵母荧光强度没有显著增加(P>0.05), 而其余各组均存在显著差异(P<0.05)。
3 讨论
G蛋白是SVCV病毒粒子表面糖蛋白, 具有多个抗原决定簇, 是当前疫苗研制、抗体制备研究的热点[4]。目前已报道几种比较成功的鱼类弹状病毒的DNA疫苗均以G蛋白为研究对象。如张奇亚等[14]分别用G基因与N基因构建鳜弹状病毒(Siniperca chuatsi rhabdovirus, SCRV)的DNA疫苗, 结果发现含有G基因的DNA疫苗保护率显著高于含N基因的DNA疫苗; Emmenegger等[16]和Kanellos等[17]利用SVCV G蛋白也构建出了具有良好保护效果的DNA疫苗。因此, 本研究直接选用SVCV的G蛋白为靶蛋白进行酵母细胞表面展示。
酿酒酵母作为真核细胞生物, 有类似高等生物的翻译后修饰机制, 能够对异源蛋白在表达后进行糖基化、二硫键的异构化等翻译后的修饰及加工[18]。此外, 酵母是公认的益生菌, 其细胞壁中的β-葡聚糖和甘露糖蛋白具有免疫佐剂的功效, 在对机体安全无毒的前提下, 可提高机体的非特异性免疫, 更好地发挥疫苗作用[19], 是活载体疫苗的理想宿主。另有研究发现一个酵母细胞表面大概能够展示表达104个凝集素蛋白, 易于高效表达具有生物活性的复杂蛋白, 且不存在内毒素的问题[9,20]。因此, 本研究采用a凝集素展示系统对SVCV G蛋白进行酿酒酵母表面展示, 旨在为SVCV的口服活载体疫苗的研制奠定基础。
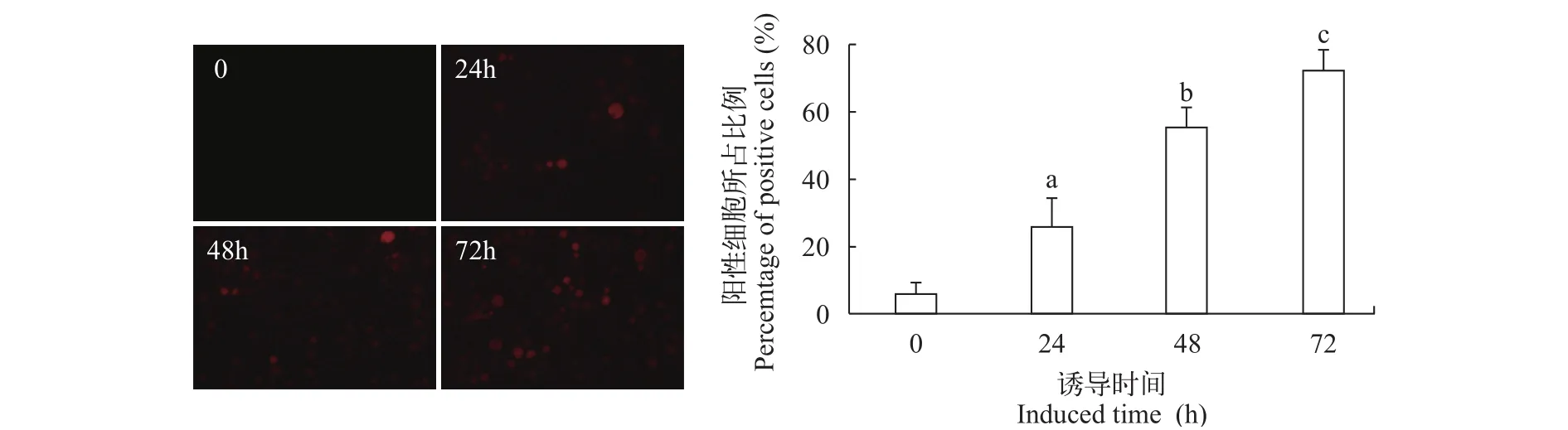
图 5 G蛋白酵母表面展示的免疫荧光检测Fig. 5 Immun of luorescence of G protein displayed on yeast surface
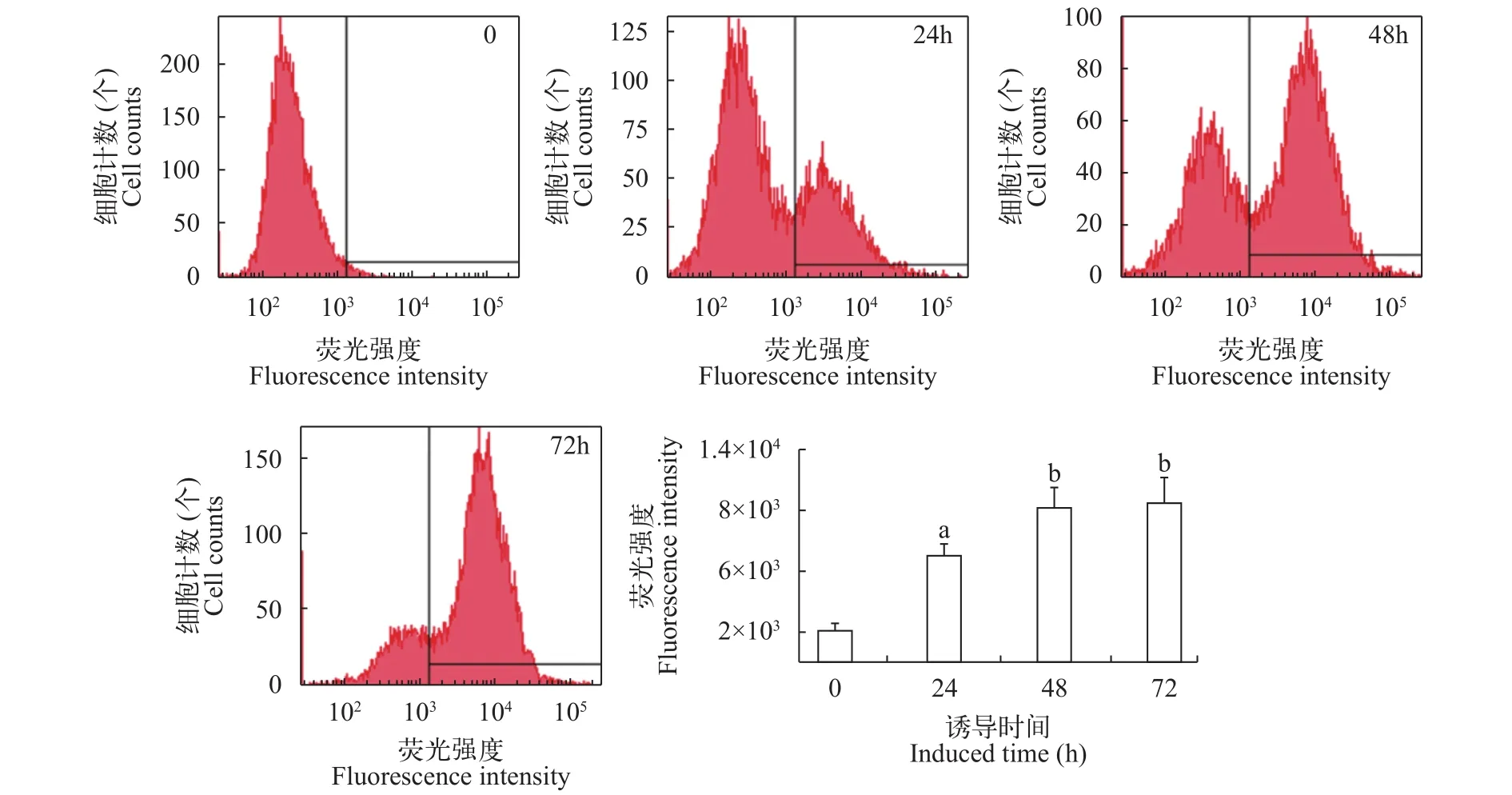
图 6 G蛋白酵母细胞表面展示的流式细胞仪检测Fig. 6 Flow cytometry analysis of G protein displayed on yeast surface
目前, 已有利用毕赤酵母细胞分泌型表达SVCV G蛋白的报道[21,22], 但是并没有利用酿酒酵母细胞锚定型表达SVCV G蛋白的报道。酿酒酵母细胞展示系统改进毕赤酵母细胞以甲醇作为碳源提供能量的缺陷, 利用半乳糖进行诱导, 使所制备的疫苗产品安全性更高。同时酿酒酵母细胞表面展示系统中的G蛋白直接裸露在细胞表面, 增多了抗原被识别的机会, 更宜直接口服免疫动物[6]。
鲤春病毒血症病是一种引发鲤科鱼类高死亡率的病毒病, 而现今对于该病尚无商业化的特效疫苗,找到一种安全可行的防治措施是当前研究的重点。目前, 鱼用疫苗接种方式主要包括: 注射法、基因枪法、浸泡法、口服法[23]。其中浸泡法和口服法是最欢迎的接种方式, 解决了工作量大、费时费力的弊端。本研究综合考虑疫苗安全性以及接种方式的操作性等方面, 首次将SVCV的G蛋白展示在酿酒酵母细胞表面。将诱导表达后的酵母细胞利用细胞免疫荧光、流式细胞仪进行鉴定。结果证明在一定时间内, 酵母荧光强度随诱导时间增加而增加且诱导48h即可达到表达平台期。因此, 可直接选用48h作为最佳诱导时间, 应用于实际的生产中, 达到省时省力的目的。本研究成功实现了SVCV G蛋白的酿酒酵母细胞表面的展示, 为今后制备抗SVCV的口服活载体疫苗的研发奠定了前期基础。

