锡兰钩虫TIMP基因的序列分析与原核表达
颜欣欣,杭建雄,刘云秋,黄 岳,冉荣坤,赵 琪,何 龙,李 秀,刘菊玫,李国清
(华南农业大学兽医学院,广东广州510642)
锡兰钩虫(Ancylostoma ceylanicum)是寄生于犬、猫的常见钩虫,也是唯一能在人体内发育为成虫的动物源性钩虫,可以引起犬、猫和人的钩虫病,主要症状为缺铁性贫血,感染严重时可导致死亡[1]。据最新的流行病学调查,锡兰钩虫是导致人钩虫病的第二大病原,同时也是东南亚和西太平洋地区旅行者腹泻的重要病原体[2-3],且犬、猫是重要的保虫宿主[4-5]。目前,使用化学药物驱虫仍然是控制钩虫病的重要手段,但由于钩虫的耐药性和重复感染,药物防治未能取得良好效果[6]。因而,迫切需要寻找新的控制方法。
金属蛋白酶组织抑制剂(Tissue inhibitor of metalloproteinase,TIMP)是基质金属蛋白酶(Matrix metalloproteinase,MMP)的特异性抑制剂。TIMP 与MMP结合,抑制TIMP 的蛋白水解活性,调节细胞外基质的降解,从而调节机体的生命活动[7]。迄今为止,已经报道了人、果蝇、犬钩虫等生物的TIMP[8-12]。关于锡兰钩虫TIMP(Ace-TIMP)虽有文献提及[13],但未见对Ace-TIMP 的研究报道。本研究旨在对Ace-TIMP 基因进行克隆、原核表达与序列分析,为进一步研究Ace-TIMP 的生物学功能及其免疫潜能奠定基础。
1 材料与方法
1.1 虫体、菌株及主要试剂本研究所用的锡兰钩虫采自华南农业大学外科实验室的实验犬,经虫种鉴定后置于RNA 样品保存液中-20 ℃保存。E.coliDH5α 感受态细胞和pMD18-T 载体、EcoRⅠ、HindⅢ、DL2000 DNA Marker 购自TaKaRa 公司;E.coliTransetta (DE3)感受态细胞购自北京全式金生物技术有限公司;pET-32a 载体由本教研室保存。TRIzol试剂购自天根生化科技(北京)有限公司;RNA 样品保存液购自广州鼎国公司;蛋白Marker 购自美国Thermo Fisher Scientific 公司;鼠抗His 标签抗体和兔抗鼠IgG-HPR 抗体购自生工生物工程(上海)有限公司;His 标签纯化试剂盒、明胶、考马斯亮蓝G-250 购自上海碧云天生物技术有限公司;人MMP-2 蛋白购自上海Novoprotein 公司。
1.2 引物设计根据GenBank 登录的Ace-TIMP 基因序列(ANCCEY-04405)设计 1 对引物,TIMP-AF:5'-CCGGAATTCATGCTCTTCCTTATAGTTTTC-3'(EcoR Ⅰ )/ TIMP-AR: 5'-CCCAAGCTTCTAGTCCAC GCTTTCCTCTT-3' (Hind Ⅲ )。 根 据 Ace-TIMP 基 因测序结果设计1 对引物扩增TIMP 成熟肽序列,TIMP-MP-AF:5'-CCGGAATTCGCATGCTCTTGCGA ACCGTAC-3'(EcoRⅠ)/ TIMP-MP-AR:5'-CCCAAGC TTGTCCACGCTTTCCTCTTCACT-3' (Hind Ⅲ)。引物均由上海生工生物工程技术服务有限公司合成。
1.3 TIMP 基因的 RT-PCR 扩增、克隆及测序TRIzol 法抽提锡兰钩虫成虫总RNA,以反转录合成的 cDNA 为模板。以 TIMP-AF/TIMP-AR 为引物,PCR 扩增 Ace-TIMP 基因。PCR 反应条件为:94 ℃3 min;94 ℃ 30 s、63 ℃ 30 s、72 ℃ 1 min,30 个循环;72 ℃ 5 min。纯化 PCR 产物,克隆于pMD18-T 载体中,转化至E.coliDH5α 感受态细胞中,PCR 鉴定为阳性的菌落样品由上海生工生物工程技术服务有限公司测序,命名为pMD18-T-TIMP。
1.4 原核表达载体的构建及诱导表达以TIMP-MP-AF/TIMP-MP-AR 为引物,pMD18-T-TIMP重组质粒为模板,扩增TIMP 成熟肽序列克隆至pET-32a 载体,构建重组质粒pET-32a-TIMP-MP,双酶切鉴定。阳性重组菌培养至OD600nm为0.4~0.6,加入终浓度为1 mmol/L IPTG 在28 ℃条件下诱导表达。表达产物离心后弃上清收集菌体,超声破碎,收集上清与沉淀,用SDS-PAGE 分析重组蛋白的表达情况。
1.5 Ace-TIMP 重组蛋白的纯化与western blot 分析采用镍柱纯化法纯化超声破碎上清,获取目的蛋白。在12 %聚丙烯酰胺凝胶上进行SDS-PAGE。以鼠抗His 标签抗体(1 ∶1 000)为一抗,以兔抗鼠IgG-HPR (1∶20 000)为二抗,western blot 检测表达产物和纯化产物的特异性。
1.6 Ace-TIMP 重组蛋白对MMP-2 的抑制活性检测采用底物酶谱法[14]分析Ace-TIMP 对MMP-2 蛋白的抑制活性,配制含有1 %明胶与1 %人MMP-2蛋白的SDS-PAGE 凝胶进行非变性凝胶电泳,考马斯亮蓝G-250 染色、脱色,拍照保存结果。
1.7 TIMP 基因的序列分析利用DNAMAN 软件翻译TIMP 基因的氨基酸序列并对其进行多重比对;利用MEGA 5.0 软件构建TIMP 氨基酸序列遗传进化树。
2 结果与讨论
2.1 TIMP 基因的扩增与鉴定以犬源锡兰钩虫cDNA 为模板,利用引物 TIMP-AF/TIMP-AR 进行PCR 扩增,获得一条约650 bp 的条带,与预期片段大小一致(图1)。回收 PCR 扩增产物,克隆于pMD18-T 载体,经菌液PCR 鉴定为阳性。表明,正确扩增了犬源Ace-TIMP 基因。
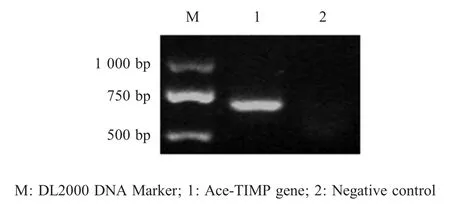
图1 Ace-TIMP 基因的 PCR 扩增Fig.1 PCR amplification of Ace-TIMP gene
2.2 重组表达质粒的鉴定、表达与重组蛋白活性的分析EcoRⅠ和HindⅢ双酶切鉴定重组表达质粒pET-32a-Ace-TIMP-MP,电泳结果显示在约597 bp处有目的条带(图2A),与预期片段大小一致。经IPTG 诱导表达,SDS-PAGE 分析上清与沉淀,结果显示在42 ku 处(pET-32a 载体标签蛋白约为20 ku)可见特异性条带(图2B),与目的蛋白大小相符。Western blot 分析pET-32a-Ace-TIMP-MP 的表达产物与纯化产物,结果显示在约42 ku 处可见特异性条带(图2C、2D),与预期蛋白分子质量一致。底物酶谱法分析Ace-TIMP 重组蛋白对MMP-2 的抑制活性,结果显示在约42 ku 处可见蓝色条带(图2E)。表明,正确构建了Ace-TIMP 基因的原核表达载体,该重组蛋白的分子质量为42 ku,主要在上清中表达,为可溶性融合蛋白,且该蛋白可以抑制MMP-2的活性。
2.3 TIMP 基因的序列分析测序结果显示Ace-TIMP 基因的ORF 全长为648 bp,编码215 个氨基酸。其信号肽序列为48 bp,编码16 个氨基酸;成熟肽序列为597 bp,编码199 个氨基酸;终止密码子为TAG。氨基酸序列比对结果显示,Ace-TIMP与犬钩虫TMP-2 (Ac-TMP-2)的相似性为56.8 %,具有 TIMP 家族 Cys-X-Cys (18Cys-19Ser-20Cys)特征性序列,且在N 末端结构域中拥有4 个保守的Cys 残基,2 个保守的 Gly 残基,1 个保守的 Pro、Val、Tyr 残基。对不同物种TIMP 蛋白的氨基酸序列进行遗传进化分析,结果显示Ace-TIMP 与Ac-TMP-2 处于同一进化分支(图3)。表明Ace-TIMP 与Ac-TMP-2的遗传进化关系较近。
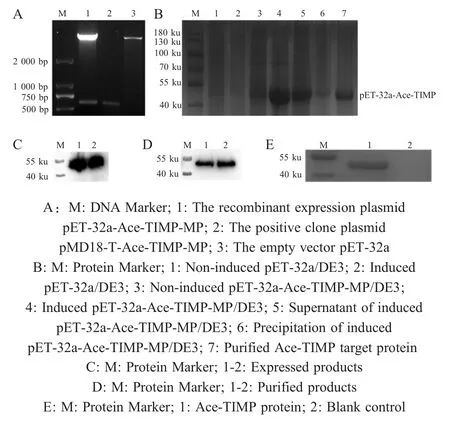
图2 重组质粒的鉴定(A)、表达产物的SDS-PAGE 分析(B)、表达产物(C)与纯化产物(D)的western blot 分析以及Ace-TIMP蛋白对MMP-2 的抑制活性检测结果(E)Fig.2 Double enzyme digestion identification of recombinant plasmid (A), SDS-PAGE analysis of expression product (B), western blot analysis of expressed products (C)and purified products (D), and the inhibitory activity of Ace-TIMP protein to human MMP-2 (E)
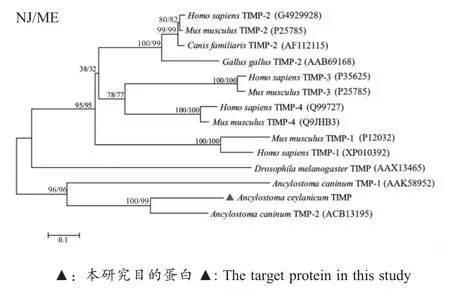
图3 TIMP 遗传进化分析Fig.3 Genetic and evolutionary analysis of TIMP
TIMP 是MMP 的特异性抑制剂,广泛存在于脊椎动物与无脊椎动物体内。目前,对TIMP 的研究多集中于脊椎动物,对无脊椎动物尤其是寄生虫TIMP 的研究甚少。在钩虫中仅报道犬钩虫(Ancylostoma caninum)的 2 个 TIMP, 即 Ac-TMP-1[10]与Ac-TMP-2[12]。研究表明 Ac-TMP-1 与 Ac-TMP-2 具有典型的Cys-X-Cys 功能位点,缺乏与哺乳动物TIMP对应的C 末端结构域[10-12]。本研究扩增了犬源锡兰钩虫Ace-TIMP 基因,通过序列比对分析显示Ace-TIMP 与 Ac-TMP-2 的相似性最高(56.8 %),含有TIMP 家族特有的Cys-X-Cys 功能位点,缺乏C末端结构域,这与犬钩虫TIMP 的结构特点相符[10-12]。系统进化树显示,来自人、鼠、犬与黑腹果蝇的TIMP 聚为一支,锡兰钩虫TIMP 与犬钩虫的TMP-2聚为一支,这与Brew 和Nagase 关于哺乳动物的TIMP 家族起源于黑腹果蝇以及单一结构域TIMP 分子可能由双结构域TIMP 缺失一个结构域进化而来的推论相符[8]。底物酶谱法分析表明Ace-TIMP 蛋白可以抑制MMP-2 的活性。
本研究首次从犬源锡兰钩虫成虫中克隆TIMP基因,构建其原核表达载体并进行体外表达,对其序列进行了多重比对和遗传进化分析,并验证了其抑制MMP 活性的功能,为深入研究锡兰钩虫TIMP的生物学功能及其免疫潜能奠定了基础。

