条斑紫菜多糖与薏米仁多糖复配物的制备及其降血脂功效研究
,周 围,王筱瑜,陈冠男,张俊鹏,张 翔
(锦州医科大学食品科学与工程学院,辽宁锦州 121001)
渤海条斑紫菜(Porphyrayezoensis)是渤海中呈紫红色或略带蓝绿色,并生长于前海潮间带岩石上互生藻类的统称[1]。在中医学中紫菜具有化痰软坚,清热利水,补肾养心的功效,而条斑紫菜富含蛋白质、碘、磷、钙、多糖等以供食用或药用,同时有研究表明紫菜多糖能够明显增强细胞免疫和体液免疫功能[2-3]、预防高胆固醇血症形成[4]、抗肿瘤[5-6]、抗辐射[7]等作用。
目前随着生活水平的提高,吃精米、精白面的人们越来越多,从营养学来讲,人们越来越缺失粗粮中富含的维生素B族、胡萝卜素、矿物质和纤维素,而这些物质都是有利于降低高血脂等指标的营养素。而粗粮含有丰富的不可溶性纤维素,有利于保障消化系统正常运转。它与可溶性纤维协同工作,可降低血液中低密度胆固醇和甘油三酯的浓度;增加食物在胃里的停留时间,延迟饭后葡萄糖吸收的速度,降低高血压、糖尿病、肥胖症和心脑血管疾病的风险。
因此本文以渤海条斑紫菜为原料,为研发新型渤海紫菜降血脂功能性食品提供实验依据。
首先响应面法优化条斑紫菜可溶性多糖的最佳工艺,同时在九种粗粮中筛选出最适复配的粗粮种类,以体外油脂吸附能力即吸油量为指标,筛选出条斑紫菜多糖和粗粮多糖的最佳复配比,最后对小鼠脂肪酶进行抑制率测定。
1 材料与方法
1.1 材料与仪器
干渤海条斑紫菜、爆玉米、薏仁米、糙米、荞麦米、青稞、香糯米、大麦米、黄小米、香米、大豆油 购于2018年9月17日购于辽宁锦州大润发超市;浓硫酸、蒽酮、葡萄糖(标准品)、95%乙醇、30%过氧化氢、硫酸亚铁、水杨酸、氢氧化钠等试剂 均为分析纯;成年昆明小鼠 取自锦州医科大学动物实验中心,许可证号:SCXK(辽2014-0004)。
FS-100粉碎机 浙江屹立工贸有限公司;HH.600水浴锅 上虞市道墟茂祥仪器设备厂;KQ3200B超声波处理器 江苏省昆山市超声仪器有限公司;TDL-5A高速离心机 上海安亭飞鸽;752型紫外可见分光光度计 上海光谱仪器有限公司制造;FA2004N分析天平 上海精密科学仪器有限公司。
1.2 超声波法提取条斑紫菜水溶性多糖
1.2.1 工艺流程 条斑紫菜→粉碎干粉→超声波法提取水溶性多糖→离心→取上清液→加乙醇放置过夜→离心→取沉淀→烘干成粉
1.2.2 多糖提取过程 将干条斑紫菜用粉碎成粉过50目筛备用。取0.5 g的条斑紫菜粉,按照料液比1∶15 (g/mL)加入蒸馏水,放进超声处理器(150 W)中[8-9],超声温度50 ℃,超声时间40 min。冷却至室温后倒入50 mL离心管中,4000 r/min离心15 min,上清液即为条斑紫菜水溶性多糖溶液,备用待测。加入与蒸馏水等量的乙醇,放置过夜,4000 r/min离心15 min,取沉淀,烘干机烘干破碎成粉。
1.2.3 单因素实验 以料液比、超声温度、超声时间和超声功率四个主要影响因素为研究因素,以条斑紫菜水溶性多糖得率为指标,优化四个主要因素的最佳条件。
1.2.3.1 提取温度的影响 设置提取温度分别为30、40、50、60、70 ℃,料液比为1∶15,超声150 W处理40 min,考察提取温度对多糖提取得率的影响。
1.2.3.2 提取时间的影响 设置提取时间分别为30、40、50、60、70 min,料液比为1∶15,提取温度为50 ℃,超声150 W处理,考察提取时间对多糖提取得率的影响。
1.2.3.3 料液比的影响 设置料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30,提取温度为50 ℃,超声150 W处理40 min,考察提取料液比对多糖提取得率的影响。
1.2.3.4 超声功率的影响 设置超声功率分别为90、110、130、150、170 W。料液比为1∶15,提取温度为50 ℃,超声150 W处理40 min,考察提取功率对多糖提取得率的影响。
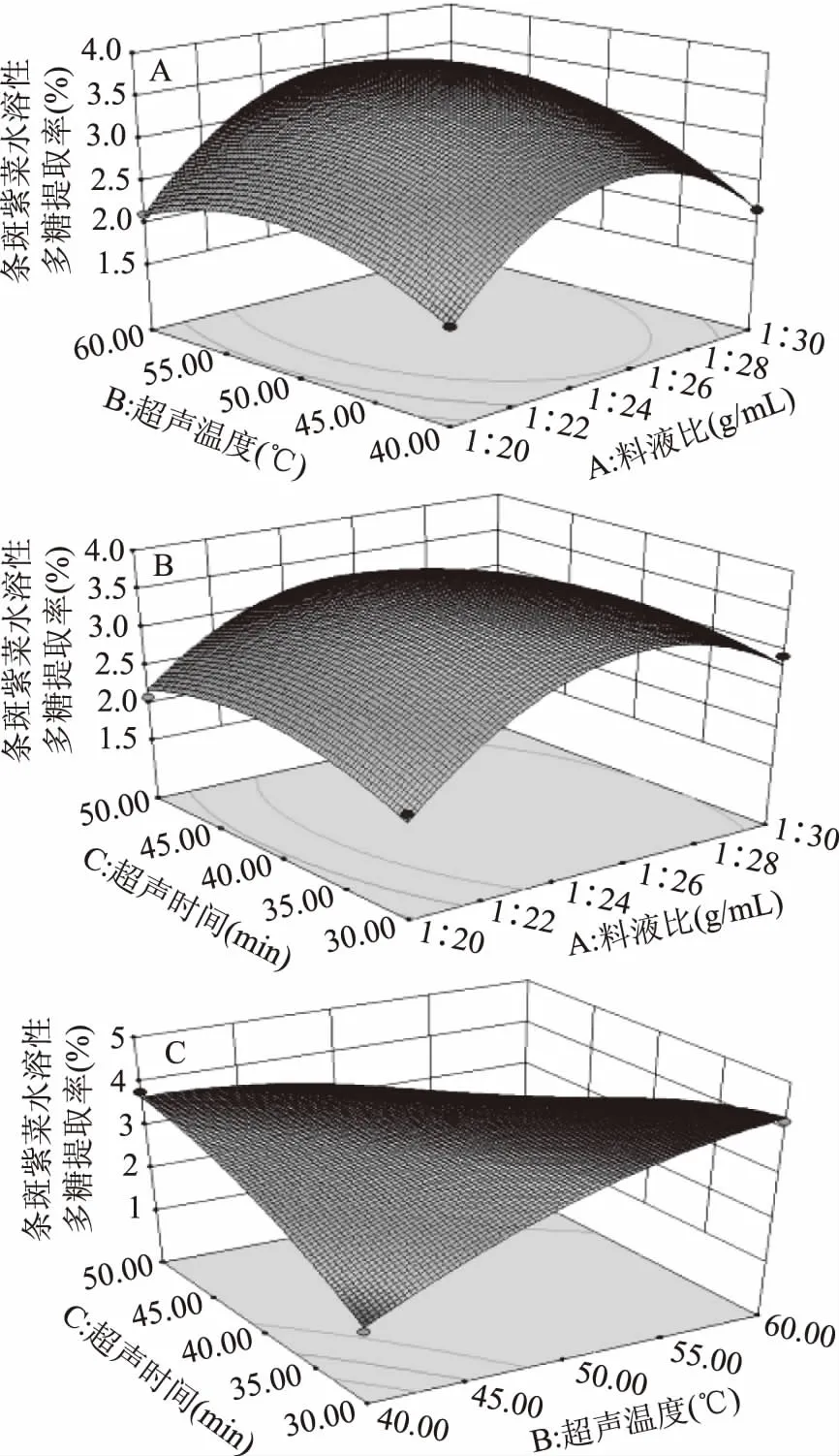
1.2.4 响应面法优化多糖超声波提取工艺 在单因素实验的基础上,选取了对条斑紫菜多糖得率影响较大的3个因素——料液比(A,g/mL)、超声温度(B, ℃)、超声时间(C,min)为自变量,条斑紫菜多糖得率为响应值,采用Box-Behnken中心组合试验设计原理,通过三因素三水平的响应面分析方法,优化条斑紫菜多糖的提取工艺,具体因素水平设计见表1。
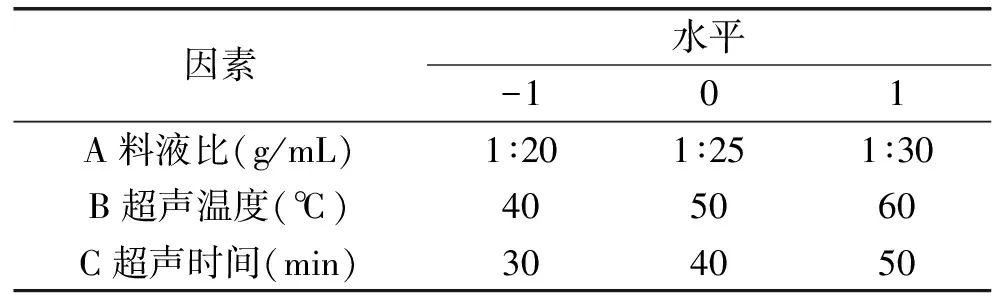
表1 响应面试验因素水平表Table 1 Factors and levels of response surface experiment
1.3 粗粮多糖复配种类的确定
1.3.1 粗粮原料预处理 将爆玉米、薏仁米、糙米、荞麦、青稞、香糯米、大麦米、黄小米、香米等原材料清水洗净,干燥,各取20 g原料用100 ℃烘干成恒重,用研磨机磨碎成粉,用80目过筛,备用。
1.3.2 粗粮多糖的制备及初步筛选 改进程振玉等[10]提取粗粮多糖的方法:取各粗粮粉5 g(重量记为W1),按料液比(m/V,g/mL)1∶9比例加入蒸馏水,70 ℃ 150 W超声提取60 min,4000 r/min离心10 min,取上清液,加入与蒸馏水等量的乙醇,放置过夜,4000 r/min离心10 min取沉淀,恒温(60 ℃)干燥至恒重后,得粗粮多糖(重量记为W2),备用待测。以粗粮多糖得率(%)为评价标准,初步筛选粗粮复配种类。
1.3.3 粗粮多糖的二次筛选 本实验获得的条斑紫菜多糖(60 ℃恒温干燥成粉)的溶解pH为≥8.0,而pH过高却不利于复配物的广泛应用,故本实验将初步筛选获得的粗粮多糖(爆玉米、薏仁米、糙米、荞麦和青稞)分别加入到pH=7.0的25 ℃蒸馏水、pH=7.0的70 ℃热蒸馏水、pH=8.0的25 ℃蒸馏水和pH=8.0的70 ℃热蒸馏水,根据粗粮多糖溶解性对粗粮复配种类进行二次筛选。
1.3.4 粗粮多糖得最终筛选 复配物之所以能够降脂,是由于复配物能够与油脂结合,使胃肠内消化吸收脂肪量减少,从而达到降脂的目的,本实验预制备具有降血脂作用的条斑紫菜多糖和粗粮粗多糖复配物,故本实验以体外油脂吸附能力为评价指标筛选最终的粗粮复配种类。取0.1 g条斑紫菜多糖,以1∶1复配比,复配0.1 g二次筛选出的粗粮多糖(爆玉米或薏仁米),以吸油量(%)为指标筛选出最终的粗粮复配种类。
1.4 条斑紫菜多糖和薏仁米多糖复配物的制备
1.4.1 2×2析因法分析条斑紫菜多糖和薏仁米多糖交互作用关系 通过2×2析因法,以吸油量(%)为指标,分析条斑紫菜多糖(0.05 g和0.1 g两个水平)和薏仁米多糖(0.05 g和0.1 g两个水平)两者之间的交互作用。
1.4.2 筛选最优多糖复配比 将条斑紫菜多糖和薏仁米多糖复配物的总重量设为0.2 g,设计不同多糖复配比(条斑紫菜多糖/薏仁米多糖:g/g)为1∶9、1∶4、3∶7、2∶3、1∶1、3∶2、7∶3、4∶1、9∶1,以吸油量(%)为指标,筛选出最佳多糖复配比。
1.5 最佳粗粮复配物对脂肪酶的测定
复配物能具有降脂的效果,其同时对体内的脂肪酶有一定的抑制效果,从而双重减少脂肪的吸收量。以最佳复配物比例对小鼠脂肪酶进行测定,做为本实验预制备具有降血脂作用复配物的有效依据。取2 mL 0.1 g/mL条斑紫菜和粗粮多糖复配物溶液,与加有底物甘油三油酸酯和小鼠脂肪酶进行酶抑制率的测定。
1.6 指标的测定
1.6.1 水溶性多糖得率的测定 取1 mL待测样品或标准品溶液,分别加入4.0 mL 0.2%的蒽酮溶液(取0.2 g蒽酮粉末用浓硫酸定容在100 mL容量瓶中,注:现配现用[9]),速用冷水冷却,然后放到沸水浴中加热10 min取出,迅速冷却,室温放置10 min,于620 nm处进行比色。以蒸馏水为空白,准确测定浓度为0.02、0.04、0.06、0.08、0.10 mg/mL的葡萄糖标准品溶液,并绘制葡萄糖标准曲线。根据葡萄糖标准曲线,计算水溶性多糖浓度和水溶性多糖得率(%)(见式1)。
式(1)
式中:c1为水溶性多糖浓度;V多糖溶液体积;n为稀释倍数;m为条斑紫菜原料重量。
1.6.2 粗粮多糖得率的测定 干燥至恒重的粗粮粉重量记为W1,经提取后获得的粗粮多糖重量记为W2。按照式2计算粗粮多糖得率(%)。
式(2)
1.6.3 体外油脂吸附能力的测定 将段振等[11]的体外油脂吸附能力测定方法改进如下:称取0.2 g条斑紫菜多糖和粗粮多糖复配混合物(重量记为S1)置于50 mL离心管中,向其中加入食用大豆油1.6 g,在恒温振荡器中37 ℃静置1 h,结束后4000 r/min条件下离心20 min,弃去上层油,用滤纸将残渣中的游离大豆油吸干,称重得S2。按式3计算吸油量(%)。

式(3)
1.6.4 粗粮复配物对体外脂肪酶的抑制率测定
1.6.4.1 小鼠脂肪酶制备 酶制备方法参照文献略加修改[12],取冷冻的成年小鼠小肠和胰脏混合物,用生理盐水冲洗干净并剪碎,用100 mL磷酸盐缓冲液(pH6.8)在冰水浴中分批倒入匀浆器,研磨至匀浆,放入4 ℃冰箱过夜,在0~4 ℃下5000 r/min离心15 min取上清液,即为小鼠脂肪酶液,4 ℃备用,使用时先将小鼠脂肪酶放入37 ℃水浴锅预热10 min,以激活酶。
1.6.4.2 小鼠脂肪酶活性测定 根据文献方法[11],稍作修改,进行小鼠脂肪酶活性测定,方法如下:取四个100 mL锥形瓶,一个为空白对照组,另外两个为测定组。每瓶加5 mL 0.025 moL/L PBS磷酸盐缓冲液(pH7.4)和4 mL甘油三油酸酯底物乳化液,置37 ℃水浴锅中预热10 min。然后加入1 mL 2 mg/mL小鼠脂肪酶液(以pH7.4 0.025 mol/L 磷酸盐缓冲液配制(除空白外)),从加入小鼠脂肪酶液开始计时,保温15 min后立即向其中加入15 mL 95%乙醇,停止酶反应。加酚酞指示剂三滴(2 g酚酞加上100 mL 95%乙醇配制),用0.025 mol/L氢氧化钠标准溶液滴至微红色。空白实验先不加小鼠脂肪酶液,保温15 min后立即加入15 mL 95%乙醇,最后加入1 mL小鼠脂肪酶液。根据式5计算胰脂肪酶活力:
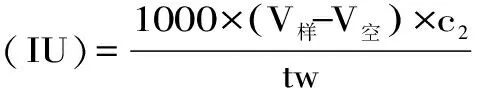
式(5)
式中:c2为NaOH标准溶液的浓度,mol/L;V样为样品消耗NaOH标准溶液的体积,mL;V空为对照实验消耗NaOH标准溶液的体积,mL;t为加酶后反应时间,min;w为小鼠小肠酶添加量,mL。
1.6.4.3 小鼠脂肪酶抑制率的测定 据文献[11],向100 mL三角瓶中加入PBS缓冲液及底物乳液,置于37 ℃恒温培养10 min后,加入2 mL 0.1 g/mL条斑紫菜薏仁米多糖(1∶1)混合溶液,保温10 min,然后加入1 mL小鼠脂肪酶液,从加入酶液开始计时15 min,结束后立即加入15 mL 95%乙醇,测定其剩余酶活。空白试验不加入条斑紫菜薏仁米多糖混合溶液。
抑制活力单位定义:在pH7.5,温度为37 ℃的条件下,使一个酶活力单位失活为一个抑制剂活力单位。条斑紫菜薏仁米多糖对胰脂肪酶的抑制率计算如式6:
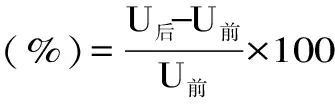
式(6)
式中:U前为抑制前小鼠脂肪酶活力,U后为抑制后小鼠脂肪酶活力。
1.7 数据处理

2 结果与分析
2.1 超声波法提取条斑紫菜水溶性多糖实验结果分析
2.1.1 葡萄糖标准曲线绘制 以葡萄糖标准品质量浓度(mg/mL)为横坐标,以吸光度(A620 nm)为纵坐标,绘制葡萄糖标准曲线图,见图1(A),得到葡萄糖标准品质量浓度与吸光度的线性关系方程为y=9.84x+0.0057,决定系数R2=0.9973。
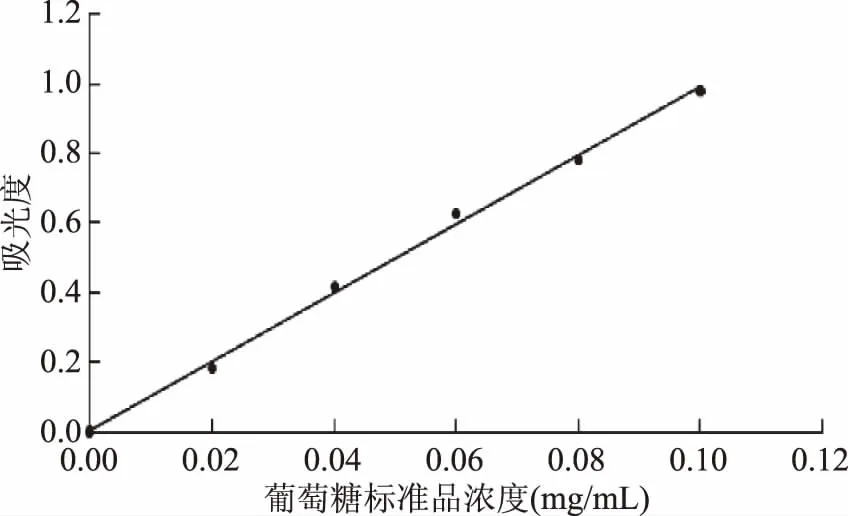
图1 葡萄糖标准曲线Fig.1 Glucose standard curve
2.1.2 单因素对条斑紫菜水溶性多糖得率的影响
2.1.2.1 料液比对条斑紫菜水溶性多糖得率的影响 由图2可知,随着料液比的增加,条斑紫菜水溶性多糖得率先显著增加后极显著急速增加(P≤0.01),当料液比为1∶20时条斑紫菜水溶性多糖得率最大(3.63%±0.08%),之后随着料液比的增加,多糖得率变化不显著(P>0.05)。可能是由于用水量过少时,条斑紫菜可溶性多糖浸出不完全;随着用水量增加,条斑紫菜可溶性多糖溶解程度增加,最终达到最高值;随着料液比的继续增加,多糖的得率提升空间较为有限[13]。因此,选择较优料液比为1∶20。
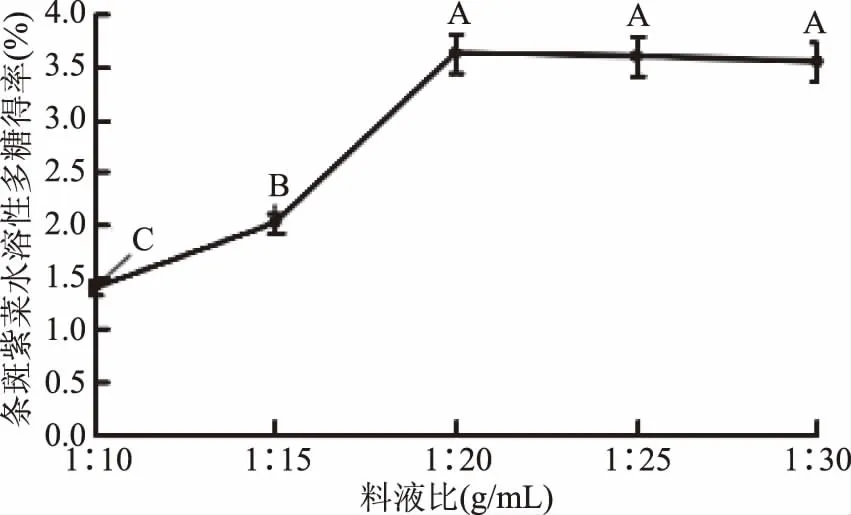
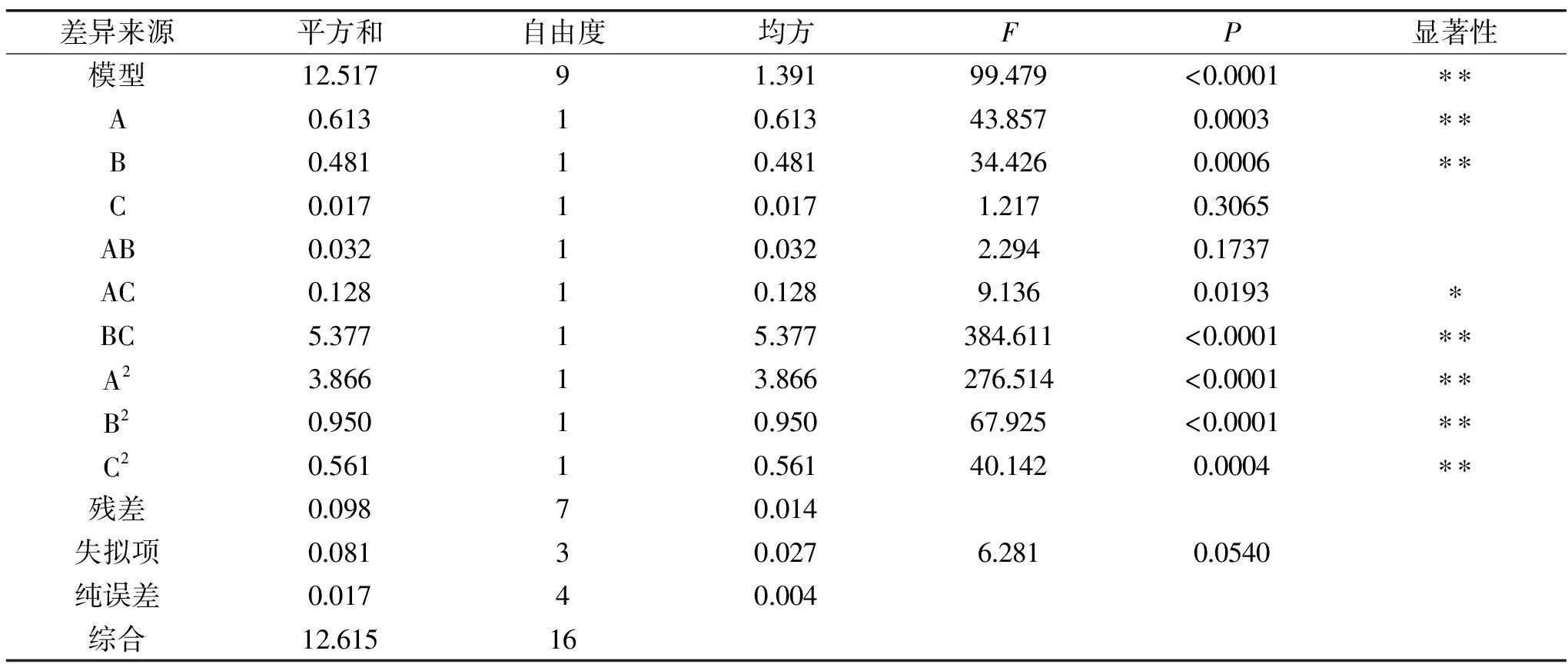
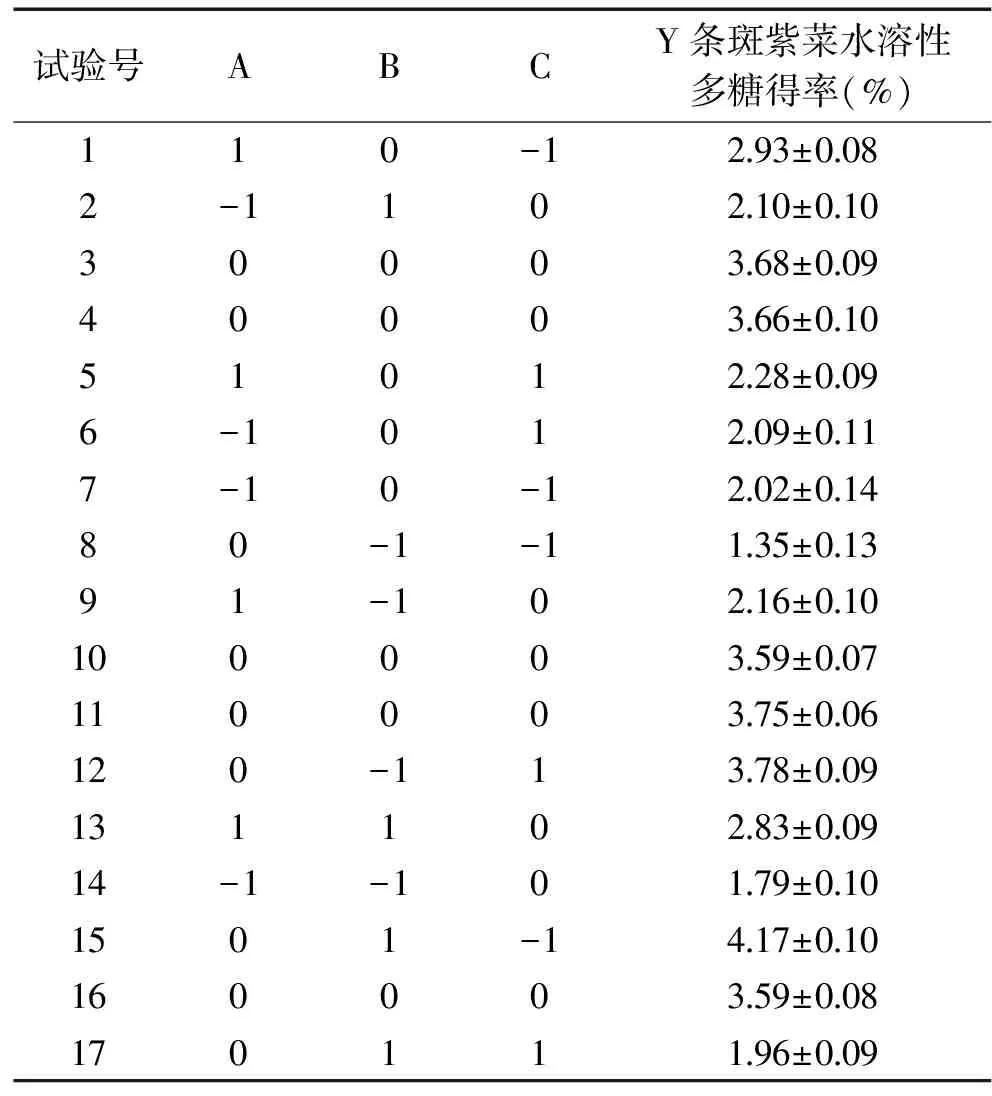
图2 料液比对条斑紫菜水溶性多糖得率得影响Fig.2 Effect of liquid-liquid ratio on the yield ofwater-soluble polysaccharides of Porphyra yezoensis注:同一比较组中标有不同大写字母表示差异极显著(P≤0.01);相同大写字母不同小写字母表示差异显著(0.01 2.1.2.2 提取温度对条斑紫菜水溶性多糖得率的影响 从图3可知,随着超声温度的升高,条斑紫菜水溶性多糖得率先升高不明显,而后极显著升高(P≤0.01),当超声温度为50 ℃时,条斑紫菜水溶性多糖得率最大(2.97%±0.10%),之后又极显著降低(P≤0.01)。当超声温度过低时,分子运动速度慢[13],导致条斑紫菜可溶性多糖得率低;而当超声温度过高时,分子运动速度虽然变快了,但可能是条斑紫菜可溶性多糖高温易被破坏[14-15],导致可溶性多糖得率下降。因此选择适宜的超声温度为50 ℃。 2.1.2.3 提取时间对条斑紫菜水溶性多糖得率的影响 由图4可知,随着超声时间的延长,条斑紫菜水溶性多糖得率先极显著升高(P≤0.01),当超声时间为40 min时得率最大(3.95%±0.10%),超声时间在40~50 min之间水溶性多糖得率数值极显著降低(P≤0.01),50 min以后得率变化不显著(P>0.05)。当超声时间过短时,条斑紫菜中水溶性多糖尚未完全和水充分接触[14],水溶性多糖得率较低;而当超声时间过长时,条斑紫菜可能有部分降解现象[16],导致水溶性多糖得率降低。因此选择适宜的超声时间为40 min。 图4 超声时间对条斑紫菜水溶性多糖得率的影响Fig.4 Effect of ultrasonic time on the yield ofwater-soluble polysaccharides of Porphyra yezoensis 2.1.2.4 超声功率对紫菜水溶性多糖得率的影响 由图5可知,随着超声功率的增加,条斑紫菜水溶性多糖得率逐渐增加(P≤0.01),当超声功率为150 W时,紫菜水溶性多糖得率达到最大值(3.50%±0.1%),随后随着超声功率的继续增加,多糖得率变化不显著(P>0.05)。可能是由于用破碎的还不够完全,能溶解的多糖有限时,条斑紫菜可溶性多糖浸出不完全;随着超声功率增加,条斑紫菜可溶性多糖溶解程度增加,最终达到最高值;随着超声功率的增加,多糖的得率提升空间较为有限[13]。因此选择适宜的超声功率为150W。 表3 回归模型方差分析Table 3 Analysis of variance by response surface methodology 图5 超声功率对条斑紫菜水溶性多糖得率的影响Fig.5 Effect of ultrasonic power on the yield ofwater-soluble polysaccharides of Porphyra yezoensis 注:0.01 Y=3.65+0.28A+0.25B-0.04C+0.090AB-0.18AC-1.16BC-0.96A2-0.47B2-0.37C2。 表2 响应面法实验设计及结果Table 2 Experimental results of response surface methodology 表3显示,回归模型F=99.479,P<0.0001表示该回归模型极显著,而且失拟项F=6.281,失拟项P=0.0540,即P>0.05,表明回归方程无失拟项存在,回归方程拟合程度极好,此模型中A、B、BC、A2、B2和C2因素对条斑紫菜水溶性多糖得率存在极显著影响(P<0.01)。 图6(A~C)能够直接反映料液比、超声温度、超声时间之间的交互作用。根据图6(A)响应面弯曲程度先上升后平缓的趋势分析得出,在料液比较低时,得率随着超声温度升高而增大。适当提高提取超声温度能弥补料液比过低时对得率的影响。但料液比逐渐提高,得率变得平缓,随着超声温度升高而降低。图6(B)所示其响应面弯曲程度先上升后平缓的趋势分析得出,在不同料液比的条件下,得率随着超声时间的增大而增大,最大料液比逐渐趋向平缓,随着超声时间和液料比的增大,得率不再增加。图 6(C)所示其响应面弯曲程度先上升后平缓且有下降的趋势分析得出,在超声温度较低时,得率随着超声时间增大而增大。但由于超声温度过高或超声时间过长得率保持在一定水平不再提升或者下降,说明超声温度与超声时间的交互作用对得率有影响。 图6 交互作用对条斑紫菜水溶性多糖得率的影响Fig.6 Effects of interaction on the extraction rate ofwater-soluble polysaccharides from Porphyra yezoensis 利用Design Expert 8.0.6软件对二次回归模型进行分析,预测最优提取条件为料液比1∶26.42,超声温度60.00 ℃,超声时间30.00 min,估测响应值的理论值为4.34%。由于实验室条件限制采取优化条件为料液比1∶25,超声温度60 ℃,超声时间30 min进行试验,水溶性多糖得率为4.24%±0.19%,相对误差为0.10%,其预测值与实际值接近。罗彤等[13]人对我国南方紫菜多糖超声波法提取最佳条件为:液固比为50∶1,90 ℃超声时间30 min,紫菜多糖得率为6.78%。相比较,本实验结果超声温度较低,可能是由于渤海条斑紫菜中高温不稳定多糖含量较高的缘故,温度较低无法完全提出。 表4 以粗粮多糖得率筛选粗粮复配种类的结果Table 4 Results of screening compound types of coarse grain by extraction rate of polysaccharides 表5 粗粮多糖溶解性结果Table 5 Solubility results of coarse grain polysaccharides 注:+为溶解,-为不溶解。 2.2.1 粗粮多糖的初筛 表4表明,因为实验设计的用量,多糖得率在6%以下的粗粮其每5 g所得得多糖过于少不足以进行一次实验,进行下一步实验时需要加倍提取,因此未超过6%筛除,香糯米、大麦米、黄小米、香米的粗粮多糖得率在6%以下,故本实验将此四种粗粮筛除。保留爆玉米、薏仁米、糙米、荞麦和青稞进行二次筛选。 2.2.2 粗粮多糖的二次筛选 表5表明,糙米、荞麦和青稞在pH=7.0的25 ℃蒸馏水、pH=7.0的70 ℃热蒸馏水、pH=8.0的25 ℃蒸馏水、pH=8.0的70 ℃热蒸馏水这四种情况都不溶解,原因可能是提取出的糙米、荞麦、青稞多糖为偏酸性多糖不易溶于碱性。因此不适用与条斑紫菜多糖进行复配。 2.2.3 粗粮多糖的最终筛选 表6表明,条斑紫菜多糖和薏仁米多糖复配物的吸油量显著高于条斑紫菜多糖和爆玉米多糖复配物的吸油量(P<0.01)。复配物通过与油脂结合,使胃肠内消化吸收脂肪量减少,从而达到降脂的目的[17-18]。 表6 复配物的吸油量结果Table 6 Oil absorption results of the compound 注:P≤0.01为差异具有极显著性,用**表示。 通过以上三次筛选,本实验最终筛选出薏仁米为与条斑紫菜复配的最佳粗粮种类,以及其二者最佳复配比,并以此进一步开展后续实验。 表8 吸油量的析因法方差分析结果Table 8 Factorial variance analysis of oil absorption 表9 不同复配比添加量的吸油量的结果Table 9 Results of oil absorption amounts with different compound ratios 2.3 条斑紫菜多糖和薏仁米多糖复配物的制备 2.3.1 2×2析因法分析条斑紫菜多糖和薏仁米多糖交互作用关系结果 析因分析结果(见表7和表8)表明,条斑紫菜多糖的主效应、薏仁米多糖的主效应都差异显著(P<0.05),而其条斑紫菜多糖×薏仁米多糖交互作用对吸油量影响差异极显著(P<0.01)。图7表明,条斑紫菜多糖与粗粮多糖之间为正协同作用,说明两者能有效共同作用使其吸附油能力增强。为后期研制条斑紫菜多糖和粗粮多糖复配物的奠定实验基础。 表7 2×2析因法设计吸油量(%)的合计值Table 7 2×2 Factorial design of oil absorption(%) 图7 吸油量的析因分析图Fig.7 Factorial analysis chart of oil absorption 2.3.2 筛选最佳多糖复配比的结果 以吸油量(%)筛选出最佳的多糖复配比(见表9),结果表明条斑紫菜多糖:薏仁米多糖为1∶1时,吸油量最高(45.87%±5.27%),即为最佳的多糖复配比。实验结果显示条斑紫菜多糖与薏仁米多糖复配具有较高的可行性,具有较强的油脂吸附能力,可间接判断其具有较高的降血脂能力[18]。 条斑紫菜多糖和薏仁米的最佳复配比为1∶1,其二者最佳复配比下对小鼠脂肪酶测定结果为34.67%,抑制率较好,即复配物不仅可以吸附油脂,同时可以对脂肪酶起一定的抑制作用,复配物可以通过抑制脂肪酶分解脂肪,使胃肠内易吸收的脂肪酸减少,减少脂肪吸收从而达到降脂的目的。因为酶提取的方式和滴定方式,导致上下浮动较大,但结果较为理想。 本实验优化超声波法最佳提取条斑紫菜中的多糖的工艺为目的,料液比(m/V,g/mL)1∶25,超声功率为150 W,超声温度60 ℃,超声时间30 min,获得水溶性多糖得率为4.24%±0.19%。筛选9种粗粮中薏仁米最适合与条斑紫菜多糖复配,且最佳复配比为1∶1,吸油量最大为45.87%±5.27%,其二者复配物对小鼠脂肪酶的抑制率为34.67%。本实验为研发新型渤海紫菜降血脂功能性食品提供实验依据。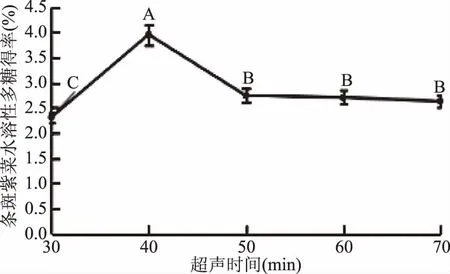



2.2 条斑紫菜多糖和粗粮多糖的复配筛选结果分析



2.4 最佳粗粮复配物对脂肪酶的测定
3 结论

