乳酸链球菌素脂质体在不同pH值条件下的稳定性及其抑菌效果
付 咪,俞佳丽,郭 亮,李延华,陈 杰,孟岳成*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
乳酸链球菌素(Nisin)是乳酸乳球菌的次级代谢产物,是一种由34 个氨基酸残基组成的阳离子多肽,具有良好的抑菌活性,能有效抑制大多数革兰氏阳性细菌以及产芽孢的枯草芽孢杆菌和梭状芽孢杆菌的生长,是世界卫生组织公认安全的天然生物食品防腐剂,因此,Nisin可以作为一种理想的抑菌剂应用于食品中[1-2]。然而,Nisin作为一种疏水性多肽,其整体带正电荷,会与食品体系中的蛋白质、脂类结合,通过酶降解而失活;或者在体系中分布不均匀,从而导致其抑菌活性降低[3-4]。此外,有研究表明,Nisin在食品体系中短时间内能达到非常好的抑菌效果,但是不能长时间维持良好的抑菌性[5]。因此,推测用卵磷脂包埋Nisin形成脂质体能够使Nisin在食品体系中更加稳定且长效地发挥作用。
脂质体是由磷脂等脂类物质分散于水性介质中,自发形成的一种具有双分子层的封闭囊泡。脂质体的类生物膜结构使其具有良好的生物相容性、流动性和两侧不对称性,所以被用作活性物质的包埋基质,因其具有良好的缓释性和无毒性,被广泛运用于食品、农学、药剂学等不同领域[6-7]。脂质体的功能特性取决于其大小、组成和在食品体系中的稳定性,其大小由脂质体的分子性质、制备方法和所处的环境条件决定,其稳定性则取决于包埋物质、壁材的选择以及制备方法和体系pH值等因素[8-12]。
da Silva等[13]以卵磷脂为壁材包埋Nisin,研究了卵磷脂-Nisin脂质体对冷藏牛乳中单增李斯特菌的抑制效果,结果表明,相较于单独使用Nisin溶液,Nisin脂质体能够更有效地抑制牛乳中单增李斯特菌的生长。Prombutara等[14]的研究中,不同的pH值和NaCl浓度对载Nisin纳米颗粒的释放率有明显影响。Thomas等[15]的研究结果表明,体系pH值的变化对Nisin的抑菌活性也有显著影响。但鲜有学者研究pH值和热处理对Nisin脂质体稳定性和抑菌活性的影响。
为了提高Nisin的利用率,实现其长效、缓释型抑菌性能,本研究以大豆卵磷脂为壁材,采用薄膜-超声法将Nisin包裹在脂质体中,制备Nisin脂质体,研究其结构特性,并考察不同pH值条件下Nisin脂质体包埋率、缓释率及其贮藏稳定性;分析经高温灭菌后pH值对Nisin脂质体抑菌性的影响;通过抑菌圈直径、动力学杀菌曲线测定,探究不同pH值下Nisin脂质体对金黄色葡萄球菌和单增李斯特菌的持续性杀菌效果。
1 材料与方法
1.1 材料与试剂
大豆卵磷脂 上海源叶生物科技有限公司;Nisin 浙江新银象生物工程有限公司;金黄色葡萄球菌(Staphylococcus aureus)、单增李斯特菌(Listeria monocytogenes)由浙江工商大学食品与生物工程学院实验室自主分离并保藏;其余试剂均为国产分析纯。
1.2 仪器与设备
Nicolet iS5型傅里叶变换红外光谱仪 美国Thermo Scientific公司;RE-52 AAA型旋转蒸发器 上海嘉鹏科技有限公司;KH-300DE数控超声波清洗器昆山禾创超声仪器有限公司;Scientz-N型真空冷冻干燥机宁波新芝生物科技股份有限公司;Nano-ZS型激光光散射仪、Zetasizer Nano ZS 90型电位分析仪 英国马尔文仪器有限公司;BSC-250恒湿恒温培养箱 上海双旭电子有限公司。
1.3 方法
1.3.1 Nisin脂质体的制备
用薄膜超声分散法制备Nisin脂质体。称取一定质量的Nisin和大豆卵磷脂,Nisin用0.02 mol/mL的盐酸溶液溶解,然后用0.01 mol/mL的磷酸盐缓冲液(phosphate buffered saline,PBS)稀释到512 µg/mL;卵磷脂直接用蒸馏水溶解,使Nisin与卵磷脂质量比为1∶2。取卵磷脂溶液于圆底烧瓶中,在一定温度条件下进行旋转蒸发,至瓶壁出现蜂窝状晶体。取50 mL Nisin溶液,洗下瓶壁上的膜,在40 ℃水化30 min,然后50 ℃水浴超声30 min,超声功率为300 W,制备得到Nisin脂质体悬浊液,用0.22 µm的水系膜过滤,将Nisin脂质体悬浊液121 ℃高温灭菌15 min后待用[16-17]。
1.3.2 Nisin脂质体的特征结构分析
将0.1 g左右干燥的溴化钾粉末在玛瑙研钵中研成细粉,加入2 mg左右冷冻干燥的样品(Nisin、大豆卵磷脂、Nisin脂质体),混合均匀后装入模具压片。将制成的半透明薄片放在样品架上,插入仪器固定位置进行测定。选取4 000~400 cm-1作为扫描范围,4 cm-1为扫描频率[18],得到Nisin、大豆卵磷脂、Nisin脂质体的傅里叶变换红外光谱图。
1.3.3 Nisin脂质体的性质表征
1.3.3.1 Nisin脂质体粒径的测定
利用激光光散射仪测定Nisin脂质体的粒径[19]。将制得的Nisin脂质体用相同pH值和离子强度的蒸馏水稀释10 倍体积后,加至特定的测量皿中进行测定,避免多重光散射,测量温度为25 ℃,平衡时间为120 s,衍射角为173°,每个样品做3 个平行,取平均值得到粒径和多分散指数。
1.3.3.2 Nisin脂质体ζ-电位的测定
将样品稀释10 倍体积后测定其ζ-电位,设置测量温度25 ℃、平衡时间120 s,每个样品做3 次平行,取平均值得到ζ-电位。
1.3.3.3 Nisin脂质体包埋率的测定
按照1.3.1节的方法制备Nisin脂质体,采用离心法分离Nisin脂质体和未包埋的Nisin,用高速冷冻离心机在4 ℃下12 000 r/min离心15 min,用紫外分光光度计测定上清液吸光度,采用紫外吸收差法测标准曲线。准确称取0.1 g Nisin标准品,用适量盐酸溶解,并用蒸馏水定容到100 mL,配制成质量浓度1 mg/mL的储备液。分别移取0.1、0.2、0.4、0.6、0.8、1、2、4、6、8 mL至10 mL容量瓶中,用蒸馏水定容。分别在215 nm和225 nm波长处测其吸光度,以两个吸光度之差得到Nisin质量浓度的标准曲线为y=0.001 3x+0.003 3,R2=0.999 6(式中x为Nisin质量浓度/(μg/mL),y为吸光度)。结合标准曲线计算未包埋的Nisin质量,从而得到Nisin脂质体的包埋率[20],按下式计算。
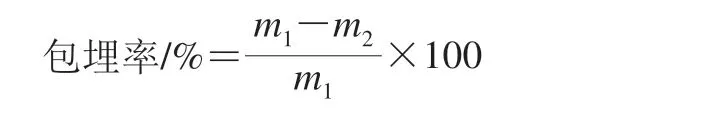
式中:m1为Nisin的总质量/μg;m2为未包埋Nisin的质量/μg。
1.3.3.4 Nisin脂质体的缓释动力学曲线测定
将Nisin脂质体悬浊液置于4 ℃冰箱中保存,每隔24 h取相同质量的溶液12 000 r/min离心15 min,按照
1.3.3.3节中方法测定上清液中Nisin质量,得到Nisin脂质体的缓释率[21]。
1.3.4 Nisin脂质体贮存稳定性的测定
按照1.3.1节的方法制备Nisin脂质体,并通过不同pH值的PBS调节其pH值分别为2、3、4、5、6、7,并贮存于4 ℃条件下,分别于0、3、6、9、12 d取样并分析Nisin脂质体的粒径、多分散指数、ζ-电位、包埋率和缓释率。
1.3.5 Nisin脂质体抑菌特性的测定
1.3.5.1 菌悬液的制备
将金黄色葡萄球菌和单增李斯特菌在LB肉汤培养基中,37 ℃、150 r/min摇床培养至对数期,用PBS洗涤并重悬制成106CFU/mL菌悬液。
1.3.5.2 最小抑菌浓度和最小杀菌浓度的测定
按照1.3.1节方法制备未加热灭菌的Nisin溶液、经高温灭菌的Nisin脂质体和Nisin溶液,并通过不同pH值的PBS调节其pH值分别至2、3、4、5、6、7,考察pH值对最小抑菌浓度(minimum inhibit concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)的影响以及Nisin脂质体包埋对Nisin的保护作用。采用96 孔板微量稀释法测定各样品的MIC和MBC[22]。
1.3.5.3 Nisin脂质体的动力学杀菌分析
用1×MHb(Mueller-Hinton Broth)将菌悬液稀释至106CFU/mL,并向其中加入终质量浓度为256 µg/mL的Nisin脂质体,考察pH值(分别为pH 2、3、4、5、6、7)对Nisin脂质体抑菌作用的影响[23],将同质量浓度的Nisin溶液作为对照组,分别考察其抑菌特性。将MH肉汤培养基置于37 ℃恒温恒湿培养箱中,分别在0、1、2、3、4、5、12 h进行菌落计数,计算菌落总数并绘制动力学杀菌曲线。
1.4 数据处理和分析
所有实验重复3 次,利用Origin 10.0软件作图,采用SPSS 22.0软件对数据进行方差分析,P<0.05为差异显著。
2 结果与分析
2.1 Nisin脂质体的傅里叶变换红外光谱分析结果

图 1 Nisin、大豆卵磷脂和Nisin脂质体的傅里叶变换红外光谱图Fig. 1 Fourier transform infrared spectra of nisin, soybean lecithin and nisin-loaded liposomes
如图1所示,Nisin在3 401 cm-1处观察到O—H和N—H的轴向拉伸,在2 964 cm-1处观察到C—H键的伸缩振动。卵磷脂在1 738 cm-1处为COO-中C=O的伸展振动。Nisin脂质体在3 406 cm-1处有较强吸收峰,与Nisin的N—H拉伸以及卵磷脂的伸缩振动有关,说明Nisin脂质体的形成使得卵磷脂与Nisin间形成了氢键,从而使吸收峰左移。而Nisin脂质体在2 926 cm-1处存在吸收峰则说明Nisin中C—H伸缩振动因为结合而向低波数方向移动。同时,1 738 cm-1处吸收峰的减弱表明Nisin脂质体形成过程中,卵磷脂中的C=O与Nisin酰胺带中的NH3+结合,导致C=O基团的特征吸收减弱,使NH3+谱带完全消失。通过对傅里叶变换红外光谱的分析可知,Nisin和卵磷脂以静电相互作用的方式结合在一起,且Nisin被包埋在内部,两者通过氢键结合以维持Nisin脂质体一定的结构特性[24-25]。
2.2 pH值对Nisin脂质体稳定性的影响
2.2.1 pH值对Nisin脂质体平均粒径的影响
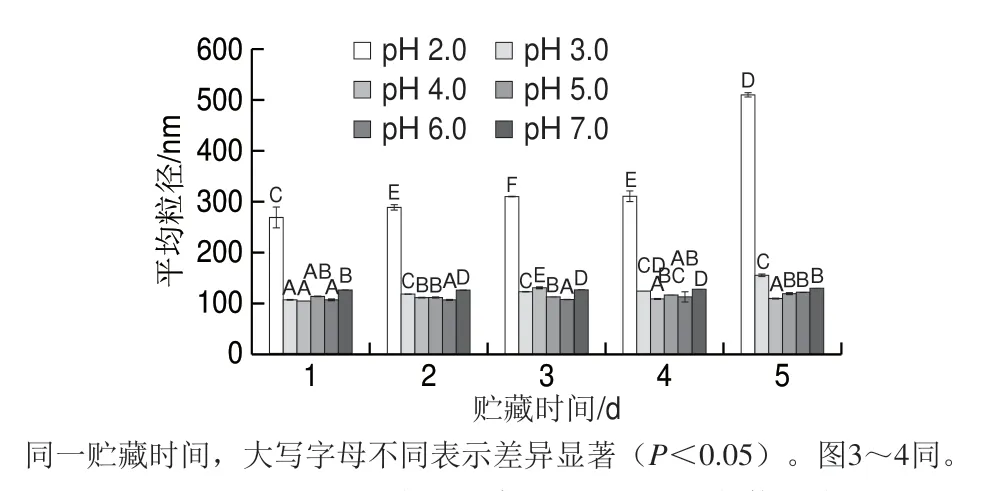
图 2 pH值对贮藏过程中Nisin脂质体粒径的影响Fig. 2 Effect of pH on particle size of nisin-loaded liposomesduring storage
如图2所示,相同贮藏条件下,pH 2.0的样品粒径最大,在贮藏末期其粒径明显增大,达到521.60 nm,与其他pH值条件下所得样品具有显著性差异(P<0.05),说明在静置贮藏过程中,pH 2.0的Nisin脂质体体系逐渐趋向于不稳定状态,使其粒径增大。pH 3.0的样品在贮藏末期粒径达到155.97 nm,与pH>3.0组的样品具有显著性差异(P<0.05)。而pH≥4.0组的样品在贮藏过程中粒径变化不明显。由此可知,低pH值条件会影响样品在贮藏期间的粒径,pH值越低影响越明显。造成此现象的原因可能是低pH值使Nisin脂质体体系中的H+增多,影响了Nisin脂质体的相互作用,使其结合力降低而导致粒径明显增大。
2.2.2 pH值对Nisin脂质体多分散指数的影响
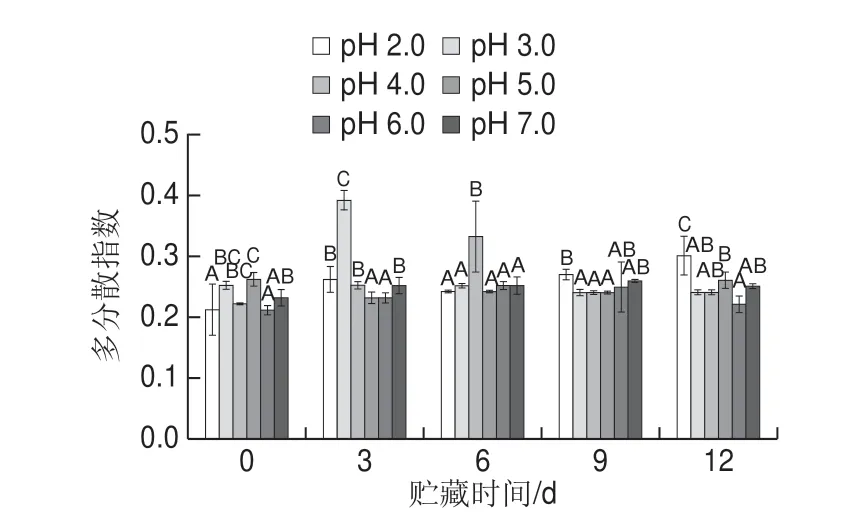
图 3 pH值对贮藏过程中Nisin脂质体多分散指数的影响Fig. 3 Effect of pH on polydispersity coefficient of nisin-loaded liposomes during storage
多分散指数是反映胶体体系中粒径分布的指标,其值越小说明粒径分布的范围越小,体系中颗粒的规整度越好,分散度越均匀[26]。如图3所示,贮藏过程中,pH<4.0的样品其多分散指数较高,在贮藏的第3天,pH 3.0的样品与其他样品产生显著性差异(P<0.05)。而pH≥6的样品在贮藏期间分散性在一定范围内维持较好的水平。说明pH值会影响Nisin脂质体的多分散指数,Nisin脂质体在较低的pH值体系中,体系颗粒的规整度和均一性变差,多分散指数增大,从而导致其在贮藏期间的稳定性变差。
2.2.3 pH值对Nisin脂质体ζ-电位的影响
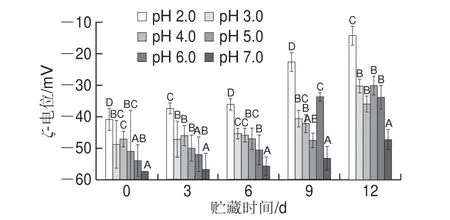
图 4 pH值对贮藏过程中Nisin脂质体ζ-电位的影响Fig. 4 Effect of pH on zeta potential of nisin-loaded liposomes during storage
ζ-电位是由体系中带电粒子的双电层产生的,其绝对值大小可反映体系的电荷稳定程度。当ζ-电位的绝对值大于30 mV时,则可认为体系是稳定的[27]。如图4所示,在同一pH值条件下,随着贮藏时间的变化,Nisin脂质体的ζ-电位绝对值呈逐渐减小的趋势。随着pH值的降低,Nisin脂质体的ζ-电位绝对值逐渐减小,说明pH值越低,Nisin脂质体越不稳定,越容易发生絮凝和沉淀。在贮藏过程中,pH 7.0的样品ζ-电位始终维持在-50 mV左右,表明Nisin脂质体在高pH值下的贮存稳定性较高。
Nisin带正电荷,大豆卵磷脂带负电荷,Nisin脂质体整体带负电荷。在静置贮藏过程中,体系的ζ-电位绝对值逐渐减小,粒径和多分散指数变化也更显著,说明Nisin脂质体体系随着贮藏时间的延长逐渐趋向于不稳定状态,有部分絮凝或沉淀产生,且pH值越低变化越显著。这是因为H+浓度增大,其与带负电荷的Nisin脂质体具有静电吸引力,导致Nisin和卵磷脂之间的静电引力减小,从而使Nisin脂质体的尺寸增大,粒子的规整度下降[28-29]。综合结果表明,pH≥6时制备的Nisin脂质体贮藏稳定性较好。
2.3 pH值对Nisin脂质体包埋率的影响
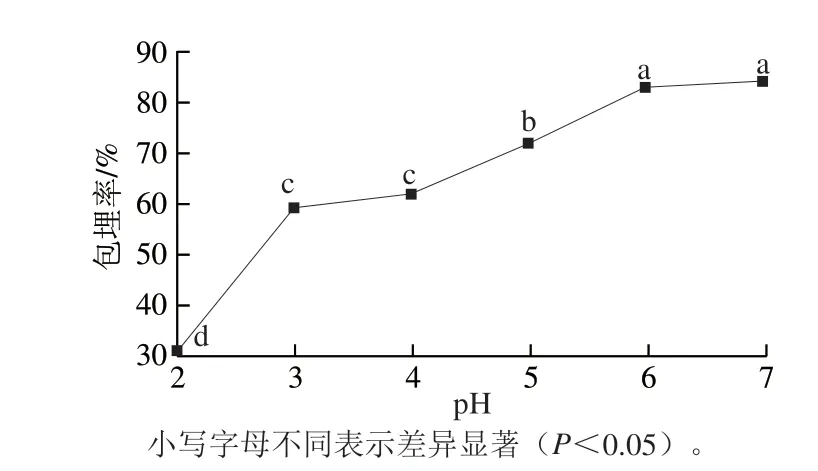
图 5 pH值对Nisin脂质体包埋率的影响Fig. 5 Effect of pH on encapsulation efficiency of nisin-loaded liposomes
如图5所示,pH值对Nisin脂质体的包埋率具有一定影响,包埋率总体上随pH值升高而增加。当pH值为2.0时,Nisin脂质体的包埋率仅为32.69%;当pH值达到6.0和7.0时,Nisin脂质体的包埋率显著增大(P<0.05),分别达到82.99%和82.26%,且两者的包埋率无显著性差异。这与Nisin脂质体在不同pH值条件下的稳定性有关。pH值越低,体系中的H+越多,卵磷脂与Nisin之间的静电相互作用力减弱,体系越不稳定,Nisin不能有效地包埋进磷脂双分子层内,导致包埋率减小。
2.4 pH值对Nisin脂质体缓释率的影响
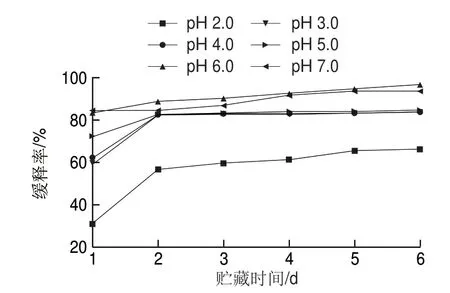
图 6 不同贮藏时间Nisin脂质体的缓释率Fig. 6 Slow release efficiency of nisin-loaded liposomes during storage
如图6所示,不同pH值条件制得的Nisin脂质体的缓释效果总体趋势相近,但是缓释能力不同。贮藏时间相同时,pH 6.0和pH 7.0样品有较好的缓释能力,在贮藏末期两者的缓释率分别达到96.49%和93.49%;pH 2.0样品的缓释能力最弱,在贮藏末期缓释率仅达到66.07%,与pH 6.0和pH 7.0样品具有显著性差异(P<0.05)。结合图5结果可知,包埋率高的Nisin脂质体在贮藏期间缓释效果好,反之亦然。说明pH 6.0和pH 7.0条件下,Nisin脂质体对Nisin有较好的包埋效果和缓释效果。
2.5 Nisin脂质体的抑菌特性及影响因素分析
2.5.1 Nisin脂质体的MIC和MBC分析
如表1所示,当Nisin溶液经过高温灭菌处理后,其活性受到明显影响,失去原有的抑菌特性,但Nisin脂质体仍保有良好的抑菌能力,说明Nisin脂质体的结构可以保护Nisin单体不受高温环境的影响,维持其抑菌活性,因此Nisin脂质体具有较好的耐高温性质[30]。不同pH值条件下,Nisin溶液的抑菌效果和杀菌效果优于Nisin脂质体,且pH值越低,Nisin溶液和Nisin脂质体的抑菌效果越好。这可能是因为较低的pH值条件有利于体系中H+浓度的增加,而H+对一般的细菌具有较强的抑制作用,使细菌无法耐受低pH值环境,从而达到促进其抑菌效果的目的。
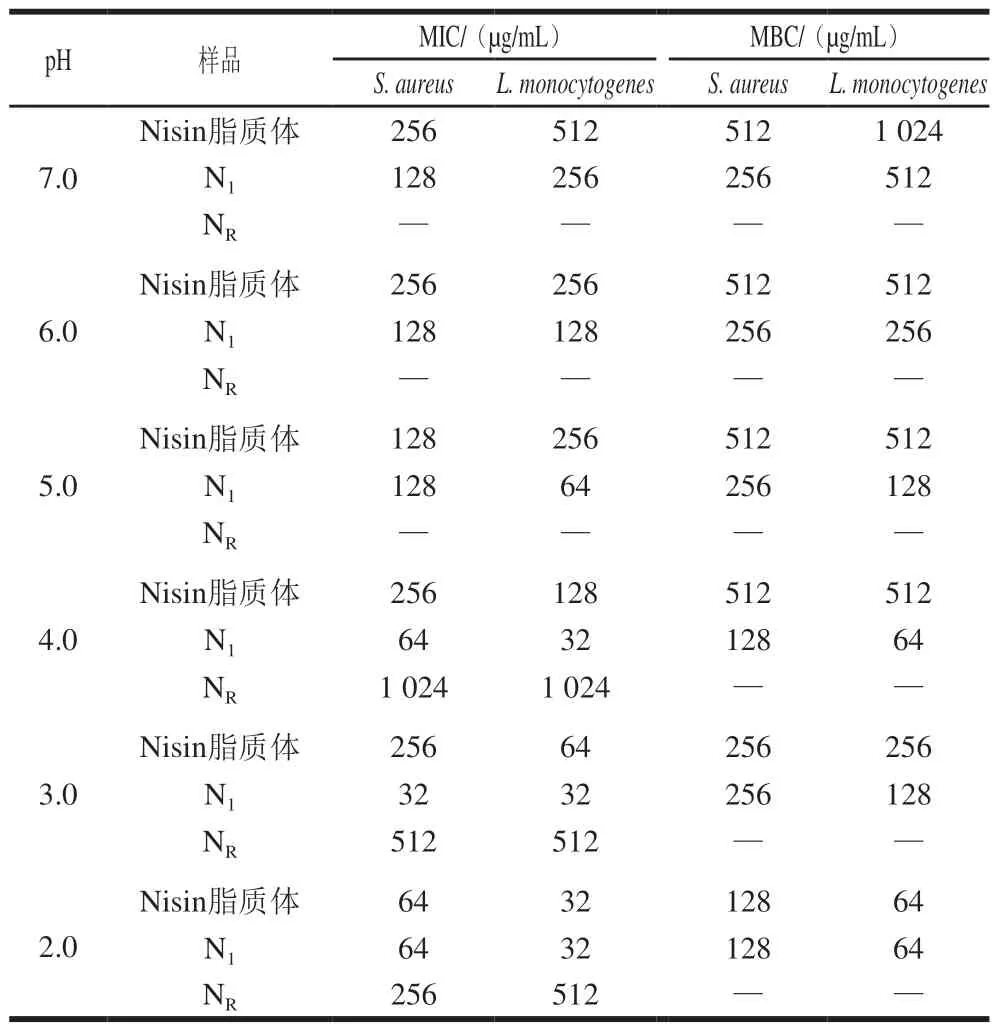
表 1 不同样品的MIC和MBCTable 1 MIC and MBC of nisin-loaded liposomes and different antibacterial agents against bacteria
2.5.2 Nisin脂质体持续性杀菌效果分析

图 7 pH值对脂质体动力学杀菌作用的影响Fig. 7 Effect of pH on bactericidal activity of nisin-loaded liposomes
如图7所示,以Nisin溶液为对照组,不同的pH值条件下,Nisin脂质体分别对金黄色葡萄球菌和单增李斯特菌显示出不同的杀菌效果,pH值越低,Nisin脂质体的杀菌作用越强。从图7A中可以看出,当pH<4.0时,Nisin脂质体在4 h时菌落总数最低;随着时间的延长,其菌落总数增加了近两个数量级,不能完全杀死细菌,而Nisin脂质体能在5 h后杀灭大部分的细菌,显示出良好的抑菌性。
从图7B中可以看出,在2 h时Nisin溶液组的菌落总数迅速降低,此时Nisin脂质体菌落总数高于Nisin溶液组,这可能是由于Nisin脂质体的缓释效果,在2 h时释放的Nisin不能完全杀死所有的细菌。随着时间的延长,Nisin溶液组的菌落总数迅速增大,pH≤6.0条件下的Nisin脂质体逐渐释放出大量的Nisin,表现出其对细菌的持续性杀菌效果,其中在5 h时,pH<4.0条件下的Nisin脂质体杀死了大部分细菌。
由此可知,Nisin溶液虽然在初期显示出良好的抑菌性,但是随着时间的延长,其抑菌效果减弱,而不同pH值条件下的Nisin脂质体具有良好的缓释效果,随着时间的延长显示出一定的持续性抑菌性能,低pH值会促进其抑菌作用的发挥。
3 结 论
研究结果表明,pH值对Nisin脂质体的稳定性具有很大影响。pH值越低,体系中H+浓度越高,Nisin和卵磷脂之间的静电相互作用力减弱,导致Nisin脂质体粒径增加、粒子迁移受阻,包埋率下降,从而使其稳定性降低,在贮藏使用过程中容易出现絮凝、沉淀等现象。贮藏时间相同时,pH 6.0和pH 7.0条件下制备的Nisin脂质体缓释性和贮藏稳定性优于其他样品。Nisin脂质体结构有利于提高Nisin的耐热性,能防止Nisin活性因高温杀菌处理而受到损失,使其在不同pH值条件下都能够维持较优的抑菌能力;同时,低pH值条件能促进Nisin脂质体的抑菌效果。Nisin脂质体具有一定的持续抑菌性能,pH值越低,其缓释效果越好,持续抑菌时间越长。因此,Nisin脂质体可用作新型长效抑菌剂的开发。在pH 6.0和pH 7.0条件下制备的Nisin脂质体有较好的缓释性和贮藏稳定性,在此pH值范围内的Nisin脂质体在高温灭菌后仍然有较好的和持续性的杀菌效果,因此可以选择pH 6.0~7.0条件下制备Nisin脂质体进行生产化。在实际应用中,可根据食品基质的不同pH值和其食品特性来选择不同的pH值条件制备Nisin脂质体。

