动力学控制的对氯三氟甲苯硝化反应热危险性研究
姜晓雨 陈利平 郭子超

摘 要:为了研究动力学控制的半间歇硝化反应过程中的放热可能造成的危险,以对氯三氟甲苯硝化反应为例,使用反应量热仪(RC1e)研究硝酸过用率、反应温度对目的反应放热的影响,对工艺放热过程进行危险性分析,并提出优化工艺条件。结果表明:该硝化反应搅拌速率到达300 r/min级以上时,反应不受搅拌速率影响;反应速率随反应温度的增高而降增,热累积度便随反应温度的增高而降增;改变对氯三氟甲苯投入量,单位质量放热量随硝酸过用率的减小而减少,反应热失控风险降低。综合分析优化条件下该反应危险严重度,属于“中级”危险。
关 键 词:动力学控制;对氯三氟甲苯;硝化;热危险性;反应量热仪
中图分类号:O625.1;X937 文献标识码: A 文章编号: 1671-0460(2019)04-0754-05
Abstract: The thermal hazard of exothermic nitration reactions with single kinetic control in semi-batch reactors, such as nitration of 4-chlorobenzotrifluoride,was analyzed by Reactor Calorimeter(RC1) .The influence of overuse ratio of nitric acid and temperature on heat release rate was investigated. According to thermal analysis of reaction under different operation conditions, optimal process conditions were proposed. The results showed that the influence of stirring speed could be neglected, if its value exceeded 300 rpm;With the increase of temperature, the reaction rate accelerated and thermal accumulation decreased; The unit mass heat release decreased with decreasing of overuse ratio of nitric acid, as a result, the risk of thermal runaway reduced. Under optimal operation conditions, the severity of nitration of 4-chlorobenzotrifluoride was ‘medium.
Key words: Single kinetic control; 4-chlorobenzotrifluoride; Nitration reaction; Thermal hazard; RC1
早在上个世纪60、70年代,在工业领域便形成了对反应放热危险性的系统认识和研究,Francis Stoessel总结前人成果并结合自身研究[1-3],系统介绍了化工工艺热安全、热失控的概念、热危险性评估方法等等[4]。硝化反应作为最早的有机化学反应之一,伴随着放热量巨大且反应机理复杂的特点[5-8]。实际工业生产中,常以半间歇加料方式将被硝化物料(分散相)加入硝硫混酸(连续相),因此硝化反应也是典型的非均相反应。
前人对于非均相反应的热风险评估进行了大量研究工作。Westerterp对安全界限图应用于反应级数为(1,1)的液-液非均相反应的情况进行了系统考察,并认为若直接应用于其它非一级反应,可能导致评估结果过于保守或不够安全[9];此外,Francesco M, Renato还提出了另一种方法:温度图评估法(Temperature Diagram)[10]。Guo等人提出一种新的绝热判据,对于判断半间歇非均相反应在其工艺操作条件下的热失控风险[11]。
在非均相系中进行的反应,通常会受到来自化学反应和物质传递的共同作用,在工艺条件(如加料速度、反应温度、搅拌速率、硝酸过用率等)改变时,反应可被分为动力学控制或扩散控制反应[12-14]。对氯三氟甲苯硝化就是一个典型的动力学控制反应[15],即在该反应体系中,对氯三氟甲苯在硝硫混酸中的的扩散速度远大于反应速率,相较于传质扩散过程,化学反应的影响作用占主导地位。搅拌速率是影响非均相反应的一个重要因素,在确定某一搅拌速率使反应为动力学控制后,加快搅拌速率并不影响该动力学控制反应的进程。而目前对于非均相体系反应的热危险性研究,如刘纯等对硝酸氧化仲辛醇液液非均相反应过程进行热危险性分析[16],姜君等对过氧化苯甲酰合成工艺进行热危险性分析[17],王韶旭对丹酚酸B的热稳定性及其热分解动力学研究[18]等等,都未详细区分反应是受动力学控制或扩散控制。
因此,将反应类型区分为受动力学控制或扩散控制,进行热危险性评估研究并优化反应工艺条件是有必要的。同时,对氯三氟甲苯及其硝化生成的硝基衍生物是一类重要的含氟类芳烃中间体,被广泛使用于合成农用、医药产品领域[19-21]。因此,以对氯三氟甲苯硝化反应为例,研究动力学控制反应放热过程中可能造成的危险,对于促进我国相关硝化工业的安全生产具有重要的意义。
为获取对氯三氟甲苯硝化反应过程中的熱信息,首先使用使用差示扫描量热仪(DSC)对反应物料、反应产物进行热稳定性测试,获取物质的起始分解温度,为下一步的硝化反应实验提供参考数据[22];通过计算得到适合的搅拌速率后,再使用反应量热仪(RC1),初步研究了氯三氟甲苯硝化过程中反应温度、硝酸过用率对目的反应放热的影响。这将有助于优化该化学反应工艺的操作条件,降低其热失控风险,促进安全生产。
1 实验部分
1.1 反应原理
对氯三氟甲苯作为分散相介质,经过强烈搅拌快速穿越两相液膜,并在连续相,即酸相进行硝化反应过程[23]。硝硫混酸作为硝化反应中常用的硝化剂,其中的硫酸作为强质子酸可大大提高硝酸的硝化能力。对氯三氟甲苯一段硝化反应机理如图1所示。
对氯三氟甲苯一段硝化温度约为37 ℃,二次硝化温度大约为110 ℃[24],温差较大,因此本文在研究对氯三氟甲苯一段硝化反应危险性时,不考虑二次硝化这一副反应造成的影響。
1.2 试样与测试条件
以下所涉及原料浓度皆为质量分数w(%),原料试样情况为:对氯三氟甲苯:99%,上海迈瑞尔化学技术有限公司;硝酸:65%~68%,国药集团化学试剂有限公司;硫酸:98%,国药集团化学试剂有限公司。
反应过程中搅拌速度可通过计算八田数Ha的值来确定。
(1)以5 g/min的加料速率,在37、47、52 ℃的反应温度下,将433.2 g对氯三氟甲苯加入707.6 g硝硫混酸中。
(2)在37 ℃时,分别将400.0 g(2.2 mol)、433.2 g(2.4 mol)对氯三氟甲苯分别加入707.6 g硝硫混酸(硝酸1.99 mol)中。
2 DSC实验结果与分析
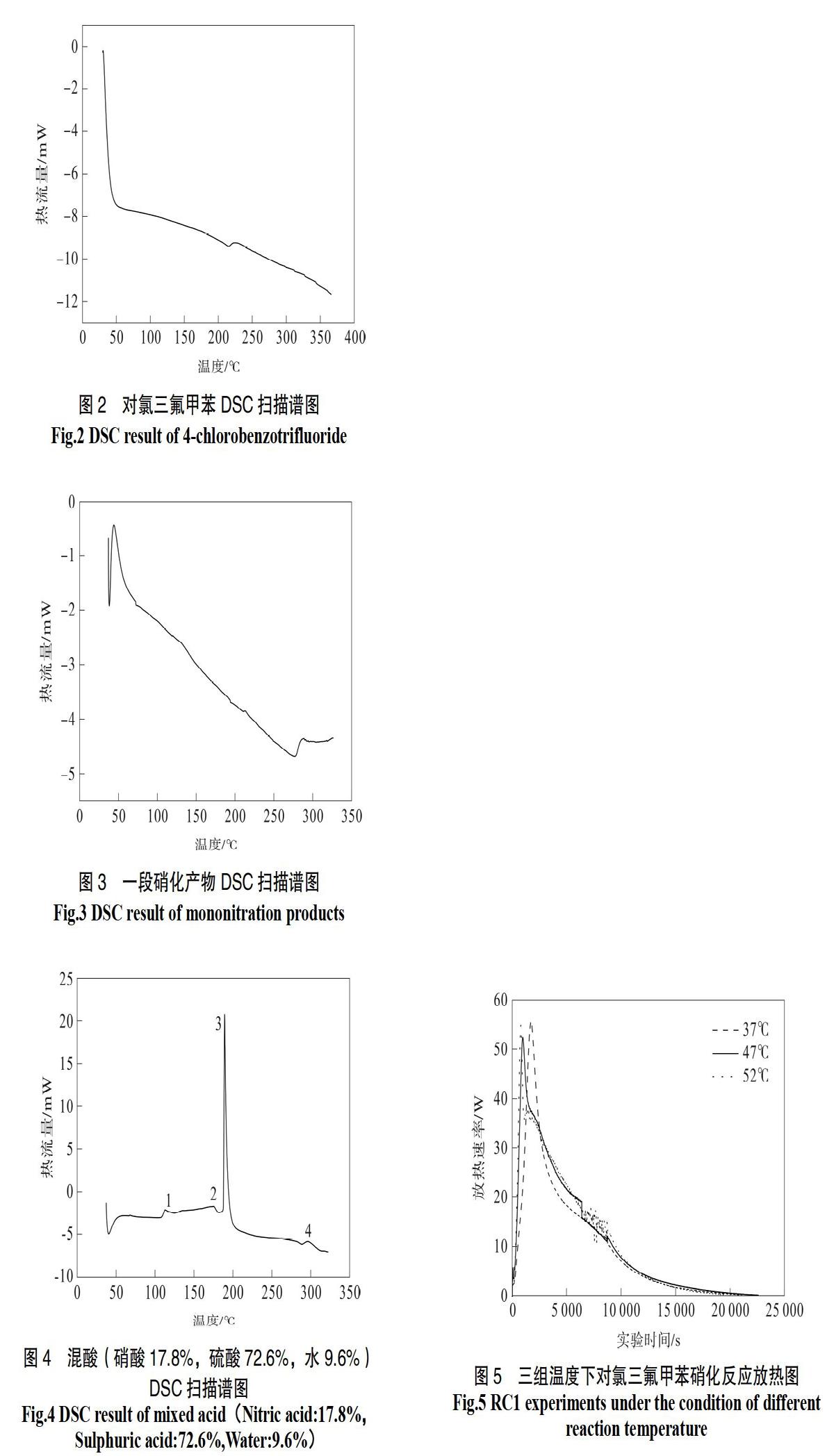
实验所用DSC由瑞士Mettler Toledo公司制造。实验采用密封不锈钢坩埚,在氮气气氛下,采用10 ℃/min的升温速率,温度范围为40~350 ℃。对氯三氟甲苯、混酸、一段硝化硝化产物一硝基对氯三氟甲苯的DSC筛选实验结果如图2-4。
对氯三氟甲苯及其一段硝化产物试样量分别为1.43、1.21 mg,由图2、图3可知,试样均无明显吸放热峰,意味着该物质在温度升高时稳定性好,不易发生分解反应,造成热失控可能性较小。
在图4中,混酸样品的组成为硝酸17.8%,硫酸72.6%,水9.6%。混酸样品DSC扫描结果发现出现多个放热峰,可能是混酸样品池发生了反应或者加热条件下混酸热分解造成。
由文献[27]可知,不同质量、浓度的硫酸的DSC谱图均存在一尖锐的放热峰,而硝酸DSC无规律可循,因此可认为放热峰3主要由硫酸引起。浓硫酸会在不锈钢的表面形成钝态表面,进一步阻止其与不锈钢反应发生。而升温条件下硝酸易分解,同时硝酸也会与不锈钢样品池发生反应。因此,可以认为放热峰1、2、4主要由硝酸热与不锈钢坩埚发生反应而导致。
对第三个尖锐的放热峰进行处理,可知:混酸的起始分解温度为201.26 ℃,根据“100 ℃法则”,若混酸的温度依存性评级为“正常”,则其热分解温度约为141.26 ℃。也就是说对于该非均相硝化反应体系,一旦冷却失效情况发生,体系温度接近141.26 ℃,就可能会引发混酸的热分解,并释放大量分解热从而提升反应体系温度,发生热失控。因此,在进行对氯三氟甲苯半间歇硝化实验时,要时刻注意控制体系温度,观察是否有硝烟溢出,预防混酸热分解现象。
3 RC1量热实验实验结果与分析
实验所用RC1e由瑞士Mettler Toledo公司制造,在满足实际工艺条件及投料配比的基础上,缩放至实验室规模,模拟化学工艺过程的具体过程及详细步骤,可以准确地监控和测量化学反应过程,获得反应的放热速率、放热量及比热容、综合传热系数等参数信息,从而进行分析并对工艺过程进行热安全评估。
3.1 温度的影响
共进行三组不同温度下的目标反应。在37 ℃、47、52 ℃的反应温度下,在145 min内将433.2 g对氯三氟甲苯加入707.6 g硝硫混酸中。实验放热情况如图5。
由图5可知,三个温度能达到的最大放热速率数值接近,约为55 W,而出现最大放热速的时间随着反应温度的升高而提前。其中,曲线1、曲线2重叠程度较高。该现象表明:反应温度的提高加快反应速率,反应的热危险性也提高。反应温度为47、52 ℃时,反应进行的程度接近。
3.2 硝酸过用率的影响
在37℃的反应温度下,分别将400.0(2.2 mol)g、433.2 g(2.4 mol)对氯三氟甲苯分别加入707.6g硝硫混酸(硝酸1.99 mol)中。其中,为保证硝酸的转化率,加入的对氯三氟甲苯的量都是过量的。三组不同硝酸过用率下对氯三氟甲苯硝化反应放热情况如图6所示。
由图6可知,在不同的硝酸过用率条件下能达到的最大放热速率数值接近,约为55 W,而出现最大放热速的时间随着加料总量的增加而延后,该现象表明:硝酸过用率越大,反应速率越快。
3.3 不同反应条件下的放热分析
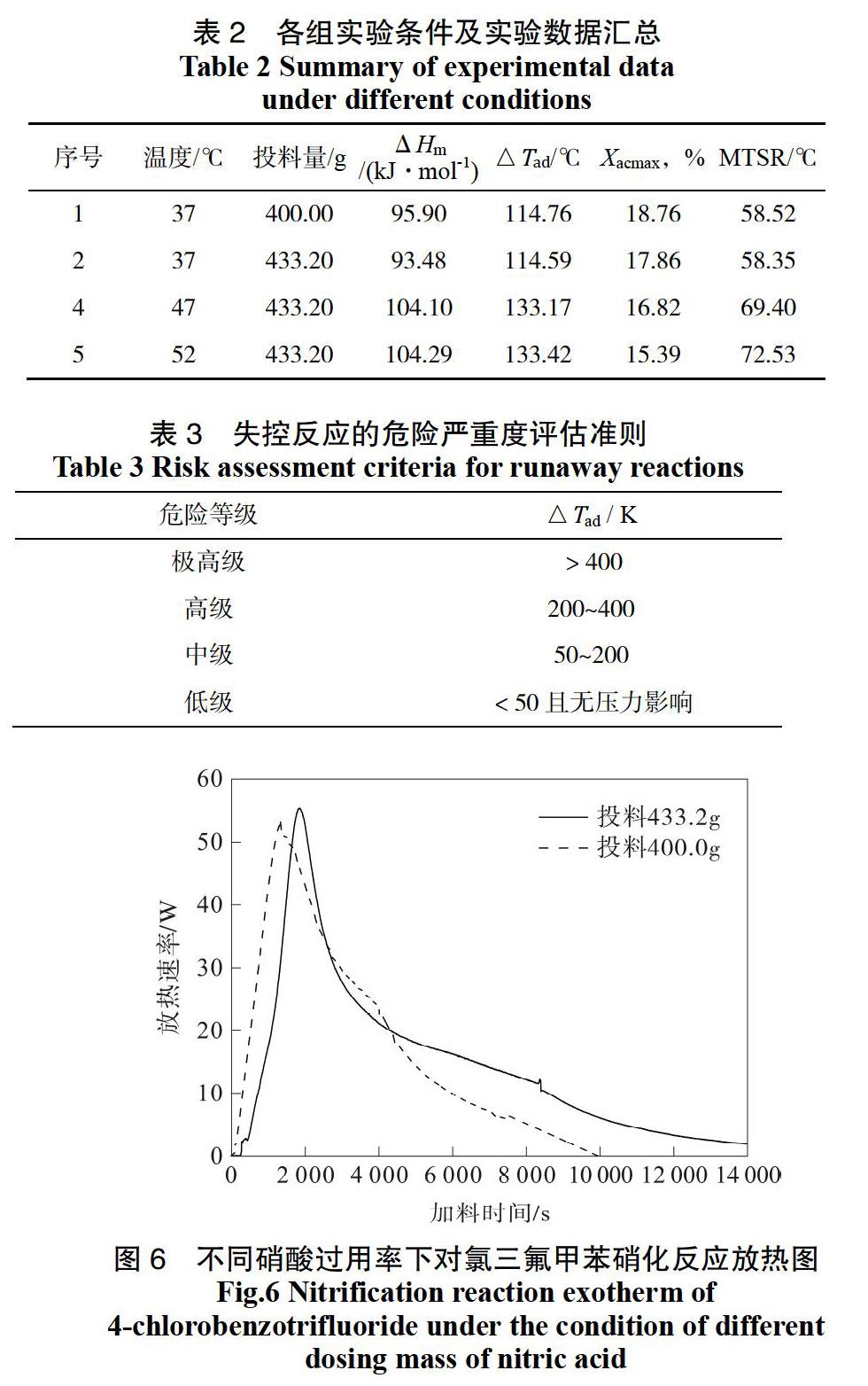
对实验所得数据进行处理后得到表2。反应热ΔH(kJ),是指料RC1实验所测得的总反应放热量,将其与对氯三氟甲苯的加入量相结合,可得单位摩尔质量对氯三氟甲苯加入过量硝酸中反应的单位放热量,ΔHm(kJ/mol)。此外,将ΔH除以反应系统的质量和比热容,便得到反应物料的绝热温升?Tad[28]。MTSR可由公式2计算得到:
对比实验1、2可知,在相同温度下,相较于加入399.96 g对氯三氟甲苯,在433.20 g对氯三氟甲苯加料结束后所得的单位放热量及MTSR数值较低。这是因为实验2加入的对氯三氟甲苯量多,硝酸过率则小,在加料结束后硝酸浓度最小,使硝酰阳离子不易形成,从而部分对氯三氟甲苯未被硝化。但是,若一味提高硝酸过用率,则会造成体系反应速率过快,迅速升温引起混酸分解,使体系对于温度的敏感度增强,更易造成热失控危险。因此,在化学计量比投料量的基础上,适量加大对氯三氟甲苯的投料,可以达到提高反应程度,又确保热安全性的目的。从单位放热量及MTSR数据来看,实验2、3的硝酸过用率都是可以接受的,该硝化反应可控制对氯三氟甲苯的投料量在400.0~433.2 g之间,即n(硝酸):n(对氯三氟甲苯)=1:1.11~1:1.2。
对比实验2、3、4可知,在145 min内以3 g/min的加料速度滴加433.2 g对氯三氟甲苯的情况下,提高反应温度,绝热温升及MTSR数值升高,且单位放热量随之升高,单位放热量越大意味着反应越充分。其中试验3、4的绝热温升、单位放热量数值与反应温度为60 ℃时[15]相近,可以认为在47~60 ℃的反应温度下,反应程度接近。适当升高反应温度,可使反应更加充分,同时要避免不必要的温度升高,避免出现热失控以及浪费能源的情况。因此,对氯三氟甲苯一段硝化反应温度可在47~52 ℃之间选取。
通过反應量热实验可知,在搅拌速率为300 r/min,反应温度为47~52 ℃的情况下,在145 min内于707.6 g硝硫混酸反应体系加入400.0~433.2 g对氯三氟甲苯,反应过程绝热温升平均值为133.30 K,依据表3评估准则[5],对反应危险严重度评级为“中级”。
在优化条件下的对氯三氟甲苯硝化反应过程中,虽然反应釜在冷却失效所能到达的最高温度MTSR均低于硝酸、硫酸的沸点,同时反应的绝热温升又均高于硝酸的沸点。因此,一旦出现热失控现象,反应过程有可能出现黄色硝烟,即硝酸热分解现象,此时应及时停止加料,降低硝烟溢出危险,提高反应的安全性。
4 结 论
(1)搅拌速率是影响液液非均相反应热释放的一个重要因素,但是对于动力学控制的非均相反应:对氯三氟甲苯硝化反应,当搅拌速率到达300 r/min级以上时,反应不受搅拌速率影响。
(2)硝酸过用率、反应温度对对氯三氟甲苯硝化反应均有影响:改变对氯三氟甲苯投入量,单位质量放热量随硝酸过用率的减小而减少;反应速率以及MTSR随反应温度的增高而递增,热累积度降低。在实际工艺生产过程中,适当减少硝酸过用率、增大反应温度都可以一定程度上降低反应的热失控风险。
(3)对氯三氟甲苯硝化反应条件可优化为:搅拌速率为300 r/min,反应温度范围为47~52 ℃,投料比为n(硝酸)∶n(对氯三氟甲苯)=1∶1.11~1∶1.2。反应的平均绝热温升为133.30 K,反应危险严重度评级为“中级”。
(4)在计算反应放热量时,并未修正除去硝硫混酸被反应产生的水稀释所放出热量。目前,尚未有广泛认可、使用的修正硝硫混酸物理热效应的方法,这也是硝化反应未来需要进一步发展的方向。
参考文献:
[1] Stoessel F. Applications of reaction calorimetry in chemical engineering [J].Journal of Thermal Analysis,1997,49(3):1677-1688.
[2] Stoessel F, Ubrich O.Safety Assessment and Optimization of Semi-batch Reactions by Calorimetry [J]. Journal of Thermal Analysis and Calorimetry,2001,64(1):61-74.
[3]Stoessel F. Planning protection measures against runaway reactions using criticality classes[J].Process safety and environmental protection, 2009,87 (2): 105-112.
[4]弗朗西斯·施特塞尔.化工工艺的热安全:风险评估与工艺设计[M]. 北京:科学出版社,2009:51-80.
[5]刘涛,刘强.2-氟-4-氯-5-甲氧羰基甲硫基苯基异硫氰酸酯合成工艺的研究[J].当代化工, 2013(5):669-672.
[6] 周奕杉.甲苯一段硝化反应热失控历程研究[D].南京理工大学,2015.
[7]Chen L P, Liu T T, Yang Q, et al. Thermal hazard evaluation for iso-octanol nitration with mixed acid[J]. Journal of Loss Prevention in the Process Industries, 2012, 25(3):631-635.
[8] Yang T, Chen L, Chen W, et al. Thermal stability of 2-ethylhexyl nitrate with acid[J]. Journal of Thermal Analysis & Calorimetry, 2015, 119(1):205-212.
[9]Westerterp K.R, Lewak M, Molga E.J, et al.Boundary diagrams safety criterion for liquid phase homogeneous semibatch reactors[J]. Ind. Eng. Chem. Res. 2014,53 :5778–5791.
[10]Francesco M, Renato R, et al. Temperature diagrams for preventing decomposition or side reactions in liquid–liquid semibatch reactors [J]. Chemical Engineering Science, 2006, 61(10):3068-3078.
[11]Guo Z, Chen L, Chen W. Development of Adiabatic Criterion for Runaway Detection and Safe Operating Condition Designing in Semibatch Reactors[J]. Industrial & Engineering Chemistry Research, 2017, 56(50):14771?14780.
[12]陈利平,陈网桦,李春光,等.混酸中甲苯半间歇硝化过程的危险性研究[J]. 中国安全科学学报,2007,17(12):102-106.
[13] Maestri F, Rota R. Thermally safe operation of liquid–liquid semibatch reactors. Part I: Single kinetically controlled reactions with arbitrary reaction order[J]. Chemical Engineering Science, 2005, 60(12):3309-3322.
[14] Maestri F, Rota R. Thermally safe operation of liquid–liquid semibatch reactors Part II: Single diffusion controlled reactions with arbitrary reaction order[J]. Chemical Engineering Science, 2005, 60(20):5590-5602.
[15]Maestri F, Rota R. Kinetic-free safe optimization of a semibatch runaway reaction: the nitration of 4-chloro benzotrifluoride[J]. Industrial & Engineering Chemistry Research, 2016, 55(50):925-933.
[16]刘纯,潘旭海,陈发明,等. 硝酸氧化仲辛醇液液非均相反应过程热危险性分析[J].南京工业大学学报(自然科学版), 2011, 33 (2): 104-108.
[17]姜君,江佳佳,蒋军成,等. 过氧化苯甲酰合成工艺热危险性分析[J]. 安全与环境学报, 2017, 17(2):439-445.
[18]王韶旭,谭志诚,车如心,等.丹酚酸B的热稳定性及其热分解动力学研究[J].化学学报,2012,70(2):212-216.
[19]Copelli S, Derudi M, Cattaneo C S, et al. Synthesis of 4-Chloro-3-nitrobenzotrifluoride: Industrial thermal runaway simulation due to cooling system failure[J]. Process Safety & Environmental Protection, 2014, 92(6):659-668.
[20]程隆新.三氟甲基农药的开发进展[J].现代农药,2004,3(3):7-11.
[21]Ismail F M D. Important Fluorinated Drugs in Experimental and Clinical Use[J]. Journal of Fluorine Chemistry, 2003, 34(11):27-33.
[22]Borchardt H J, Daniels F. The Application of Differential Thermal Analysis to the Study of Reaction Kinetics1[J]. Journal of the American Chemical Society, 1957, 79(1):1179-98.
[23]Maestri F, Copelli S, Rota R, et al. Simple Procedure for Optimal Scale-up of Fine Chemical Processes. II. Nitration of 4-Chlorobenzotrifluoride[J]. Industrial & Engineering Chemistry Research, 2009, 48(3):1316-1324.
[24]王双.对氯三氟甲苯的硝基衍生物合成研究[D].南京理工大学, 2008.
[25]Zaldívar J M, Molga E, Alós M A, et al. Aromatic nitrations by mixed acid. Fast liquid-liquid reaction regime[J]. Chemical Engineering & Processing Process Intensification, 1995, 35(6):543-559.
[26]Zaldívar J M, Molga E, Alós M A, et al. Aromatic nitrations by mixed acid. Slow liquid-liquid reaction regime[J]. Chemical Engineering & Processing Process Intensification, 1995, 34(5):543-559.
[27] 陳利平. 甲苯硝化反应热危险性的实验与理论研究[D]. 南京理工大学, 2009.
[28]Krause J P, Mock R, Gheorghe A V. Assessment of risks from technical systems: integrating fuzzy logic into the Zurich Hazard Analysis method[J]. International Journal of Environment & Pollution, 1995, 5(5):278-296.

