N掺杂对α-石墨炔表面吸附H2O,H,O和OH的电子性质和磁性的影响
李慧婷,马亚强,戴宪起
(河南师范大学 物理与材料科学学院,新乡 453007)
1 引 言
近年来,由于石墨烯独特的物理、电子和机械性能,在太阳能电池、液晶、纳米级晶体管等许多领域得到应用. 在石墨烯的研究取得巨大成功的推动下,科学领域越来越关注其他具有类似石墨烯电子性质的碳的同素异形体[1, 2]. 石墨炔是另一种二维碳的同素异形体,在结构上,其通过在石墨烯的两个C-C单键中插入炔键(-C≡C-)来实现的,在石墨炔中包含sp和sp2两种杂化的碳原子[3]. 自从2010年李玉良课题组首次通过化学合成以来,石墨炔吸引了物理、化学、能源等多个领域科学研究者的探索,在多个领域展示出潜在的应用前景[4]. α-石墨炔具有与石墨烯类似的电子结构:在费米能级附近具有半金属性,表现出优异的光学和电子性质,且具有石墨烯不具备的高活性炔键单元[5],因此引起广大研究者的兴趣.
掺杂作为调控材料电子性能较为常用和有效的方法之一,受到许多研究者的青睐. 在纳米结构中掺杂原子、分子或分子基团,被认为是一种调整其性能的可行性方法[6]. 近年来,对非金属原子(N、B、S、Si、P等)掺杂碳材料的研究较为广泛,其中的研究表明,Be、Se和P掺杂石墨烯作为吸附NO2、SO2和O2的良好传感器材料[7]. 与其他非金属原子相比,N掺杂是研究最为深入的掺杂模型,因为N元素紧邻C,且其电负性大于C原子[8]. 氮(N)掺杂碳材料的研究极为广泛,如N掺杂石墨烯[9]、碳纳米管[10]、碳纳米纤维[11]、纳米金刚石[12]等,因其具有较高的催化性能,是最有希望替代高成本催化剂的材料之一.
众所周知,吸附是一种切实可行的操纵和控制材料电子性能的方法,典型的二维材料由于具有较大的表面积比和高导电性,非常适合于表面吸附的研究[13]. 此外,二维材料对小分子的吸附性能研究,还是纳米级传感器的主要研发方向. 研究表明,碳纳米管、富勒烯、金属有机物、共价有机物、石墨烯等都是良好的碳基吸附型材料[14]. 研究者发现,分子吸附法是优化石墨烯p、n掺杂的一种较好的方法[15].
已有文献主要对单层α-石墨炔引入N掺杂后催化性能开展研究,对H、O、OH和H2O分子等吸附后电子结构变化缺乏关注. 因此,结合N原子掺杂对其电子结构的影响,本文采用第一性原理计算方法,研究了α-石墨炔引入N掺杂前后对H、O、OH和H2O分子吸附性能的影响,以期为设计α-石墨炔基传感器的研究提供新的思路.
2 计算方法
本研究采用基于密度泛函理论下的第一性原理方法,晶体结构优化和电子结构的计算基于VASP软件包[16],交换-关联势采用的是广义梯度近似(GGA)下的PBE泛函[17]. 计算过程中,平面波截断动能设置为500 eV,布里渊区中k点由Monkhorst-pack的格点方法产生[18]. 结构采用共轭梯度方法进行弛豫,能量收敛判据为每个单胞10-5eV,力的收敛标准为每个原子上的Hellmann-Feynman力小于0.01 eV/Å. 在进行结构优化时k点选取3×3×1,电子结构和态密度(DOS)的计算k点选取5×5×1. 范德华力修正采用DFT-D3的方法[19]. 为了保证良好的周期性边界条件选取3×3的超胞,z方向取15 Å的真空层以避免层间的相互作用.
为了研究掺杂N原子之后体系结构的稳定性,体系形成能得Efor计算为
Efor=EN-GY-EGY+EC-EN
(1)
其中,EN-GY表示掺杂之后体系的总能,EGY表示原始α-石墨炔的总能,EC和EN分别表示单个C原子和N原子能量. 形成能越低,表明掺杂体系越稳定.
体系的吸附能Eads的计算采用
Eads=Etotal-(Esheet+Em)
(2)
其中,Etotal表示吸附之后体系的总能,Esheet表示未吸附体系的总能,Em表示吸附的H原子、O原子、OH或H2O分子的能量. 吸附能为负值时,表明吸附后体系的总能量低于吸附前体系的总能量,吸附更稳定.
3 结果与讨论
3.1 N原子掺杂对本征α-石墨炔电子结构影响
我们首先计算了单层α-石墨炔的结构参数、态密度和能带结构. 结果展示在图1中. α-石墨炔经过优化后的晶格参数为6.965 Å,C-C键的键长分别为L1=L3=1.396 Å和L2=1.230 Å. 能带结构显示在Γ点出现明显的狄拉克锥,带隙为0 eV. 这些结果与前人的研究一致[20].
α-石墨炔有两种类型的C结构: sp杂化碳(C1)和sp2杂化碳(C2) (如图1所示). 为确定单个N原子掺杂最稳定的位置,我们计算了N原子替代C1和C2位置C原子的石墨炔体系,掺杂前后体系的形成能、键长、磁矩和电荷转移等在表1中给出. 结果表明,N原子掺杂之后,掺杂体系的结构出现较小的晶格畸变,不具有磁性. C1位置掺杂的形成能明显比C2位置的形成能小,N原子更易掺杂在C1位. 与原始结构相比,N原子掺杂在C1和C2位置处,L2和L3皆减小,C-N键长小于原始的C-C键长,说明掺杂之后最邻近的C原子会向杂质原子方向移动,原子间相互作用增强. N掺杂在C1位L1减小,键长变短,原子间相互作用增强;而N掺杂在C2位L1增加,键长变长,原子间相互作用减弱,C-C键更不稳定. 从成键的角度分析,N原子掺杂在C1位置结构更加稳定,这与形成能的结论一致. 因此,在后续的计算中,主要对N原子在C1位的掺杂体系进行了吸附的研究. Bader电荷分析结果表明,N掺杂之后,体系约有1.267 |e|电荷从α-石墨炔向N原子转移,N原子出现电荷积累.
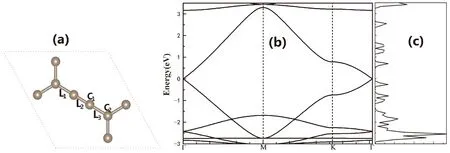
图1 α-石-墨炔的原胞(a)、能带结构(b)和态密度(c).Fig. 1 Unit cell (a), band structure (b) and density of states (c) of α-graphyne.
表1 N掺杂α-石墨炔体系的键长、形成能、磁矩和电荷转移
Table 1 The bond lengths, formation energies, magnetic moments and charge transfers in N-doped α-graphyne system

SystemsL1(Å)L2(Å)L3(Å)Efor(eV)M(μB)ΔQ(e)α-GY1.3961.2301.396—0—N-11.3881.1791.3692.51901.267N-21.4131.2201.3574.17801.272
3.2 H2O、H、O和OH与α-石墨炔的作用
在研究H2O、H、O和OH在α-石墨炔上的吸附特性时,我们考虑了多种结构来确定其稳定吸附位置. 对于本征α-石墨炔表面,吸附主要在C1,C2顶位,C1-C1,C1-C2,C2-C2等桥位以及形成环装结构的空位等位置(图1). OH和水分子中O原子存在孤对电子,更容易与表面成键,因此均采用O原子在下,H原子朝上的结构. N原子掺杂之后,主要考虑缺陷位置近邻的五个吸附位置进行顶位吸附研究(图2),同时选取连接这五个位置的四个桥位、以及中空位作为吸附初始位置.

图2 N原子掺杂单层α-石墨炔示意图,棕色和银色球分别代表C原子和N原子.Fig. 2 Schematic illustration of N-doped α-graphyne monolayer.Brown and silver balls represent C and N atoms, respectively.
计算结果表明,H2O、H、O和OH在纯净α-石墨炔上最稳定的吸附位置为C1顶位. H、O、OH和H2O吸附高度分别为1.534 Å、1.857 Å、2.031 Å和3.418 Å. H2O吸附高度较高,这个数值远远大于O原子和C原子的共价半径,表明H2O分子与表面键合作用较弱. 水分子的吸附能约为-0.100 eV,与范德瓦耳斯相互作用的形成能数量级相同,表明水分子在本征α-石墨炔表面吸附主要为范德瓦耳斯相互作用. H和OH吸附后体系出现磁性,磁矩分别为1.0 μB和0.836 μB,H原子吸附体系的磁矩主要由C原子的2p轨道和H原子的1s轨道贡献,为半金属性,OH吸附体系的磁矩主要由C原子和O原子的2p轨道以及H原子的1s轨道贡献,而O原子和H2O分子的吸附体系均无出现磁矩. 与H原子、OH和H2O分子相比,O原子的吸附能最低,说明α-石墨炔最容易吸附O原子. 吸附后,体系均出现电荷转移,与H原子、OH和H2O分子相比,O原子与表面间的电荷转移数目最多.
为进一步理解吸附物与石墨炔的作用机理,我们采用Bader电荷分析方法对体系的电荷转移进行分析[21],并计算了吸附体系的总态密度(TDOS),C、H、O原子和H2O分子的分波态密度(PDOS)(图3),H、O、OH和H2O分子吸附的单层α-石墨炔体系中的总磁矩如表2所示. 结果表明,H、O原子和OH吸附后在费米能级附近均出现杂质态,而H2O分子吸附后没有杂质态出现. H吸附后杂质态贡献主要来自H原子的1s轨道,O吸附后杂质态贡献主要来自O原子和C原子的2p轨道,OH吸附后杂质态贡献主要来自O原子的2p轨道和H原子的1s轨道. H原子吸附后,H作为电荷供体向α-石墨炔衬底提供了0.400 |e|,而O、OH和H2O吸附后,O、OH和H2O作为电荷受体,分别从α-石墨炔衬底获得0.783 |e|、0.367 |e|、0.025 |e|. 吸附的O原子作为受体得到更多的电荷.

图3 (a)、(b)、(c)、(d)分别为H、O、OH和H2O分子吸附在原始的α-石墨炔体系的电荷密度差的等值面图,(e)、(f)、(g)、(h)分别为H、O、OH和H2O分子吸附在原始的α-石墨炔体系的TDOS. 所有情况下的等值面值为0.002 eÅ-3(每个吸附分子提供顶视图和侧视图),电荷的积累和损耗分别用黄色和蓝色图表示.Fig. 3 The isosurface graphs of charge density difference of H, O, OH and H2O molecules adsorbed on the pristine α-grapheyne system (a, b, c, d), TDOSs of adsorbed on the pristine α-grapheyne system by H, O, OH and H2O molecules (e, f, g, h), respectively. In all cases, the isosurface value is 0.002 eÅ-3(top and side view are provided for each adsorption molecule). Charge accumulation and depletion are represented in yellow and blue plots, respectively.
3.3 N掺杂对α-石墨炔上H2O、H、O和OH电子结构的影响
为了分析N原子对H、O、OH和H2O分子吸附α-石墨炔电子结构的影响,我们进一步研究了N掺杂后吸附体系电子性质,计算结果如表2所示. N掺杂后,H、O、OH和H2O吸附高度分别为0.003 Å、0.394 Å、1.842 Å和3.002 Å. 与没有掺杂体系相比,H和O的吸附高度明显减小,OH的吸附高度略有增加,而H2O吸附高度增加明显,表明N掺减弱了H2O分子的吸附. N掺杂后,O原子吸附体系出现磁性,磁矩为0.429 μB.
我们对N掺杂后吸附结构电荷转移进行了分析,并计算了吸附体系的总态密度(TDOS),以及C、H、O原子和H2O分子的分波态密度(PDOS)如图4所示. 在H、O、OH和H2O分子吸附的N掺杂α-石墨炔体系中,计算得到的总磁矩与表2基本一致. 结果表明,在N掺杂后的体系上吸附,H原子、OH和H2O分子吸附后没有杂质态出现,而在O原子吸附后仍出现杂质态,O吸附后杂质态贡献主要来自C原子、N原子和O原子的2p轨道. 根据bader电荷分析,H、O原子和OH吸附后,H、O、OH作为电荷受体,分别从N掺杂的α-石墨炔衬底获得0.026 |e|、0.921 |e|、0.386 |e|,而H2O分子吸附后几乎没有电荷转移. 我们的电荷分析表明,吸附的O原子作为受体发生了明显的电荷转移. 如上所述,在N原子掺杂后,O原子更易吸附在衬底表面,H、O原子和OH吸附在纯净的和N原子掺杂的α-石墨炔衬底表面磁性的变化,可以用来判断α-石墨炔中是否有杂质存在.
表2 H、O、OH和H2O分子吸附α-石墨炔体系优化后的键长L1、L2、L3(Å)、吸附高度h(Å)、吸附能Eads(eV)、磁矩M(μB)和电荷转移ΔQ(|e|).
Table 2 The optimized bond lengthsL1,L2,L3(Å), adsorption heightsh(Å), adsorption energiesEads(eV), magnetic momentsM(μB) and charge transfers ΔQ(|e|) for the adsorptions of H, O, OH and H2O molecules on α-graphyne .
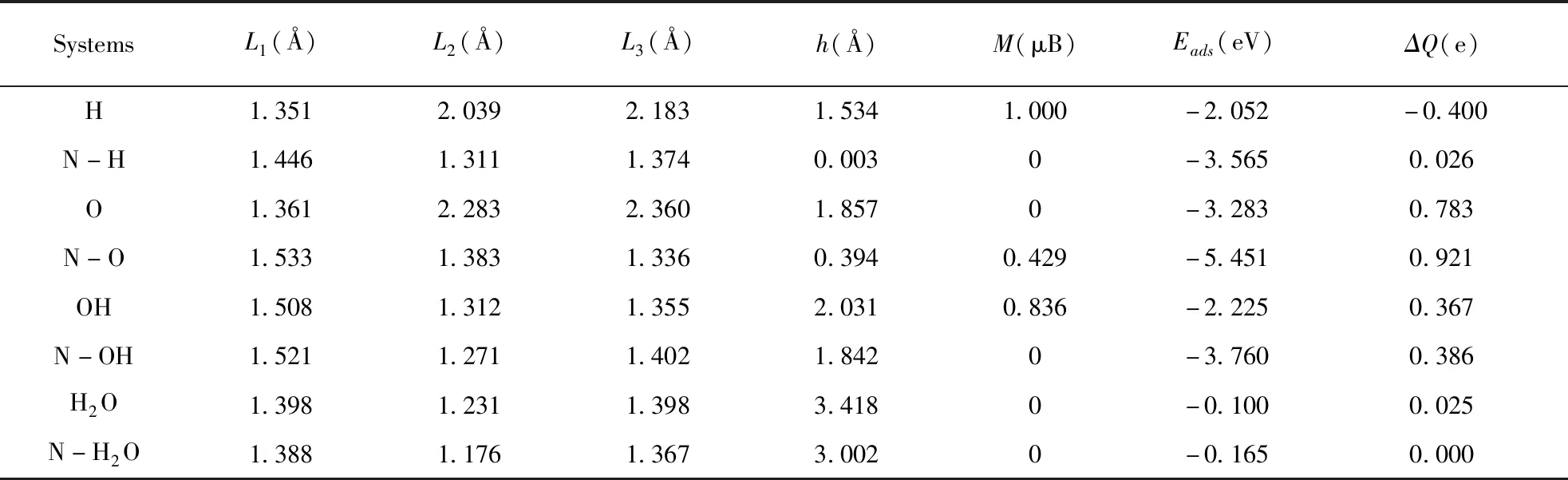
SystemsL1(Å)L2(Å)L3(Å)h(Å)M(μB)Eads(eV)ΔQ(e)H1.3512.0392.1831.5341.000-2.052-0.400N-H1.4461.3111.3740.0030-3.5650.026O1.3612.2832.3601.8570-3.2830.783N-O1.5331.3831.3360.3940.429-5.4510.921OH1.5081.3121.3552.0310.836-2.2250.367N-OH1.5211.2711.4021.8420-3.7600.386H2O1.3981.2311.3983.4180-0.1000.025N-H2O1.3881.1761.3673.0020-0.1650.000
4 结 论
综上所述,本文通过第一性原理计算方法,系统地研究了N掺杂对H2O、H、O和OH在单层α-石墨炔体系表面吸附电子性质的影响. 数据结果分析表明,N原子替代掺杂在α-石墨炔sp杂化碳原子位置结构最稳定. 在纯净的α-石墨炔表面吸附,O原子的吸附性能比H原子、OH和H2O分子的吸附性能好,并且,N原子掺杂能够增强O原子的吸附性能. 同时,根据吸附前后电子结构的变化,H、O原子和OH吸附可以用来判断α-石墨炔是否引入N原子杂质. 并且,在水分子浓度较高的环境下,有利于做H、O、OH吸附传感器的研究. 我们的研究结果为气体传感器的研究提供新的视角,并为基于α-石墨炔结构吸附和掺杂的研究提供有益的参考.

图4 (a)、(b)、(c)、(d)分别为H、O、OH和H2O分子吸附在N掺杂的α-石墨炔体系的电荷密度差的等值面图,(e)、(f)、(g)、(h)分别为H、O、OH和H2O分子吸附在N掺杂的α-石墨炔体系的TDOS. 所有情况下的等值面值为0.002 eÅ-3(每个吸附分子提供顶视图和侧视图),电荷的积累和损耗分别用黄色和蓝色图表示.Fig. 4 The isosurface graphs of charge density difference of H, O, OH and H2O molecules adsorbed on N-doped α-grapheyne system (a, b, c, d), TDOSs of adsorbed on N-doped α-grapheyne system by H, O, OH and H2O molecules (e, f, g, h), respectively. In all cases, the isosurface value is 0.002 eÅ-3 (top and side view are provided for each adsorption molecule). Charge accumulation and depletion are represented in yellow and blue plots, respectively.

