芪蛭胶囊对缺血性中风大鼠豆蔻酰化蛋白激酶C表达的影响
张婷婷 滕尧 陆雪健 王东岩 蒋希成

摘要:目的 觀察芪蛭胶囊对缺血性中风大鼠PKC-MARCKS信号通路豆蔻酰化蛋白激酶C(MARCKS)表达的影响,探讨其相关作用机制。方法 采用线栓法制作SD大鼠大脑中动脉闭塞脑缺血再灌注模型,缺血2 h后行再灌注。实验大鼠随机分为假手术组、模型组、中药组和阳性药组,各给药组给予相应药物干预,连续8 d,第8日给药1 h后造模,除假手术组外,其余3组分为4个亚组,即再灌注后6、24、72 h和7 d组。应用Zea Longa 5分制评分标准对大鼠进行神经功能缺损评分,之后取大鼠脑组织缺血部分,HE染色观察细胞形态,Western blot检测MARCKS及p-MARCKS蛋白的表达,RT-PCR检测MARCKS mRNA的表达。结果 模型组大鼠神经功能较假手术组损伤明显(P<0.05),中药组和阳性药组大鼠脑组织再灌注后72 h神经功能评分较模型组明显降低(P<0.05);HE染色结果显示,假手术组大鼠脑组织神经细胞无明显变化,模型组大鼠脑组织神经细胞受损严重,中药组和阳性药组大鼠脑组织神经细胞损伤程度较模型组轻;Western blot和RT-PCR检测结果显示,模型组较假手术组大鼠脑组织MARCKS蛋白和mRNA及p-MARCKS蛋白均呈高表达(P<0.05),阳性药组和中药组大鼠脑组织MARCKS蛋白、mRNA及p-MARCKS蛋白表达明显下调(P<0.05)。结论 芪蛭胶囊可下调模型大鼠脑组织MARCKS蛋白及mRNA的高表达,进而缓解脑缺血再灌注损伤。
关键词:缺血性中风;脑缺血再灌注;芪蛭胶囊;豆蔻酰化蛋白激酶C;大鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)11-0040-06
Abstract: Objective To observe the effects of Qizhi Capsules on the expression of MARCKS PKC-MARCKS signaling pathway in ischemic stroke rats. Methods The cerebral ischemia-reperfusion model of middle cerebral artery occlusion in SD rats was made by suture method. Reperfusion was performed 2 hours after ischemia. SD rats were randomly divided into four groups: sham-operation group, model group, TCM group and positive medicine group, and each medication group was administered continuously for 8 days. The model was made 1h after administration on the 8th day, the other three groups except for the sham-operation group were divided into 4 subgroups, namely reperfusion 6 h, 24 h, 72 h, and 7 d groups. Neurological deficit scores in rats were evaluated using Zea Longa 5-point scale. The ischemic part of rat brain was taken out. The morphology of the cells was observed by HE staining. The expression of MARCKS and p-MARCKS protein was detected by Western blot. The expression of MARCKS mRNA was detected by RT-PCR. Results The nerve function damage in model group was more serious than that in sham-operation group (P<0.05). The nerve function score in positive medicine group and TCM group at reperfusion 72 h was significantly lower than that in model group (P<0.05). The results of HE staining showed thatthe nerve cells in the sham-operation group had no obvious changes, and the nerve cells in the model group were seriously damaged. The damage degree of TCM group and positive medicine group was lighter than that of the model group; Western blot and RT-PCR showed that the MARCKS protein and mRNA and p-MARCKS protein in the model group were over-expressed (P<0.05). Both the positive medicine group and TCM group could down-regulate the expressions of MARCKS protein and mRNA and p-MARCKS protein (P<0.05). Conclusion Qizhi Capsules can down-regulate ischemic stroke rats the overexpression of MARCKS protein and mRNA, and then alleviate the cerebral ischemia-reperfusion injury.
Keywords: ischemic stroke; cerebral ischemia-reperfusion; Qizhi Capsules; MARCKS; rats
缺血性中风是常见的危害人类神经系统的疾病,占脑中风比例较大。PKC-MARCKS信号转导系统脑缺血后被激活,豆蔻酰化蛋白激酶C(MARCKS)在神经功能和神经疾病中扮演重要的角色[1],其为蛋白激酶C(protein kinase C,PKC)的特异性底物蛋白[2]。MARCKS能调节大脑神经元轴突生长、内吞和胞吐及突触可塑性等基本过程,揭示MARCKS蛋白在一系列生理过程是一个不可或缺的参与者,参与了大脑皮层的发育与衰老相关的认知能力下降等过程。目前,已知的关于MARCKS的调节机制均与PKC磷酸化有关。本课题组前期研究发现,芪蛭胶囊对大鼠局灶性脑缺血具有保护作用[3],但其具体分子机制尚不明确。本实验制作大鼠大脑中动脉闭塞脑缺血再灌注模型,观察芪蛭胶囊对模型大鼠缺血区脑组织形态及MARCKS、p-MARCKS表达的影响,探讨芪蛭胶囊对缺血性中风模型大鼠的作用机制。
1 材料和方法
1.1 動物
健康雄性SD大鼠80只,SPF级,体质量250~300 g,黑龙江中医药大学药物安全性评价中心提供,动物许可证号SYSK(黑)2013-012。饲养于温度(20±2)℃、相对湿度40%~42%环境,12 h光照,自由摄食饮水。
1.2 药物
芪蛭胶囊(黄芪30 g、丹参20 g、水蛭15 g、地龙15 g等),黑龙江中医药大学附属第一医院中药房提供,批号170301;尼莫地平片,哈药集团三精明水药业有限公司,批号20180524。
1.3 主要试剂与仪器
兔抗MARCKS(20661-1-Ap,Proteintech),兔抗p-MARCKS(11992,CST),山羊抗兔IgG(H+L)HRP(天德悦S004),山羊抗小鼠IgG(H+L)HRP(天德悦S001),GAPDH鼠单抗(天德悦TDY042),超纯RNA提取试剂盒(CWbio.Co.Ltd,Cat#CW0581),HiFi-MMLV cDNA第一链合成试剂盒(CWbio.Co. Ltd,Cat#CW0744)。涡旋振荡仪(其林贝尔QL-902),离心机(Eppendorf Centrifuge 5415D),分光光度计(Therno Scientific,NANODROP 2000),荧光定量PCR仪(Applied Biosystems,ABI7500),Fresco低温冷冻离心机(Thermo),MultiSkan3酶标仪(Thermo),Mini P-4电泳槽(Cavoy)。
1.4 分组及给药
实验大鼠按随机数字表法分为假手术组、模型组、阳性药组和中药组,其中假手术组6只,其余3组各24只。根据人与动物给药剂量比例换算,大鼠用药剂量=人用药剂量×0.018÷200 g。中药组给予芪蛭胶囊(2.6 mg/mL)药液灌胃,阳性药组给予尼莫地平(3 mg/mL)药液灌胃,假手术组和模型组给予等体积生理盐水灌胃。给药体积10 mL/kg,每日1次,连续8 d。模型组、中药组和阳性药组根据缺血2 h再灌注后时间不同随机分为再灌注后6、24、72 h和7 d共4个亚组。
1.5 造模
第8日给药1 h后开始造模。采用Zea Longa线栓法[4]制作大鼠脑缺血损伤动物模型,即大脑中动脉阻塞模型。大鼠腹腔注射10%水合氯醛(35 mg/kg)麻醉,仰卧位固定,于颈部正中线处做一纵切口,分离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。然后在近心端结扎CCA、ECA,用小动脉夹暂时夹闭CCA远心端近分叉部,然后在CCA近心端距分叉部4 mm剪一小口,将栓线插入到CCA,轻推栓线达分叉处,松开小动脉夹,从血管分叉处进入ICA,从分叉处插入深度约18 mm,于CCA远心端用细线结扎,消毒后缝合伤口。术后2 h将栓线拔出约1 cm,行再灌注。假手术组大鼠不插入栓线,其余步骤同其他组。
1.6 神经功能缺损评分
参照Zea Longa 5分制评分标准[4]对成模大鼠进行初选:无神经缺损症状,0分;不能充分伸展左侧前肢,1分;行走时身体向左侧转圈,2分;行走时身体向左侧倾倒,3分;不能自发行走,意识水平丧失,4分。选取1~3分者,将不合格大鼠剔除,通过随机抽样原则补齐动物数并重新造模。
1.7 标本处理
所有实验组各取2只大鼠行脑组织HE染色,脑组织标本制作经心脏灌流。大鼠腹腔注射10%水合氯醛(35 mg/kg)麻醉,先灌注生理盐水约100 mL,再灌注4%多聚甲醛缓冲液。灌注固定完成后,迅速剪取大鼠头部,用弯钳小心将缺脑组织剥离,切取2 mm2缺血区脑组织,4%多聚甲醛缓冲液4 ℃固定24 h,组织脱水、透明及浸蜡,常规脱水、石蜡包埋、切片,HE染色。各组余下4只大鼠,其中2只用于大鼠脑组织Western blot检测,另外2只用于大鼠脑组织RT-PCR检测。模型大鼠麻醉后冰上断头取脑组织,剥离脑组织至冰上,刀片切取缺血区脑组织,置于冻存管中液氮保存,提取总蛋白及总RNA备用。
1.8 Western blot检测豆蔻酰化蛋白激酶C及其磷酸化蛋白表达
将缺血区脑组织剪碎,提取总蛋白。加裂解液,脑组织15 000 r/min匀浆10 s,冰上孵育20 min,4 ℃、13 000 r/min离心20 min,取上清液,应用BCA法蛋白定量,酶标仪读取OD值,分装后置于-80 ℃冰箱保存。以RIPA调整蛋白浓度,根据目的蛋白分子量,配制12%分离胶,浓缩胶浓度为5%,20 μg/孔上样,通过预染蛋白Marker确定电泳停止时间,然后进行转模和染色,观察转膜效果。用3%BSA-TBST稀释MARCKS、p-MARCKS蛋白,浓度分别为1∶4000和1∶500,室温孵育10 min,4 ℃过夜。第2日膜处理后曝光,显影2 min,定影。拍照保存图像,分析软件测定条带光密度值,以光密度值代表蛋白的相对表达量。
1.9 RT-PCR检测豆蔻酰化蛋白激酶C mRNA表达
用超纯RNA提取试剂盒提取组织样本中总RNA,实验操作按试剂盒说明书进行。取5 μL RNA,1%琼脂糖凝胶进行电泳,检测RNA的完整性。设计引物MARCKS mRNA,用GAPDH作内参。引物设计见表1。用UltraSYBR Mixture(With ROX)进行扩增,实验操作严格按产品说明书进行。扩增步骤:95 ℃、10 min,95 ℃、15 s,60 ℃、60 s,共45个循环。取5 μL RNA,1%琼脂糖凝胶进行电泳。选取样本cDNA进行5倍梯度稀释,稀释后样品各取2 μL作为模板,分别用目的基因引物和内参基因引物进行扩增,同时60~95 ℃进行融解曲线分析,仪器自动绘制出对应的内参基因和目的基因的标准曲线。根据RT-PCR原始检测结果,用2-ΔΔCt法分析基因的相对表达量。
1.10 统计学方法
采用SPSS23.0统计软件进行分析。实验数据以 ±s表示,多组间比较用方差分析,组间两两比较用LSD法。P<0.05表示差异有统计学意义。
2 结果
2.1 芪蛭胶囊对模型大鼠脑组织神经功能评分的影响
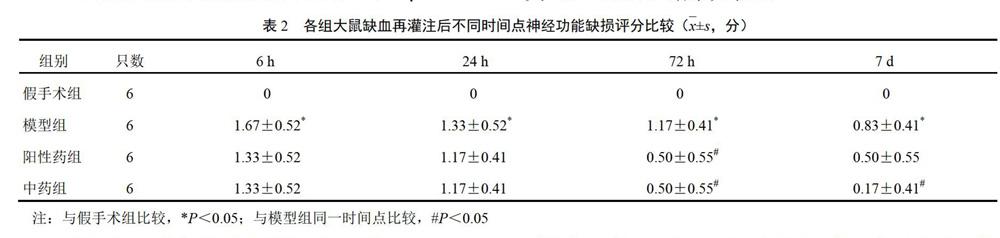
除假手术组外,其余大鼠自缺血再灌注后6 h起即有明显的神经功能缺损表现,多数大鼠出现患侧肢体屈曲内收、双侧伸出不对称的症状,缺损症状明显者多出现行走时向患侧转圈,症状越重则旋转直径越小,可出现行走时追尾。模型组大鼠神经功能评分缺血再灌注后各时间点整体水平呈下降趋势,中药组、阳性药组较模型组整体评分降低,再灌注后72 h中药组和阳性药组较模型组差异有统计学意义(P<0.05),再灌注后7 d中药组较模型组差异有统计学意义(P<0.05)。结果见表2。
2.2 芪蛭胶囊对模型大鼠脑组织形态的影响
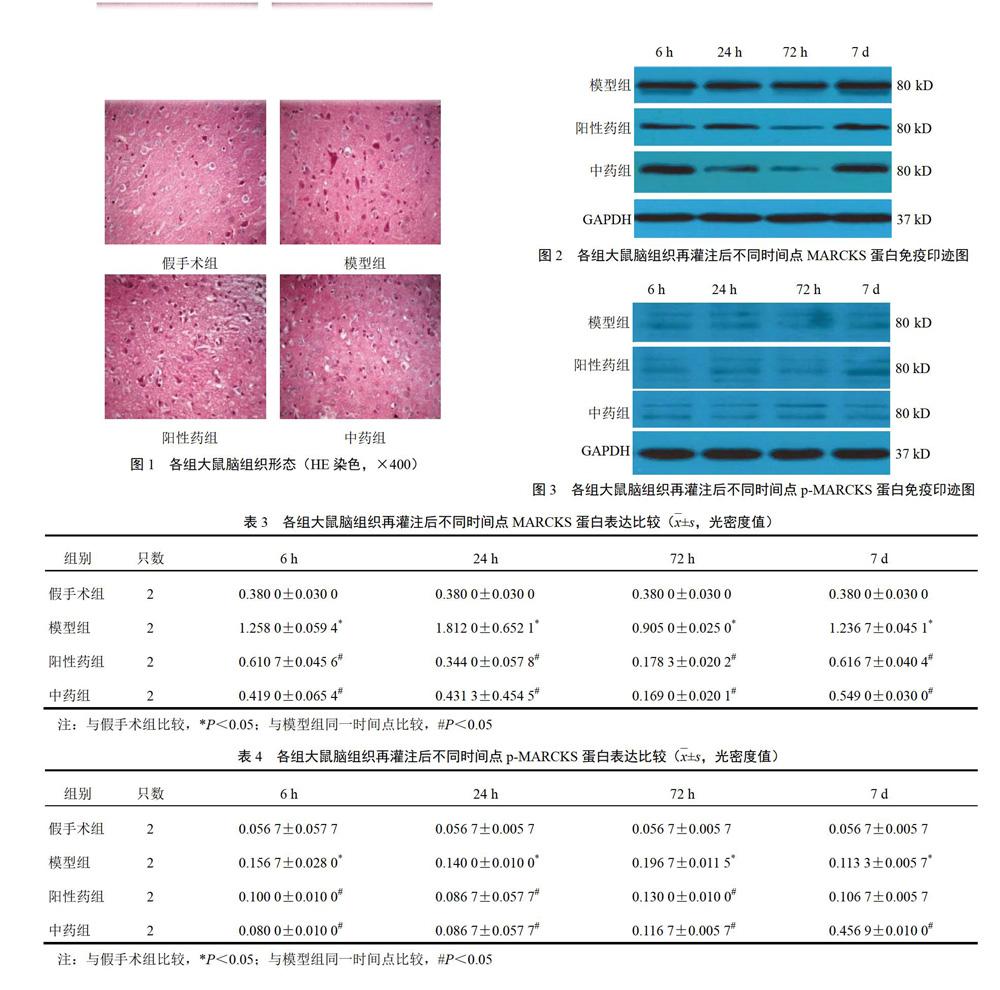
假手术组大鼠缺血区神经细胞密集,排列整齐,神经细胞形态完整,胞核呈蓝色,胞质呈粉红色,胞核居中,核仁清晰,周围间隙无水肿;模型组再灌注后72 h大鼠缺血区可见神经元细胞核染色加深,神经元胞浆肿胀甚至破裂,细胞周围出现间隙,小胶质细胞开始出现,毛细血管充血扩张,血管周围间隙扩大,可见大量紫色深染的凋亡小体,炎性细胞及胶质浸润,增生明显;阳性药组大鼠较模型组神经元水肿有所减轻,细胞周围间隙有所减轻,网格排列情况较轻,可见少量紫色深染的凋亡小体;中药组大鼠较模型组神经元水肿减轻,细胞周围间隙减小,未见网格排列情况,未发现大空泡;中药组和阳性药组大鼠再灌注后72 h较模型组形态差异最明显,神经元损伤减少,神经元数量增加,神经元肿胀明显减轻,可见少量紫色深染的凋亡小体。见图1。
2.3 芪蛭胶囊对模型大鼠脑组织豆蔻酰化蛋白激酶C及其磷酸化蛋白表达的影响
模型组大鼠脑组织MARCKS、p-MARCKS蛋白呈高表达,假手术组呈低表达,中药组和阳性药组大鼠表达量低于模型组。再灌注后各时间点各亚组显示,与模型组比较,中药组和阳性药组大鼠脑组织蛋白表达明显降低,差异有统计学意义(P<0.05)。结果见图2、图3、表3和表4。
2.4 芪蛭胶囊对模型大鼠脑组织MARCKS mRNA表达的影响
目标基因与GADPH比值顯示,模型组大鼠脑组织MARCKS mRNA呈高表达,假手术组大鼠脑组织呈低表达,与模型组比较差异有统计学意义(P<0.05)。再灌注后各时间点各亚组显示,与模型组比较,中药组和阳性药组大鼠脑组织基因表达明显下调,差异有统计学意义(P<0.05),2组间比较差异无统计学意义(P>0.05)。结果见表5。
3 讨论
气虚血瘀夹痰是缺血性中风主要病因病机。气虚为本,血瘀为标,瘀血既成,影响气生血及行血,又使脑络瘀阻加重。血瘀是缺血性中风的病理核心,气虚是本病的根源;痰是脏腑功能失调的一种病理产物,亦是导致缺血性中风的基本病理因素之一。故缺血性中风治以益气活血、祛痰通络,则血行气旺,血足气畅,络通风消,诸症痊愈。芪蛭胶囊具有益气活血、化瘀祛痰、通经活络功效。方中黄芪为君药,性甘温,大补元气,气足则血生,气旺促血行;辅以水蛭、地龙破血逐瘀、通经活络;丹参补血、活血化瘀;水蛭、地龙与丹参等同用,旨在祛瘀通络、活血化瘀而不伤正。诸药合用,共奏益气活血、祛瘀化痰、通经活络功效。现代药理研究表明,黄芪具有清除自由基、抗脂质过氧化、拮抗内皮素的释放及兴奋性氨基酸的毒性作用;并能降低血管通透性,改善缺血后血液流变性[5]205;水蛭肽具有抗脑缺血、保护神经元、减轻细胞损伤的作用[5]221;丹参素具有抗缺血缺氧、抗自由基、抑制细胞内钙离子升高等作用,对神经细胞具有保护作用[5]266;地龙活性提取物具有减少或修复因脑缺血引起的组织损伤和增加脑血流量、减少脑血管阻力、降低血小板黏附和抑制动物体内血栓形成等作用[5]281。
MARCKS控制大脑中各种细胞类型的蛋白质相互作用。MARCKS能通过PKC将细胞内或细胞外信号传导到肌动蛋白细胞骨架。在大脑中,MARCKS富含在轴突末端和树突棘,在突触前末梢中,MARCKS与突触蛋白Ⅰ相互作用,与突触小泡共存,并被PKC磷酸化[1]。MARCKS作为PKC的特异性底物蛋白,是大脑中表达丰富的联系神经元表面信号与树突棘可塑性的重要膜蛋白[6]。PKC在脑缺血再灌注损伤中起关键性作用,再灌注早期内源性δPKC活化介导的一系列伤害性级联反应诱发的氧化应激、凋亡、炎症反应与再灌注损伤密切相关。脑损伤时,MARCKS大量表达,并且MARCKS在PKC的作用下,发生磷酸化反应生成p-MARCKS,可参与跨膜信息传递与脑组织的发育[7],参与细胞的转移、黏附、分泌及细胞的内摄、外放和吞噬作用[7-8]。缺血性中风发作时,MARCKS蛋白上调,通过PKC的磷酸化反应生成大量的p-MARCKS蛋白,参与细胞的跨膜传递并调节细胞机能。另外,有研究表明,小胶质细胞中MARCKS升高对海马的可塑性和功能有害[9],凯尼克酸诱导癫痫发作导致小胶质细胞活化,其机制是上调MARCKS的mRNA和蛋白表达[10]。
脑缺血中风梗死病灶由中心坏死区及其周围的缺血区半暗带组成。中心坏死区由于严重的完全性缺血致脑细胞死亡;而缺血半暗带因仍有侧支循环存在,可获得部分血液供给,尚有大量存活的神经元,理论上认为如果血流迅速恢复,损伤仍为可逆性,据此提出超早期治疗,采取脑保护措施减轻再灌注损伤。实验结果表明,芪蛭胶囊组能改善缺血区脑组织细胞形态,降低神经功能缺损,对大鼠局灶性脑缺血具有明显的保护作用。本实验中模型组大鼠脑组织小胶质细胞出现,MARCKS蛋白及基因表达均高于假手术组和给药组,因缺血缺氧导致神经元损伤,而小胶质细胞大量存活,激活了与保护/损伤相关的PKC-MARCKS信号通路,神经细胞发生凋亡、坏死。芪蛭胶囊能下调缺血性中风大鼠脑组织MARCKS蛋白及其磷酸化蛋白和mRNA的表达,抑制小胶质细胞的产生。有研究表明,脑缺血状态下大鼠缺血区脑组织MARCKS和p-MARCKS表达与脑缺血神经元损伤关系密切[11],芪蛭胶囊治疗缺血性中风的机制可能是通过下调缺血区大鼠脑组织MARCKS蛋白的表达,抑制PKC-MARCKS信号通路的激活及小胶质细胞的生成,进而减轻脑缺血对模型大鼠的损伤。
参考文献:
[1] BRUDVIG J J, WEIMER J M. X MARCKS the spot:myristoylated alanine-rich C kinase substrate in neuronal function and disease[J]. Frontiers in Cellular Neuroscience,2015,9(10):407.
[2] STUM P O, BOCK C B, TUTTLE J S, et al. MARCKS deficiency in mice leads to abnomalbrain development and perinatal death[J]. Proc NatlA and SciUSA,1995,92(4):944-948.
[3] 蒋希成,王志国,赵玉萍,等.芪蛭胶囊对大鼠局灶性脑缺血的保护作用[J].上海中医药杂志,2006,40(11):55-56.
[4] ZEA-LONGA E L, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[5] 雷载权.中药学[M].上海:上海科学技术出版社,1995.
[6] 苏芮.Aβ致痴呆老龄大鼠模型海馬MARCKS表达变化机制及中药调节作用研究[D].北京:北京中医药大学,2010.
[7] ADEREM A. The MARCKS brothers:a family of protein kinase C substrates[J]. Cell,1992,71(5):713-716.
[8] BLACKSHEAR P J. The MARCKS family of cellular protein kinase C substrates[J]. J Biol Chem,1993,268(3):1501-1504.
[9] MCNAMARA R K, HUSSAIN R J, SIMON E J, et al. Effect of myristoylated alanine-rich C kinase substrate (MARCKS) overexpression on hippocampus-dependent learning and hippocampal synaptic plasticity in MARCKS transgenic mice[J]. Hippocampus, 2005,15(5):675-683.
[10] EUN S Y, KIM E H, KANG K S, et al. Cell type-specific upregulation of myristoylated alanine-rich C kinase substrate and protein kinase C-α, -β Ⅰ, -βⅡ, and -δ in microglia following kainic acid-induced seizures[J]. Experimental & Molecular Medicine,2006,38(3):310-319.
[11] 张綦慧,张允岭,娄金丽,等.急性多发脑梗死大鼠海马MARCK SmRNA表达的动态变化[J].中国病理生理杂志,2006,22(5):964-967.
(收稿日期:2019-06-01)
(修回日期:2019-07-01;编辑:华强)

