补脑软胶囊对阿尔茨海默病大鼠学习记忆能力及海马区神经细胞损伤的影响
李喜香 豆金彦 潘从泽 陈二林

摘要:目的 觀察补脑软胶囊对β-淀粉样蛋白1-42(Aβ1-42)所致阿尔茨海默病(AD)大鼠学习记忆能力和海马神经细胞损伤的影响,探讨其治疗AD的可能机制。方法 将90只Wistar雄性大鼠随机分为假手术组、模型组、阳性对照组和补脑软胶囊高、中、低剂量组,各给药组给予相应药物灌胃。除假手术组注射生理盐水外,其余各组大鼠均在左侧脑室海马区注射聚集态Aβ1-42制作AD大鼠模型。灌胃给药14 d后,采用Morris水迷宫实验评价大鼠学习记忆能力;取大鼠海马组织,HE染色,镜下观察神经细胞损伤修复情况;大鼠脑组织制备匀浆,测定过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量;免疫组化检测大鼠海马组织β-分泌酶活性。结果 与假手术组比较,模型组大鼠逃避潜伏期明显延长,平台象限穿越次数明显减少(P<0.01);脑组织CAT、GSH-Px、SOD活性明显降低,MDA含量明显升高(P<0.05,P<0.01),海马β-分泌酶活性明显升高(P<0.05);与模型组比较,补脑软胶囊高剂量组大鼠逃避潜伏期明显缩短,平台象限穿越次数明显增加(P<0.05);补脑软胶囊高、中剂量组大鼠脑组织CAT、GSH-Px、SOD活性明显升高,MDA含量明显降低(P<0.01);补脑软胶囊各剂量组大鼠神经细胞损伤明显修复,其中高、中剂量组海马组织β-分泌酶活性明显降低(P<0.01)。结论 补脑软胶囊可明显改善AD大鼠学习记忆能力,其机制可能是通过抗自由基损伤及降低海马组织β-分泌酶活性来发挥抗神经细胞损伤作用。
关键词:补脑软胶囊;阿尔茨海默病;β-淀粉样蛋白1-42;海马神经细胞;β-分泌酶;大鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)11-0057-05
Abstract: Objective To investigate the effects of Bunao Soft Capsules on learning and memory ability and hippocampal nerve cell injury of Alzheimer disease (AD) rats induced by intracerebroventricular injection of Aβ1-42; To discuss its possible mechanism for treatment of AD. Methods Totally 90 male Wistar rats were randomly divided into sham-operation group, model group, positive control group, and Bunao Soft Capsules high-, medium-, and low-dosage groups. Each administration was given relevant medicine for gavage. Except for sham-operation group, all the other rats were injected with aggregated Aβ1-42 into the left hippocampus to make AD rat models. After 14 days of gavage administration, the learning and memory ability of rats was evaluated by Morris water maze test; Rat hippocampus tissue was taken and stained with HE, and the repair of nerve cell injury was observed under microscope; Preparation of homogenate in rat brain tissue was used to determine the activity of CAT, GSH-Px, SOD and MDA content; Immunohistochemistry was used to detect β-secretase activity in rat hippocampus. Results Compared with the sham-operation group, the escape latent period of model group was significantly prolonged (P<0.01); the times of crossing target quadrant significantly decreased (P<0.01); the activity of CAT, GSH-Px and SOD in brain tissue decreased; the level of MDA increased significantly (P<0.05, P<0.01); the activity of β-secretion in the hippocampus increased significantly (P<0.05). Compared with the model group, the escape latency period of BunaoSoft Capsules high-dosage group was significantly shortened and the times of crossing target quadrant significantly increased (P<0.05). The activity of CAT, GSH-Px and SOD in Bunao Soft Capsules high- and medium-dosage groups significantly increase (P<0.01), and the level of MDA significantly decreased. Rat nerve cell injury repair effect was obvious, and hippocampal tissue β-secretase activity was significantly reduced in Bunao Soft Capsules groups (P<0.01). Conclusion Bunao Soft Capsules can improve learning and memory ability of AD rats and its mechanism may be to exert anti-neuronal damage by anti-free radical damage and reduce β-secretase activity.
Keywords: Bunao Soft Capsules; Alzheimer disease; β-amyloid; hippocampal nerve cell; β-secretase; rats
阿尔茨海默病(Alzheimer disease,AD)是一种常见的中枢神经系统退行性疾病,主要以进行性记忆功能障碍、认知障碍、行为异常、社交障碍等为特征,然而迄今其病因尚不明确。其中,β淀粉样蛋白(β-amyloid protein,Aβ)在大脑皮层及海马区聚集并形成老年斑是该病的一大特征[1-2]。补脑软胶囊前身补脑膏是我院夏永潮主任医师创建的“中医佛手治疗体系”中的方剂之一,在甘肃省中医院脑病科近30年的临床应用及动物实验中表明,其对治疗脑外伤性神经损伤及后遗症,脑炎、脑膜炎后遗症,脑、脊髓变性等脑部疾病疗效确切[3-4]。在长期临床应用中,补脑膏在剂型方面不能完全满足临床用药的需求。本实验采用新设备结合新辅料和新工艺,将传统煎膏剂制成补脑软胶囊[5-6],通过大鼠颅内注射Aβ1-42建立老年斑块化AD模型,观察补脑软胶囊对AD大鼠海马组织神经细胞的影响,探讨其治疗AD的可能机制,为补脑软胶囊在治疗AD方面的临床应用提供依据。
1 实验材料
1.1 药物
补脑软胶囊(当归、川芎、黄芪、赤芍等,1 g相当于原药材23.6 g),甘肃省中医院科研制剂中心配制,批号20180601;盐酸多奈哌齐片,5 mg/片,卫材(中国)药业有限公司,批号1702012。
1.2 动物
SPF级雄性Wistar大鼠90只,体质量(260±20)g,中国人民解放军联勤保障部队第九四零医院动物实验中心提供,动物许可证号SYXK(甘)2012-0029。饲养于温度18~22 ℃、相对湿度40%~60%环境,正常光照,自由摄食饮水。
1.3 主要试剂与仪器
Aβ1-42 淀粉样蛋白,美国Anaspec公司,批号1855817;过氧化氢酶(CAT)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒,南京建成生物工程研究所,批号分别为20181101、20180912、20181012、20181201;4%多聚甲醛组织固定液,武汉博士德生物工程有限公司,批号1901022;免疫组化试剂盒DAB显色剂,DAKO公司,批号K5007;水合氯醛,阿拉丁试剂(上海)有限公司,批号B1826028;二甲苯,国药集团化学试剂有限公司,批号10023418;无水乙醇,国药集团化学试剂有限公司,批号100092683;苏木素染液套装,武汉谷歌生物科技有限公司,批号G1005;灭菌注射用水,四川科伦药业股份有限公司,批号M17010224。PUMP 11 ELITE Nanomite脑立体定位仪专用注射泵,美国Harvard Apparatus公司;51500D大小鼠腦立体定位仪,美国哈佛仪器公司;JJ-12J脱水机,武汉俊杰电子有限公司;JB-P5包埋机,武汉俊杰电子有限公司;JB-L5冻台,武汉俊杰电子有限公司;KD-P组织摊片机,浙江省金华市科迪仪器设备有限公司。
2 实验方法
2.1 造模
参照文献[7-10]方法制作AD模型。将0.5 mg Aβ1-42冷冻干粉溶于40 μL 1%NH4OH溶液中,加入460 μL PBS,制得浓度为1 μL/μg贮备液,37 ℃恒温培养箱孵育1周,成为聚集态,置于4 ℃冰箱保存备用。大鼠术前12 h禁食不禁水,腹腔注射10%水合氯醛(3.5 mL/kg)麻醉,用脑立体定位仪平颅固定,切开,暴露颅囱,取前囱后3.5 mm,中缝左侧旁开2.0 mm,用牙科钻手动钻开颅骨,暴露硬脑膜,微量进样器自脑表面垂直进入2.8 mm,5 min内将Aβ1-42肽段10 μL(10 μg)缓慢注入,留针5 min保证溶液充分弥散。另15只假手术组大鼠海马区注射生理盐水,然后3 min内缓慢撤针,缝合切口,常规饲养,术后每只大鼠腹腔注射青霉素钠(20 U/d),连续3 d。
2.2 分组
90只Wistar雄性大鼠随机分为假手术组、模型组、阳性对照组和补脑软胶囊高、中、低剂量组,每组15只。
2.3 给药
各组实验大鼠均于术后第1日开始给药,实验药物用灭菌注射用水配制为混悬液。阳性对照组给予盐酸多奈哌齐(3 mg/kg)药液灌胃,补脑软胶囊高、中、低剂量组分别给予800、400、200 mg/kg药液灌胃,假手术组和模型组给予等体积生理盐水灌胃。给药体积均为10 mL/kg,每日1次,连续14 d。
2.4 指标测定
2.4.1 Morris水迷宫实验
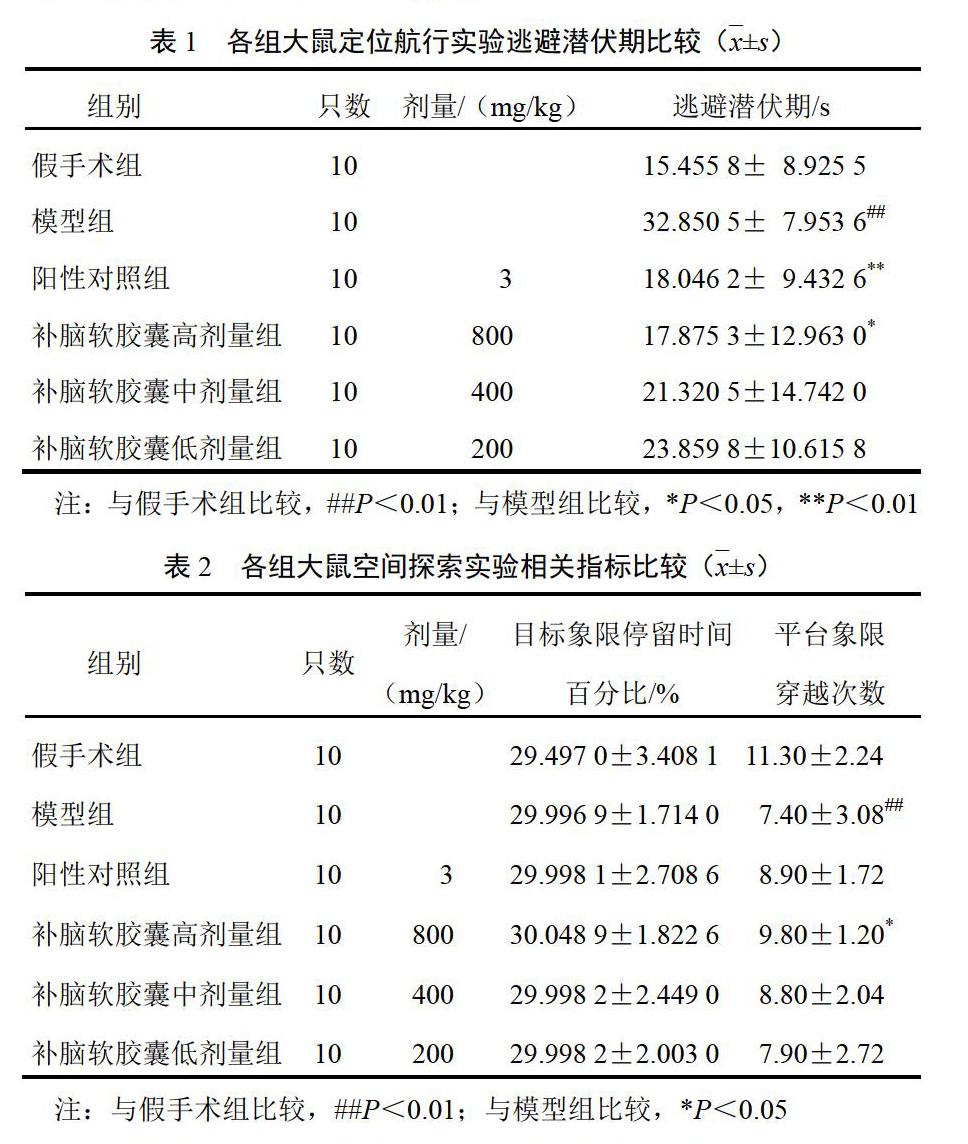
实验大鼠给药14 d后进行Morris水迷宫实验评价大鼠空间学习和记忆能力。水迷宫装置由圆形水池、可移动平台和自动录像分析系统组成。水池直径100 cm,水深25 cm,水温控制在22~25 ℃。定位航行实验:将受试大鼠按顺时针方向依次由第1、2、3、4象限入水点顺序放入水中,记录2 min内寻找平台时间(逃避潜伏期)和总路程。空间探索实验:定位航行实验结束后,次日进行空间探索试验,撤去平台后选第1象限同一入水点将大鼠面向池壁放入水中,测其2 min内跨越原平台位置次数和大鼠在平台象限停留时间、距离,判断大鼠记忆储存及提取再现能力。
2.4.2 生化指标
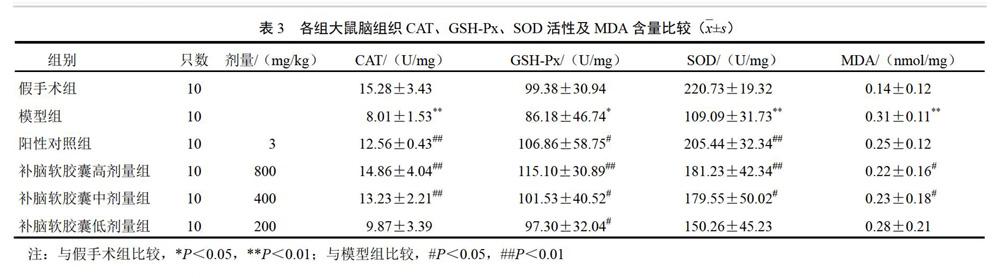
末次给药12 h后禁食不禁水,次日大鼠腹腔注射10%水合氯醛(3.5 mL/kg)麻醉,冰生理盐水心脏灌注,直至流出液体基本无色,停止灌注。取脑组织,分离海马组织,脑组织加1 mL生理盐水,匀浆机中制备成10%脑匀浆,低温3000 r/min离心10 min,取上清液,按试剂盒说明分别测定CAT、GSH-Px、SOD活性和MDA含量,采用BCA法测定蛋白含量。
2.4.3 HE染色观察神经细胞损伤
分离出的海马组织4%多聚甲醛固定,再经洗涤脱水、透明、浸蜡、包埋、切片、贴片、烤片、二甲苯脱蜡及水化、HE染色、封片等,镜下观察海马组织变化。每个标本连续切片5张,厚度4 μm。正常海马组织形态为CA1区锥体细胞排列整齐,形态完整,层次分明;胞质均质染色,核大而圆,胞核无固缩;纤维结构清晰,未见淋巴细胞浸润。
2.4.4 免疫组化检测β-分泌酶活性
石蜡切片脱蜡至水后,抗原修复,加一抗、二抗孵育,DAB显色,Harris苏木素复染细胞核,脱水封闭后镜检,图像采集分析。其中,深棕色为强阳性,棕黄色为中度阳性,浅黄色为弱阳性,蓝色细胞核为阴性。进而对每个组织切片进行识别,分析出强阳性、中度阳性、弱阳性及阴性面积,阳性百分比,最后进行组织化学评分。
3 统计学方法
采用SPSS13.0统计软件进行分析。计量资料以±s表示,组间比较用t检验,多组间比较用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 补脑软胶囊对模型大鼠Morris水迷宫实验学习记忆能力的影响
定位航行实验:与假手术组比较,模型组大鼠运动轨迹相对混乱,逃避潜伏期明显延长(P<0.01);与模型组比较,补脑软胶囊各剂量组和阳性对照组大鼠运动轨迹相对平缓,逃避潜伏期缩短,补脑软胶囊高剂量组和阳性对照组差异有统计学意义(P<0.05,P<0.01),见表1。空间探索实验:与假手术组比较,模型组大鼠平台象限穿越次数明显减少(P<0.01);与模型组比较,补脑软胶囊各剂量组和阳性对照组平台象限穿越次数增加,补脑软胶囊高剂量组差异有统计学意义(P<0.05),见表2。
4.2 补脑软胶囊对模型大鼠脑组织过氧化氢酶、谷胱甘肽过氧化物酶、超氧化物歧化酶活性及丙二醛含量的影响
与假手术组比较,模型组大鼠脑组织CAT、GSH-Px、SOD活性明显降低,MDA含量明显升高(P<0.05,P<0.01);与模型组比较,补脑软胶囊高、中剂量组大鼠脑组织CAT、GSH-Px、SOD活性明显升高,MDA含量明显降低(P<0.05,P<0.01),补脑软胶囊低剂量组大鼠脑组织GSH-Px活性明显升高(P<0.05)。结果见表3。
4.3 补脑软胶囊对模型大鼠海马组织神经细胞形态的影响
HE染色结果显示,大鼠海马组织神经元细胞核呈蓝色,细胞质呈红色。假手术组大鼠海马组织神经元数量丰富、排列规则、形态结构正常,胞核、胞质分界明显,核仁清晰,未见明显炎症,镜下可见CA1区锥体细胞分4层排列,整齐规则,胞浆尼氏体着色清晰,胞核淡染,核仁清楚;模型组大鼠海马齿状回区可见少量神经元皱缩,染色加深,胞核、胞质分界不清(黄色箭头),较多神经元胞质空泡化(红色箭头),多见毛细血管轻度瘀血,CA4区神经元数量减少,可见少量神经元皱缩,染色加深(绿色箭头);阳性对照组胞核、胞质分界明显,核仁清晰,齿状回区可见较多神经元皱缩,染色加深,胞核胞质分界不清(黑色箭头);补脑软胶囊高、中剂量组大鼠海马齿状回区可见神经元胞核体积减小、染色加深,少量神经元皱缩,胞核、胞质分界不清(黄色箭头);补脑软胶囊低剂量组大鼠海马可见大量神经元变性,胞质疏松淡染(黑色箭头),齿状回区局部可见较多神经元皱缩,染色加深,较多神经元胞质空泡化(红色箭头)。各给药组大鼠海马区神经元胞浆染色清晰,胞核淡染,形态明显好于模型组。但各给药组间无明显差异。结果见图1。
4.4 补脑软胶囊对大鼠海马组织神经细胞β-分泌酶活性的影响
与假手术组比较,模型组大鼠海马组织神经细胞β-分泌酶活性明显升高(P<0.05);与模型组比较,补脑软胶囊高、中剂量组和阳性对照组大鼠海马组织神经细胞β-分泌酶活性明显降低(P<0.05,P<0.01)。结果见图2、表4。
5 讨论
AD是一种病因复杂、隐匿,病程进行性发展的中枢神经退行性病变,随着疾病的进展,患者表现为认知、记忆、定向等能力明显下降,生活自理能力逐渐丧失。目前的研究将AD的发病原因主要集中在Aβ聚集形成淀粉样斑块、Tau蛋白异常磷酸化形成神经纤维缠结、Cav-1蛋白及EPh家族蛋白相关基因突变、炎症及氧化应激反应、胆碱能损伤等。
大脑皮层和海马区淀粉样前体蛋白(amyloid precursor protein,APP)主要受3种分泌酶(α、β、γ)的影响。α-分泌酶将APP分解为2段,β-、γ-分泌酶分别作用于蛋白质N、C端,经β-、γ-分泌酶作用,产生2种不同的肽,一种肽正常,另一种肽易聚集、毒性强,称为Aβ淀粉样肽[11]。正常情况细胞产生的Aβ几乎无神经毒性,异常或病理状态Aβ的產生和代谢不平衡可形成具有神经血管毒性的纤维状聚集物,进一步形成老年斑,这被认为是AD发生的早期触发因素[13]。老年斑与学习记忆密切相关,引起神经元损伤和认知功能衰退,在这个过程中单独发生或并发神经原纤维缠结,最终导致神经元变性和死亡[12-13]。老年斑是AD的不变特征,且极有可能是直接病因。因此抑制β-分泌酶的表达,可能减少斑块的形成。Aβ斑块沉积,进一步破坏神经元细胞膜,细胞通透性随之增加,大量Ca2+进入细胞,依次激活钙依赖性激酶、蛋白酶、脂肪酶、细胞内自由基生成,导致细胞损伤乃至死亡。蜕变的神经元释放有毒物质,转而刺激其他细胞释放炎症因子,引发局部炎症反应,同时产生自由基,而局部炎症反应又可加剧Aβ沉积,形成恶性循环,最终导致神经细胞死亡。本研究结果显示,补脑软胶囊可保护大鼠海马组织,抑制大鼠神经细胞中β-分泌酶的表达,起到保护神经细胞的作用。
机体遭受有害刺激时,体内氧化应激反应被激活,自由基产生随之增加,过氧化物超负荷,机体氧化-抗氧化系统间稳态被破坏,从而损伤体内生物大分子物质。Aβ沉积对氧自由基代谢系统产生持续影响,过氧化物可使溶解状态的Aβ转化为聚集态的Aβ,从而加速老年斑的形成[14]。本研究发现,与假手术组比较,补脑软胶囊可提高大鼠脑内过氧化物酶CAT、SOD和GSH-Px的活性,高剂量组作用更明显。
AD属中医学“呆证”“文痴”“郁证”“善忘”等范畴,其病位在脑,与肝、脾、肾密切相关。有学者认为,对痴呆的治疗,补肾益髓是基础,活血化瘀、化痰通络是增进智能的关键[15]。补脑软胶囊以甘肃道地药材岷当归为君药,养血、活血、祛瘀,加川芎、赤芍增强活血之力,配黄芪益气,合黄精、淫羊藿、补骨脂健脾补肾、养血生津,益母草祛瘀生新,甘草调和诸药,诸药共奏养血活血、补益肝肾、化瘀通络功效。本实验结果显示,补脑软胶囊通过清除自由基、抗氧化作用,以及抑制神经细胞β-分泌酶的表达,减少Aβ淀粉样肽产生,最终阻滞AD的发生与发展。本研究为其临床治疗AD提供了依据,但AD发生与发展是多通道、多因素共同作用的結果,今后有待于对药物作用机制进一步研究。
参考文献:
[1] 王德生,张守信.老年性痴呆[M].北京:人民卫生出版社,2001:197.
[2] 张均田.老年痴呆的发病机理及治疗策略[J].药学学报,2000,35(8):635-640.
[3] 李妍怡,刘志军,杨瑞龙,等.补脑膏治疗血管性痴呆70例[J].中医研究,2010,23(1):41-43.
[4] 李妍怡,杨瑞龙,刘志军,等.补脑膏对脑缺血再灌注损伤模型大鼠神经保护作用的机制研究[J].西部中医药,2013,26(10):14-16.
[5] 李喜香,毕映燕,李季文,等.正交试验优选补脑软胶囊水提乙醇沉降制备工艺[J].中成药,2014,36(12):2625-2628.
[6] 李喜香,刘效栓,毕映燕,等.补脑软胶囊质量标准的研究[J].中成药, 2016,38(2):321-325.
[7] 刘新峰,陈春富.实验神经病学[M].北京:人民军医出版社,2006:227- 228.
[8] DONG P, JI X, HAN W, et al. Oxymatrine attenuates Aβ1-42-induced neurotoxicity in primary neuronal cells and memory impairment in rats[J]. Can J Physiol Pharmacol,2019,97(2):99-106.
[9] WANG H. Establishment of an animal model of vascular dementia[J]. Exp Ther Med,2014,118(5):1599-1603.
[10] VICENTE M C, ALMEIDA M C, BICEGO K C, et al. Hypercapnic and hypoxic respiratory response during wakefulness and sleep in a streptozotocin model of Alzheimer's disease in rats[J]. J Alzheimers Dis,2018,65(4):1159-1174.
[11] ARBOR S C, LAFONTAINE M, CUMBAY M. Amyloid-beta Alzheimer targets-protein processing,lipid rafts, and amyloid-beta pores[J]. Yale J Biol Med,2016,89(1):5-21.
[12] HUNTINGTON P, INGE M W, LARS N N. The inflammation-induced pathological chaperones ACT and apo-Eare necessary catalysts of Alzheimer amyloid formation[J]. Neurobiology of Aging,2001, 22(6):923-930.
[13] FARES A, BORRMANN D. Neurochemical Aspects of Alzheimer's disease and movement disturbances:A theory of β-amyloid and T-protein[J]. Am J Alzheimers Dis Other Demen,2018,33(8):535- 540.
[14] POLIDORI M C. Oxidative stress and risk factors for Alzheimer's disease:clues to prevention and therapy[J]. J Alzheimers Dis, 2004,6(2):185-191.
[15] 王永炎,鲁兆麟,张允岭,等.中医内科学[M].2版.北京:人民卫生出版社,1999:311.
(收稿日期:2019-06-20)
(修回日期:2019-07-17;编辑:华强)

