褪黑素对肝星状细胞中PI3K/AKT信号通路的影响
陈艳梅,洪汝涛,岳彩飞
肝纤维化(hepatic fibrosis,HF) 是多种致病因素长期刺激肝脏引起的代偿反应,其病理特征是肝内细胞外基质(extracellular matrix,ECM)过度沉积,最终进展为肝硬化、肝癌[1]。目前尚无有效治疗肝纤维化的药物。研究[2]证实,肝纤维化可以逆转。肝星状细胞(hepatic stellate cells,HSCs) 的活化是引起肝纤维化的关键过程[3]。TGF-β1是最强的促纤维细胞因子[4]。研究[5-6]证实,阻断PI3K/AKT信号通路,能抑制肝纤维化。褪黑素(melatonin, Mel)是胺类激素,具有抗氧化、抗炎、抗纤维化等作用[7]。课题组前期研究[8]证明褪黑素对CCl4诱导的肝纤维化大鼠具有保护作用,但具体机制尚不清楚。该研究选用细胞实验检测褪黑素对TGF-β1诱导的HSC-T6细胞增殖和PI3K/AKT信号通路的影响,探究褪黑素抗肝纤维化的作用机制。
1 材料与方法
1.1 试剂和细胞TGF-β1(美国PeproTech公司);MTT、DMSO、褪黑素(美国Sigma公司);胎牛血清(杭州四季青生物有限公司);DMEM高糖培养基(南京Wisent生物技术有限公司);β-actin小鼠单克隆抗体(武汉三鹰生物技术有限公司);抗PI3K兔单克隆抗体、抗P-AKT兔单克隆抗体、抗AKT兔单克隆抗体(美国CST公司);DBA染色液、免疫组化试剂盒(北京中杉金桥生物技术有限公司);青霉素/链霉素、胰酶消化酶、BCA试剂盒(上海碧云天生物技术有限公司);HSC-T6细胞(南京凯基生物科技发展有限公司)。
1.2 细胞培养HSC-T6细胞培养于含10%胎牛血清和1%青霉素/链霉素的高糖DMEM完全培养基中,细胞置于37 ℃、含5%CO2的培养箱中培养,每隔24 h换1次培养基,当细胞融合达70%~80%时传代培养,选用对数生长期阶段的细胞进行实验。
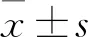
1.3 MTT实验选用对数生长期的HSC-T6 细胞,用胰酶消化,使细胞脱落,先计数细胞个数,测出浓度,再将其稀释成3×104个/ml的细胞悬液,以每孔200 μl铺板于96孔板中。为了防止干燥,边缘各孔均加入200 μl PBS。将细胞分成5组:对照组、模型组、褪黑素低浓度组(1 nmol/L)、褪黑素中浓度组(1 μmol/L)、褪黑素高浓度组(0.1 mmol/L),静置5 min后把板置于培养箱中。培养24 h后,吸净培养基,先用PBS清洗,再换用无血清的培养基,除对照组外,其余各组均加入TGF-β1(10 ng/ml),在三组不同浓度的褪黑素组加入对应浓度的褪黑素,将板置于37 ℃培养箱中。药物作用48 h后,吸净上清液,用PBS清洗后,每孔先加入180 μl无血清的培养基,再加入20 μl浓度为5 mg/ml 的MTT,反应4 h后,吸净上清液,每孔加入150 μl DMSO,把板置于震荡器中震荡10 min,充分溶解孔内的结晶,用酶标仪测定波长490 nm处各孔的光密度(optical density,OD)。
1.4 细胞免疫组化实验选用对数生长期的HSC-T6细胞,用胰酶消化,使细胞脱落,先计数细胞个数,测出浓度,再将其稀释成0.4×105个/ml的细胞悬液,把无菌的直径为15 mm的细胞爬片置于24孔板中,将已稀释的细胞悬液以每孔500 μl铺板于24孔板内的细胞爬片上。将细胞分成5组(同前),静置5 min后把板置于培养箱中。培养24 h后,吸净培养基,先用PBS清洗,再换用无血清的培养基,除对照组外,其余各组均加入TGF-β1(10 ng/ml),在三组不同浓度的褪黑素组加入对应浓度的褪黑素,将板置于37 ℃培养箱中。药物作用48 h后,吸净上清液,用PBS洗3次,每次3 min,为了固定细胞爬片上的细胞,滴加95%乙醇反应20 min,用PBS洗3次,每次3 min,将细胞爬片置于载玻片上,滴加0.3% Triton X-100孵育15 min,用PBS洗3次,每次3 min,滴加3%H2O2孵育10 min,用PBS洗3次,每次3 min,滴加血清孵育15 min,滴加一抗(P-AKT 1 ∶100),置于4 ℃冰箱中过夜,次日置于37 ℃恒温箱中复温30 min后,用PBS洗3次,每次3 min,滴加二抗,置于37 ℃恒温箱中孵育15 min,用PBS洗3次,每次3 min,滴加辣根酶,置于37 ℃恒温箱中孵育15 min,用PBS洗3次,每次3 min,滴加DAB显色液,苏木精复染10 s后,用自来水冲洗,晾干后用中性树胶封片。HSC-T6细胞出现棕黄色或黄褐色为阳性显色,将显微镜调至200倍,镜下观察细胞的染色情况,随机拍摄6个不连续的视野,并将其保存。用Image-ProPlus 6.0软件测定每张图片中阳性区域的OD值,并得出每张爬片的平均OD值,最后用这个值来分析蛋白阳性表达的情况。
1.5 Western blot实验选用对数生长期的HSC-T6细胞,用胰酶消化后,加入培养基使细胞制成细胞悬液,将其接种于培养皿内。将细胞分成5组(同前),把皿置于培养箱中。培养24 h后,吸净培养基,先用PBS清洗,再换用无血清的培养基,除对照组外,其余各组均加入TGF-β1(10 ng/ml),在三组不同浓度的褪黑素组加入对应浓度的褪黑素,将皿置于37 ℃培养箱中。药物作用48 h后,提取细胞的总蛋白,用BCA法测定蛋白浓度,加热使蛋白变性,配制分离胶、浓缩胶,加样,电泳分离目的蛋白后,将目的蛋白转移到PVDF膜上,丽春红染色PVDF膜上的目的蛋白,用双蒸水洗3次,每次5 min,5%脱脂牛奶室温封闭2 h,用双蒸水洗3次,每次5 min,滴加一抗(PI3K 1 ∶1 000,AKT 1 ∶1 000,P-AKT 1 ∶2 000,β-actin 1 ∶1 000),置于4 ℃冰箱中的慢摇床上孵育过夜,次日置于室温复温30 min后,先用PBST洗3次,每次7 min,再用PBS洗1次,每次7 min,滴加二抗(1 ∶60 000),置于摇床上室温孵育2 h后,先用PBST洗3次,每次7 min,再用PBS洗1次,每次7 min,将显影仪内的温度降至-40 ℃,滴加显影液显影,拍摄并保存显影的结果。用Image-ProPlus 6.0图像分析软件来分析结果,以β-actin为内参,以PI3K/β-actin的灰度比作为PI3K的相对表达量,以P-AKT/AKT的灰度比作为P-AKT的相对表达量。
1.6 定量PCR(qPCR)实验选用对数生长期的HSC-T6细胞,用胰酶消化后接种于培养瓶内。将细胞分成5组(同前),把瓶置于培养箱中。培养24 h后,吸净培养基,先用PBS清洗,再换用无血清的培养基,除对照组外,其余各组均加入TGF-β1(10 ng/ml),在三组不同浓度的褪黑素组加入对应浓度的褪黑素,将瓶置于37 ℃培养箱中。药物作用48 h后,提取细胞的总RNA,用紫外分光光度计测定RNA的浓度。消化残留的DNA:加入无酶水3 μl,RQ/Rnase 10×Recation Buffer 1 μl,RQ/Rnase-Free Dnase 2 μl,RNA 4 μl,离心混匀,置于37 ℃ PCR仪上,反应30 min,加入1 μl 终止液RQ/Dnase Stop Solution,置于70 ℃ PCR仪上,反应10 min;逆转录:加入10×buffer 和10 mmol/L dNTP 各2 μl,RNase 0.5 μl,AMV逆转录酶0.75 μl,随机引物1 μl、无酶水2.75 μl,离心混匀,置于42 ℃PCR仪上,反应60 min,置于95 ℃ PCR仪上,继续反应5 min;PCR扩增:加入无酶水7 μl,PCR反应Mix 10 μl,正向引物、反向引物、cDNA各1 μl,震荡混匀,加入96孔板中扩增。PCR扩增条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸30 s,循环扩增共40次,末次循环结束后,分析电脑上的溶解曲线(检测引物的质量),并记录CT值,选取β-actin作为内参,选用2-ΔΔCt法来分析目的基因的表达。α-SMA引物序列如下:F:5′-GGAGATGGCGTGACTCACAA-3′,R: 5′-CGCTCAGCAGTAGTCACGAA-3′;β-actin: F: 5′-CACCCGCGATACAACCTTC-3′,R:5′-C CCATACCCACCATCACACC-3′。
2 结果
2.1 MTT检测褪黑素对TGF-β1诱导的HSC-T6细胞增殖的影响结果显示,与对照组相比,TGF-β1能显著诱导HSC-T6细胞增殖(F=11.886,P<0.01);与模型组相比,各浓度褪黑素组均能抑制HSC-T6细胞增殖,且褪黑素的浓度越高,抑制作用越明显(F=11.886,P<0.01)。见表1。

表1 褪黑素对TGF-β1诱导的 HSC-T6细胞增殖的影响
与对照组比较:**P<0.01;与模型组比较:##P<0.01
2.2 细胞免疫组化检测褪黑素对HSC-T6细胞中P-AKT蛋白表达的影响P-AKT蛋白主要表达于HSC-T6细胞胞质。与对照组相比,模型组中P-AKT蛋白的表达明显增多(F=42.019,P<0.01);与模型组相比,各浓度褪黑素组中P-AKT蛋白的表达明显减少(F=42.019,P<0.01),且褪黑素的浓度越高,P-AKT蛋白表达减少越明显。见图1。
2.3 Western blot检测褪黑素对HSC-T6细胞中PI3K和P-AKT蛋白表达的影响与对照组相比,模型组中PI3K和P-AKT蛋白的表达明显增多(F=9.466、F=63.672,P<0.01);与模型组相比,各浓度褪黑素组中PI3K和P-AKT蛋白的表达均明显减少(F=9.466、F=63.672,P<0.01或P<0.05),且褪黑素的浓度越高,PI3K和P-AKT蛋白表达减少越明显。见图2、3。
2.4 qPCR检测褪黑素对HSC-T6细胞中α-SMA mRNA表达的影响与对照组相比,模型组中α-SMA mRNA的表达明显增多(F=70.672,P<0.01);与模型组相比,各浓度褪黑素组中α-SMA mRNA的表达均明显减少(F=70.672,P<0.01),且褪黑素的浓度越高,α-SMA mRNA表达减少越明显。见图4。

图1 褪黑素对HSC-T6细胞中P-AKT蛋白表达的影响 ICC×200
A:对照组;B:模型组;C:褪黑素低浓度组;D:褪黑素中浓度组;E:褪黑素高浓度组;与对照组比较:**P<0.01;与模型组比较:##P<0.01

图2 褪黑素对HSC-T6细胞中PI3K蛋白表达的影响
A:对照组;B:模型组;C:褪黑素低浓度组;D:褪黑素中浓度组;E:褪黑素高浓度组;与对照组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
3 讨论
肝纤维化是一种复杂的肝细胞修复反应,各种致病因素(如病毒、药物和酒精等)长期持续损害肝脏,引起HSCs活化,分泌大量ECM并过度沉积,破坏肝脏结构,从而导致肝纤维化[3]。若不有效治疗,肝纤维化最终将进展为肝硬化、肝癌。有研究[2]表明,肝纤维化是可以逆转的。因此,研发安全有效的抗肝纤维化药物有重要的临床意义。

图3 褪黑素对HSC-T6细胞中P-AKT蛋白表达的影响
A:对照组;B:模型组;C:褪黑素低浓度组;D:褪黑素中浓度组;E:褪黑素高浓度组;与对照组比较:**P<0.01;与模型组比较:##P<0.01

图4 褪黑素对HSC-T6细胞中α-SMA mRNA表达的影响
A:对照组;B:模型组;C:褪黑素低浓度组;D:褪黑素中浓度组;E:褪黑素高浓度组;与对照组比较:**P<0.01;与模型组比较:##P<0.01
褪黑素是松果体分泌的胺类激素,具有调节免疫、抗氧化、抗炎、抗纤维化等功能。Lebda et al[9]研究表明,褪黑素能增强抗氧化活性,减少促炎细胞因子和纤维化基因表达,减少HSCs增殖,从而抗肝纤维化。Kang et al[10]研究表明,褪黑素能增强线粒体自噬和线粒体生物合成,从而抗肝纤维化。本课题组前期研究[8]表明,褪黑素具有抗肝纤维化作用,但具体机制尚不明确。
HSCs是一种间质细胞,位于肝脏Disse间隙。在正常情况下,HSCs处于静止状态,其主要功能是储存和代谢VitA,合成和分泌少量的ECM。当各种致病因素引起肝脏损伤时,在TGF-β和血小板衍生生长因子(PDGF)等多种细胞因子作用下,HSCs 活化,转化为肌成纤维细胞,表达大量的α-SMA,合成过多的胶原蛋白,使ECM在肝脏过度沉积,从而导致肝纤维化[11]。α-SMA是 HSCs活化的标志。因此,抑制HSCs活化与增殖成为抗肝纤维化的重要靶点。MTT结果显示,TGF-β1能显著诱导HSC-T6细胞增殖,而高浓度褪黑素能显著抑制HSC-T6细胞增殖;qPCR结果显示,TGF-β1能增强HSC-T6细胞中α-SMA mRNA的表达,而褪黑素能明显抑制α-SMA mRNA的表达。推测褪黑素可能通过抑制HSC-T6细胞增殖,抑制ECM合成,从而抗肝纤维化。
PI3K/AKT信号通路在肝纤维化发生发展中起重要的作用[12]。PI3K是磷脂酰肌醇-3-激酶,由调节亚基p85和催化亚基p110组成,具有丝氨酸 /苏氨酸蛋白激酶和磷脂酰肌醇激酶的双重活性。AKT是一种丝氨酸 /苏氨酸蛋白激酶。当细胞外的配体与相应的受体结合后,激活PI3K,改变p85和p110复合体的构象,使磷脂酰肌醇-4,5-二磷酸(简称PIP2)生成磷脂酰肌醇-3,4,5-三磷酸(简称PIP3)。PIP3与AKT结合后,使AKT从胞质转移到胞膜。PDK1磷酸化AKT的Thr308位点,PDK2磷酸化AKT的Ser473位点,从而活化AKT[13]。有研究[12]证实,积雪草酸通过抑制PI3K/AKT信号通路,抑制HSCs活化和ECM合成,从而抗肝纤维化。细胞免疫组化和Western blot结果显示,TGF-β1能明显增强HSC-T6细胞中PI3K和P-AKT蛋白的表达,而褪黑素能明显抑制PI3K和P-AKT蛋白的表达。推测褪黑素可能通过抑制PI3K/AKT信号通路,从而抑制HSC-T6细胞增殖。
综上,褪黑素能抑制HSC-T6细胞活化与增殖,抑制ECM合成,可能与抑制PI3K/AKT信号通路有关。本实验仅为初步研究,具体机制仍需进一步探究。

