基于微流控技术的数字PCR检测仪设计与实现
何关金
(广东顺德工业设计研究院〈广东顺德创新设计研究院〉 广东 佛山 528000)
0 引 言
聚合酶链式反应(Polymerase Chain Reaction,PCR)技术是分子生物学的基础手段,用于特定核酸片段的相对定量和绝对定量,自20世纪70年代问世以来,在生命科学、分子诊断、医学研究以及农业等领域获得了广泛应用,为人类的生命健康和自然的和谐发展发挥了巨大作用[1]。PCR技术分为 3个阶段,即普通 PCR、实时定量 PCR(quantitative PCR,qPCR)和数字 PCR(digital PCR,dPCR)[2-4]。
数字PCR技术于20世纪末提出,其原理是将实时定量PCR反应体系通过一定的技术手段进行有限元分区,形成数以万计的单一反应体系,当分区足够多时,根据泊松分布原理,以没有发生扩增反应的阴性分区比例可以计算出目标分子的起始拷贝数,从而计算出浓度等。作为绝对定量技术,其优势在于无需标准曲线,灵敏度高,线性范围广。根据泊松分布原理,分区数量越多,所获得的结果越精确[5]。
初期的数字PCR技术主要以多孔芯片中的微反应室(多至 20000孔)对反应体系进行分散,其固有的缺点是分散单元数量相对较少,且载样过程复杂不易重复[4]。微滴式数字 PCR(droplet digital PCR,ddPCR)技术作为一种更灵活的方法,被越来越多地研究和应用[6-8]。针对微滴式数字PCR技术的庞大应用市场,配套的数字 PCR检测设备越来越多地受到国内外相关行业公司的关注[9]。
本文设计了一种基于微流控技术的微滴式数字PCR检测仪,用于检测微滴扩增后产生的荧光信号,通过采集、分析荧光信号波形得到阴性微滴比例,根据泊松分布原理从而得到靶分子的起始拷贝数或浓度。本仪器设置 2个荧光检测通道,具有检测灵敏度高、线性范围广、结果分群明显等优势,能快速准确定量核算分子浓度,可应用于肿瘤、感染性疾病、基因多态性、多基因遗传病诊断,具有广阔的应用前景。
1 仪器设计与制造
1.1 硬件设计方案
检测仪系统框图如图1所示。通过进样针、切向阀、注射泵配合使用抽取微滴,并驱动流过微滴检测芯片,在十字口经载体油推动排列成单个微滴的序列进入检测位置,如图2所示。LED激发光源激发微滴内针对不同基因探针标记的FAM或VIC荧光染料,2种荧光染料发射波长分别为520nm(FAM荧光)和554nm(VIC荧光)。通过光学组件将 2种荧光分离,并通过2组PMT探测器采集荧光信号,将其转换为模拟信号。2路模拟荧光信号经过二阶有源滤波器滤除噪声后送入 16位 ADC转换为数字信号,通过FPGA对 2路信号进行快速采集。ADC采样芯片选择 ADI公司的 AD1377,该芯片输入电压范围广,线性误差小,采样速度高。ADC采集到的荧光波形数据传输给主CPU(STM32F103),并通过USB接口将数据传送到PC端电脑分析软件。
为了完成微滴在96孔板中不同孔位进样还需要控制三维运动机构实现对孔位的定位。三维机构运动采用3组带编码器的无刷电机闭环控制,实现位置精确定位及确保微滴抽取完全。通过控制注射泵的运动和切向阀的转换实现微滴进样、抽样、液路清洗等过程。仪器采用步进电机控制进样门的开合,操作简单。本检测仪还加入了废液油过量检测、检测油空、96孔板未安装等故障检测功能,以确保实验正常进行。
无刷直流电机驱动器采用 A4989三相集成驱动芯片控制。A4931是Allegro MicroSystems公司推出的三相无刷直流电机电机的前置驱动器,可驱动多种N沟道的功率 MOSFET,支持的马达供电电源高达30V,同时还具有堵转保护、过热停机、过压监视等功能。DIR端口控制电机的运动方向,PWM 端口控制电机的运动速度,Brake端口用于电机刹车,防止过冲。同时通过FG1和FG2可以准确测量电机的旋转速度。AM26LV31为单端转差分信号的芯片,可以将外部输入的Hall单端信号转化为A4931需要的差分信号。同时,无刷直流电机配 10000线的 ABZ编码器用作闭环位置反馈信号,为编码器信号输入口,滤波后与CPU相连。
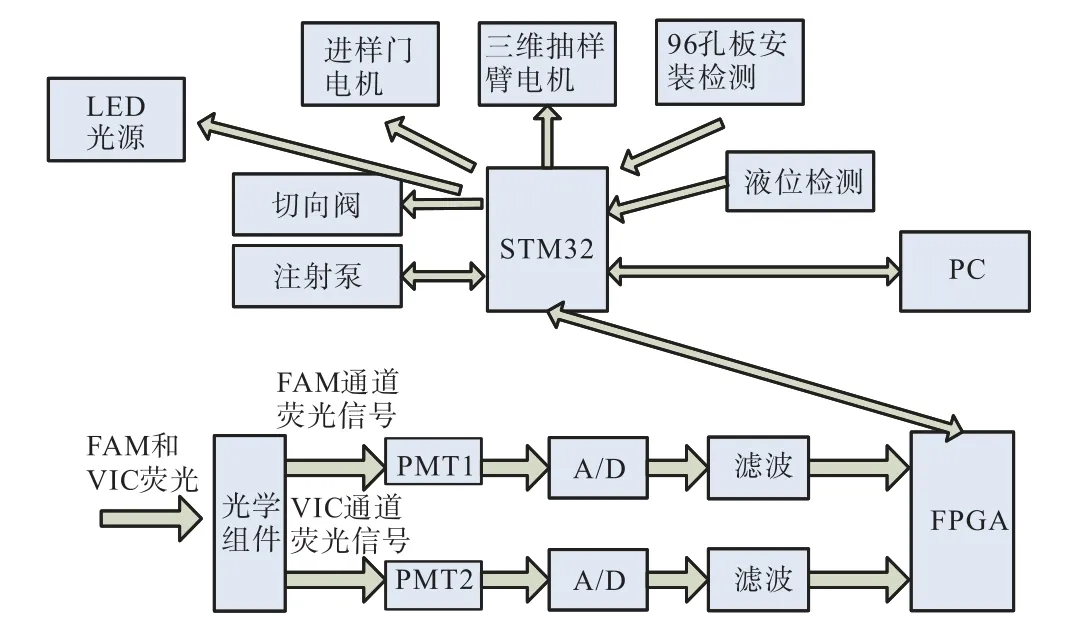
图1 检测仪系统框图Fig.1 Detector system block diagram
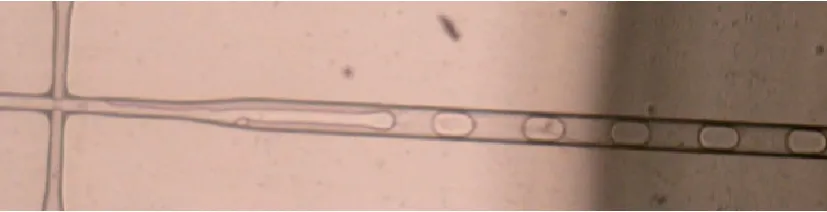
图2 荧光检测流道Fig.2 Fluorescence detection flow path
1.2 荧光信号处理系统
系统荧光信号处理过程如图3所示。采集的荧光信号并不是平滑的,存在一些由于电源波动、流体杂质、信号干扰等造成的随机噪声,随机噪声将对后期峰值提取造成失效或不准的影响。在峰值提取之前需要对信号进行滤波处理。另外,在微滴荧光检测过程中,荧光检测点位于玻璃检测芯片微流道的中间。由于检测油的液体折射、散射和玻璃材质芯片散射光的作用,整体的荧光数据会出现整体向上偏移。因此,峰值提取前进行了基线调整。
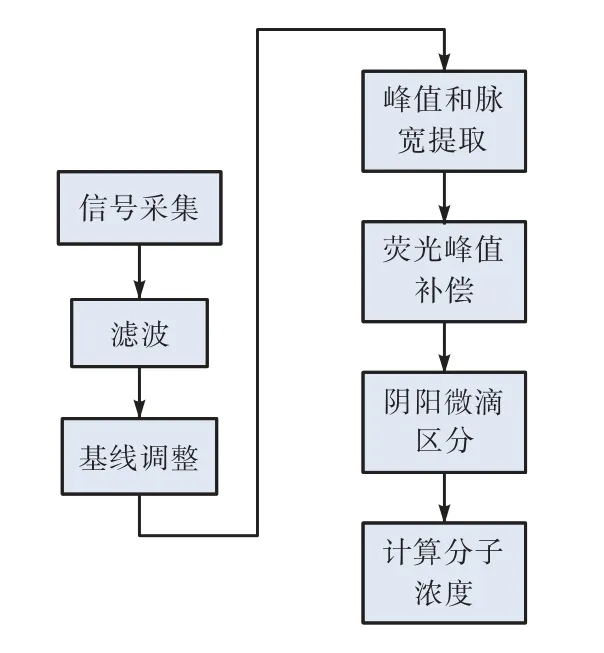
图3 荧光信号处理过程Fig.3 Fluorescence signal processing
波形识别情况更为复杂,当微滴较好地均匀离散通过检测点时,微滴波形呈现高斯分布。但是,实际中微滴通过检测点时并不理想,会存在多个微滴同时通过、重叠通过的情况,同时还存在流体中杂质发出非正常荧光信号干扰的情况,针对每种情况需要识别,然后保留或剔除。为了检测突变基因变异程度,本微滴式数字PCR检测仪设计了FAM和VIC 2种荧光通道,但引入了通道间荧光值串扰的问题,因此我们对每个通道荧光值进行了补偿。
1.3 荧光补偿
“荧光补偿”是指修正荧光光学信号在探测器相互渗透并被数字化检测的过程。荧光补偿不足会导致弱阳性群体使假阳性颗粒增多,过度补偿则会丢失弱阳性群体而导致假阴性。经过设计不同浓度的单荧光探针双通道的实验,确定了不同浓度荧光素钠在同时通过2种通道时,2种通道采集的荧光数据呈线性分布。因此,可以采用线性的方式补偿荧光。
x定义为在n探测器中检测到的来自x荧光的信号。这样fF1就是指FAM探测器中FAM探针荧光的信号;vF2是指VIC荧光探测器中VIC荧光的信号。Dn是指探测n所检测到的荧光信号[10-11]。于是有:

x荧光在其他探测中的信号将与xFn计算例(n指代专门收集此荧光的探测器);这样,如要知道有多少真正的FAM或VIC信号,就需要计算fF1和vF2。现已知的比值恒定。同理,比值恒定。比值定义如下:

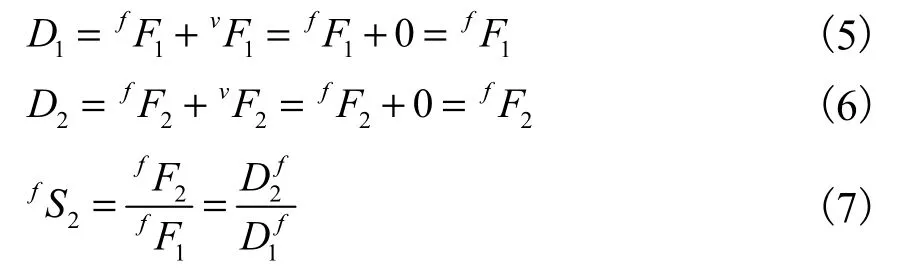
同理,由单一VIC荧光补偿质控物实验可得:

由公式(1)(2)(7)(8)可得:
FAM探测器中真正FAM荧光值为:

VIC探测器中真正VIC荧光值为:

补偿后的峰值为单色荧光产生的实际值,根据自动阈值划分算法确定阴阳区分的阀值,荧光幅值大于等于阀值划分为阳性微滴,荧光幅值小于阀值划分为阴性微滴。
1.4 样本浓度及变异比率计算
数字PCR是利用直接计数的方法进行定量,在PCR扩增后有荧光信号的微滴确定为阳性微滴,无荧光信号的微滴记为阴性微滴。把样本通过微滴生成方法均匀分割后,理论上每个有荧光信号的微滴代表一个DNA分子拷贝数。但是,在通常情况下,数字PCR反应单元(单个微滴)中可能包含2个或2个以上的目标分子,这时需要用泊松分布公司进行计算[12]。
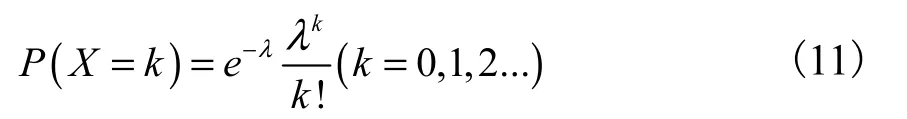
式中:λ为每个反应单元(单个微滴)中包含目标DNA分子的平均拷贝数(浓度);P为在一定的λ条件下,总反应体积中所包含k个拷贝目标DNA分子的概率。
而λ由样本的稀释倍数m决定:
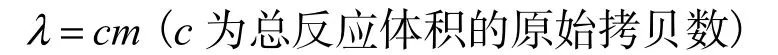
同时,k=0时,P可以看作阴性微滴个数(无荧光信号反应单元的个数)与微滴总个数(总反应单元个数)的比值,即:

其中,n为微滴总数,f为阳性微滴个数,对等式(12)两边取对数(ln)得
1μL体积下的拷贝数为:D=c/V(V为总反应体积,单位为μL)
用FAM通道内探针标记突变型基因,得到突变基因的拷贝数d1;用VIC通道内探针标记野生型基因,得到野生型基因的拷贝数为d2。由公式(13)可确定基因突变率。

1.5 数据分析系统软件设计
数据分析软件作为检测仪重要组成部分,完成对荧光检测数据的分析,向用户直观展现阳性微滴、阴性微滴、总微滴、微滴拷贝数、基因变异系数等数值信息,同时通过一维和二维图形展现微滴分群情况。分析软件系统框架如图4所示,由实验设置、实验运行、数据分析、系统设置以及帮助5个部分组成。
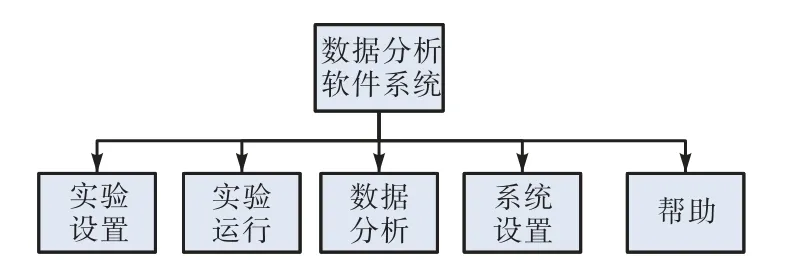
图4 数据分析系统软件架构图Fig.4 Software architecture diagram of data analysis system
实验设置(Mode)界面可以对需要运行的孔位、样本名称、实验类型、检测类型等进行设置,同时可以加载之前保存的设置。
实验运行(Run)界面直观展现当前检测的孔位,执行进度以及上一个孔检测结果的一维图和二维图,如图5所示。
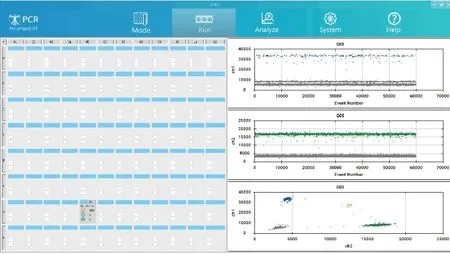
图5 系统软件运行界面Fig.5 System software operation interface

图6 系统软件分析界面Fig.6 System software analysis interface
分析界面(Analyze)显示通过Mode界面加载的孔的结果数据(图6)。分析界面分为结果图窗口、结果表窗口和孔选择窗口。结果图窗口以一维图、二维图的形式展示了微滴分布的结果;结果表窗口以表格方式展示了对应孔位检测的阳性微滴数、阴性微滴数、总微滴数、总拷贝数等信息。孔选择窗口为用户自由选择对比孔提供了便利,方便同类实验对比。
系统设置(System)界面可以设置系统参数,如微滴直径、样本体积、数据保存路径、数据保存类型等。
2 实验结果
为验证本套数字PCR系统的准确性与精度,本研究购买了Horizon(#HD780)突变频率为5%、1%、0.1%、0%标准品,每个样本2个重复,试验重复3次,结果显示,同一次试验中2个结果较为相近,与标准品提供的拷贝数一致,同一样本的3次重复实验结果的CV≤5%,扩增后阴阳微滴区分明显(图7)。实验结果说明,本套数字PCR仪器准确性好,精度也比较高。
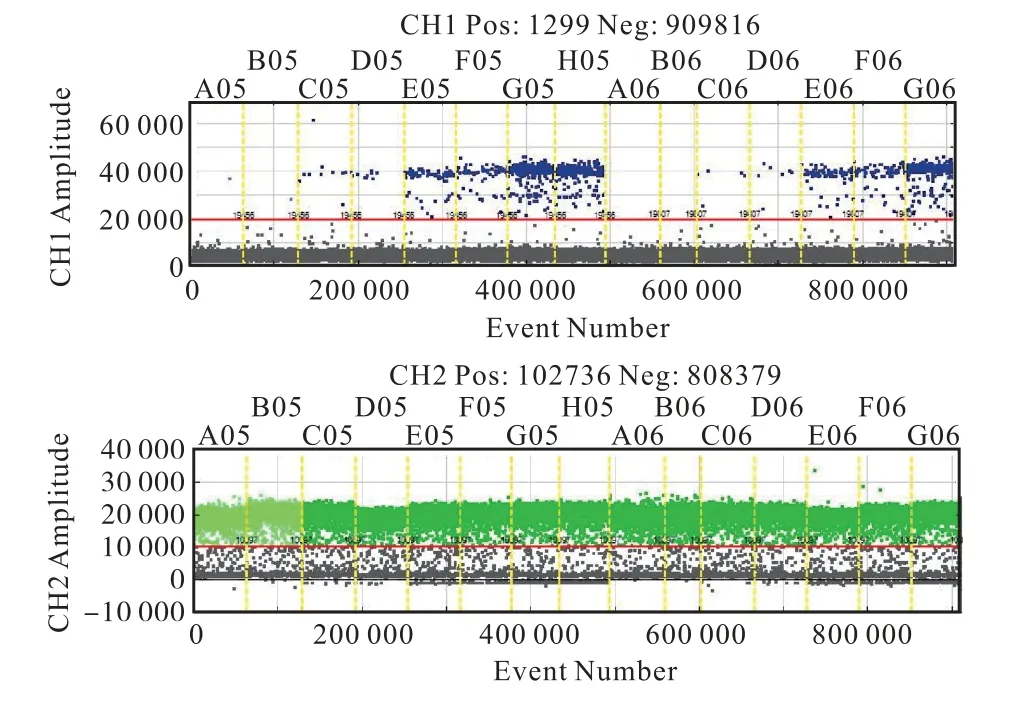
图7 Horizon检测结果Fig.7 Result of horizon detection
为验证仪器线性范围和线性相关性,本研究采用自主构建的 EGFR L858R突变型和野生型质粒进行了线性测试,实验过程如下所述。
①样本制备:使用 Magen质粒快速提取试剂盒质粒,使用Qbit和Bio-rad Q200数字PCR体系配合对提取的质粒定量,通过稀释得到质粒浓度梯度为10拷贝数至 1000000拷贝数(101~106)共 6个梯度。
②扩增体系制备:通过移液枪依次加入自主研发的 2X Mix 10µL,EGFR L858R 上下引物各1800nmol野生型探针(VIC通道)和突变型探针(FAM通道)各500nmol梯度样本各1µL试剂,最后使用ddH2O补足20µL,最终形成20µL体系的水相扩增体系。
③微滴生成:将20µL的水相用移液枪转移到配套微滴生成芯片的水相 Well中,将 30µL自主研发的微滴生成油(含高性能表面活性剂)转移到微滴生成芯片的油相 Well中。将生成芯片置于配套开发的微滴生成仪中,一键运行等待运行完成。微滴生成完成后,在微滴生成芯片的出口 Well中的上层形成直径约为70µm、数量约为10万个的乳白色微滴层。
④微滴转移、封膜与扩增:将电动移液枪移液体积设置为 45µL,然后利用电动移液枪将微滴生成芯片出口Well中的微滴转移至艾本德的96孔PCR板中。利用自主研发的PCR板封膜仪将PCR板封上铝膜后转移到 ABI的热循环扩增仪上进行扩增,扩增程序见表1。
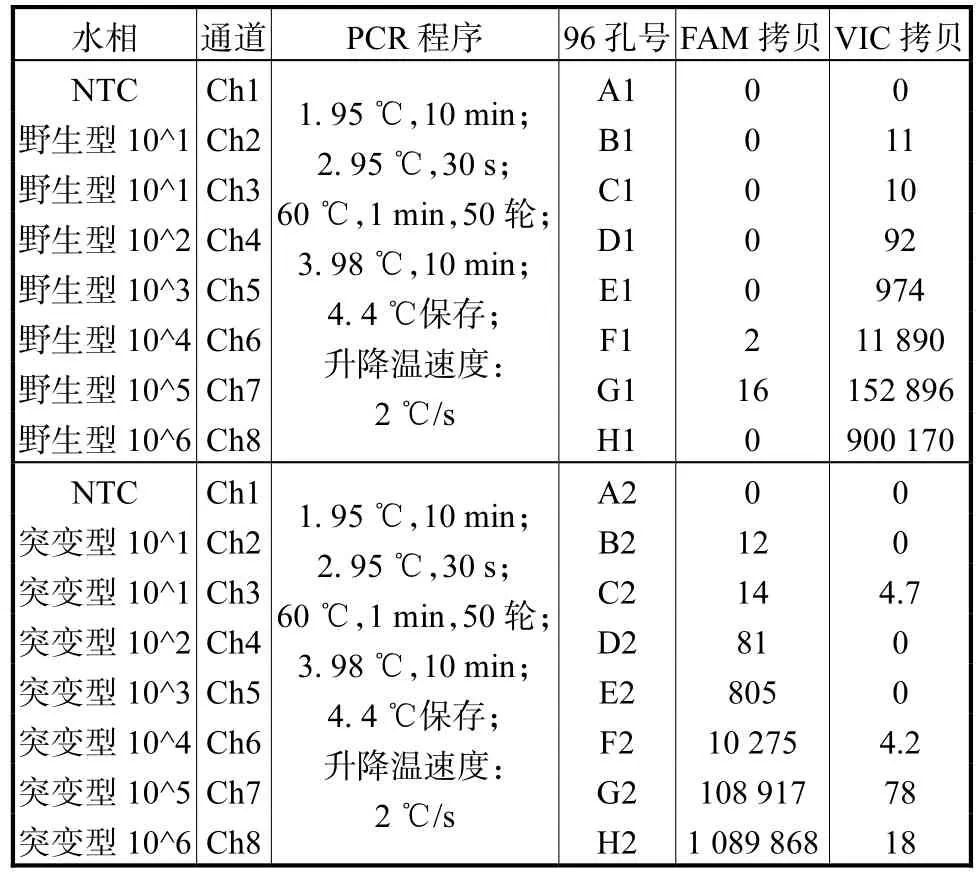
表1 FAM和VIC通道101-106拷贝数梯度检测结果Tab.1 FAM and VIC channel 101-106 copy number gradient test results
⑤微滴检测:扩增结束后,直接将 96孔板移至自主研发的数字 PCR检测仪中检测微滴阴阳性,检测结果见表1。
⑥数据分析:将检测软件分析后获得拷贝数取对数,使用 Excel中图标分析工具分析样本浓度梯度的线性系数,分析数据结果显示突变型和野生型拷贝数的线性相关系数R2均大于 0.99(图8~9)。实验结果表明,本仪器线性范围广,稳定性好。
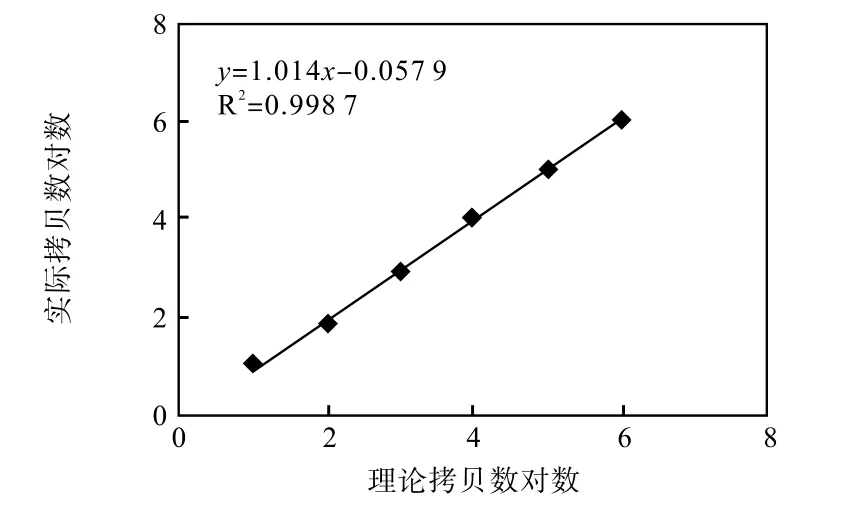
图8 单通道突变性拷贝数相关系数Fig.8 Single-channel mutant copy number correlation coefficient
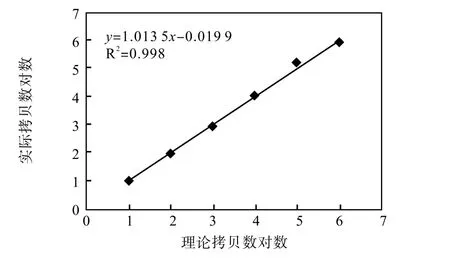
图9 单通道野生性拷贝数相关系数Fig.9 Single-channel wild copy number correlation coefficient
3 结 论
数字PCR属于第三代PCR技术,相比于第二代荧光定量 PCR的相对定量和第一代 PCR定性具有绝对定量的能力,是 PCR技术发展的重要方向之一。本文从硬件设计、荧光检测、软件设计和数据处理等方面论证了数字 PCR仪器的原理,并依据理论设计研发了流式微滴数字 PCR检测仪。本仪器能够快速检测 70μm 微滴的荧光信号,结合相应的数据处理算法能够根据微滴荧光强度判定微滴的阴阳性,结合泊松分布模型实现核酸的绝对 定量。
通过对国际标准品 Horizon的测试,确定本研究中的数字 PCR系统能够区分微滴的荧光强度,且具有非常高的准确性和精度,推广测试实验室制备的质粒样本梯度标准品。两通道拷贝数结果的线性相关系数 R2均大于 0.99,进一步证明本研究中数字 PCR系统检测结果稳定准确,具有应用价值。另外,在本套数字 PCR系统上探索了多位点基因突变检测,可实现多重测试,在每通道各 2个位点检测中,通过调整引物和探针量,二维结果图中准确实现 16分群,有效提高了检测效率,降低检测成本,具有一定的应用价值。

