Hedgehog通路在缺氧诱导脑胶质瘤转移中的作用及分子机制研究
傅之梅 胡兵伟 王钱东 马婷婷


[摘要] 目的 探討Hedgehog通路在缺氧诱导脑胶质瘤转移中的作用及分子机制。 方法 选择2018年1月~2019年8月浙江省立同德医院脑胶质瘤患者5例,取其脑胶质瘤细胞,随机分为对照组、抑制剂处理组、乏氧组和乏氧加抑制剂处理组。各组细胞均完成48 h培养,采用Westernblot检测各组细胞Smoothened(SMO)、神经胶质瘤相关癌基因同源蛋白1(GLI1)和上皮间质转化(EMT)E-cadherin基因表达,采用BrdU-ELISA法检测细胞增殖,采用Transwell法检测细胞侵袭作用。 结果 Westernblot检测结果显示,乏氧加抑制剂处理组SMO、GLI1及EMT相关蛋白表达水平低于乏氧组、抑制剂处理组与对照组(P<0.05);乏氧组SMO、GLI1及EMT相关蛋白表达水平高于抑制剂处理组与对照组(P<0.05)。BrdU-ELISA法结果显示,乏氧加抑制剂处理组不同时间点细胞增殖率低于乏氧组,高于抑制剂处理组与对照组(P<0.05)。Transwell法检测结果显示,乏氧加抑制剂处理组细胞侵袭率低于乏氧组,但明显高于抑制剂处理组与对照组(P<0.05);乏氧组细胞侵袭率高于抑制剂处理组与对照组(P<0.05)。 结论 Hedgehog通路可能通过SMO、GLI1调控EMT,参与疾病的发生、发展,在缺氧诱导脑胶质瘤转移中发挥重要的作用,能为脑胶质瘤转移治疗提供新的靶点。
[关键词] Hedgehog通路;Smoothened;神经胶质瘤相关癌基因同源蛋白1;上皮间质转化;缺氧诱导;脑胶质瘤转移
[中图分类号] R739.41 [文献标识码] A [文章编号] 1673-9701(2020)32-0020-04
[Abstract] Objective To explore the role and molecular mechanism of Hedgehog pathway in hypoxia-induced glioma metastasis. Methods From January 2018 to August 2019, a total of 5 patients with glioma from Tongde Hospital of Zhejiang Province were selected as subjects. Glioma cells were collected and randomly divided into a control group, an inhibitor-treated group, a hypoxia group, and a hypoxia combined with inhibitor-treated group. The cells in each group were given 48 hours of culture. The expression of Smoothened(SMO), glioma-associated oncogene homologous protein 1(GLI1) and epithelial mesenchymal transformation(EMT) E-cadherin genes were detected by Westernblot, cell proliferation was detected by BrdU-ELISA method, and cell invasion was detected by Transwell method. Results Westernblot test results showed that the expression levels of SMO, GLI1 and EMT-related proteins in the hypoxia combined with inhibitor-treated group were lower than those in the hypoxia group, inhibitor-treated group and control group(P<0.05); the expression levels of SMO, GLI1 and EMT-related proteins in the hypoxia group were higher than those in the inhibitor-treated group and the control group(P<0.05); the results of BrdU-ELISA showed that the cell proliferation rate in the hypoxia combined with inhibitor-treated group at different time points was lower than that in the hypoxia group, but was higher than that in the inhibitor-treated group and control group(P<0.05); Transwell test results showed that the cell invasion rate in the hypoxia combined with inhibitor-treated group was lower than that in the hypoxia group, but was significantly higher than that in the inhibitor-treated group and control group(P<0.05); the cell invasion rate in the hypoxia group was higher than that in the inhibitor-treated group and control group(P<0.05). Conclusion Hedgehog pathway may participate in the occurrence and development of EMT through SMO and GLI1 regulations, which play important roles in hypoxia-induced glioma metastasis and can provide a new target for the treatment of glioma metastasis.
[Key words] Hedgehog pathway; Smoothened; Glioma-associated oncogene homologous protein 1; Epithelial mesenchymal transformation; Hypoxia-induced; Glioma metastasis
胶质瘤是临床常见的恶性肿瘤,在中枢神经系统肿瘤中较为常见,占颅脑肿瘤的35.26%~60.96%,其发病率占脑肿瘤首位,死亡率居第二位[1]。由于胶质瘤具有高浸润生长的生物学特性,导致手术无法保证肿瘤的完全切除,术后复发率近90.0%,且随着手术次数、复发次数的增加,恶性程度具有增加趋势。缺氧是肿瘤微环境的基本特征之一,能促进肿瘤侵袭和转移作用[2-3]。临床研究显示,介导缺氧应答的主要转录因子-缺氧诱导因子1α(HIF-α)在脑胶质瘤等多种肿瘤中过表达,且与脑胶质瘤的转移、预后有关[4-5]。上皮间质转化(EMT)是将具有极性的上皮细胞转换成具有活性能力、能在细胞基质间自由移动的间质细胞的过程[6]。Suh[7]的研究表明,Hedgehog通路中的锌指转录因子GLI1及上游转膜蛋白SMO亦是上述缺氧/JDAC3调节的靶基因,哺乳动物Hedgehog通路由三种HH配体激发,能与受体转膜蛋白Patched1(PTCH1)结合,从而阻断PTCH1对转膜蛋白SMO的抑制功能,释放SMO活性,实现下游靶基因的调控作用[8-9]。因此,本研究以脑胶质瘤细胞为研究对象,探讨Hedgehog通路在缺氧诱导脑胶质瘤转移中的作用及分子机制,现报道如下。
1 资料与方法
1.1 一般资料
选择2018年1月~2019年8月浙江省立同德医院脑胶质瘤患者5例。取其脑胶质瘤细胞,随机均分为对照组、抑制剂处理组、乏氧组和乏氧加抑制剂处理组。本研究经医院医学伦理委员会批准,所有患者知情同意。
1.2 方法
1.2.1 材料与设备 胎牛血清RMPI-1640培养基(美国HyClone公司)、小牛血清(杭州四季青生物工程材料有限公司)、Transwell小室(美国Becton Dickinson)、人工基质胶Mateigel(美国Becton Dickinson)、青/链霉素,RIPA裂解液、BCA法蛋白浓度测定试剂盒(碧云天公司)。
1.2.2 细胞处理[10-11] 取脑胶质瘤细胞,将细胞接种在浓度为10.0%的胎牛血清RMPI-1640培养基中,放置在37℃、浓度为5%的CO2细胞培养箱中培养,待细胞融合80.0%以上时,开始传代培养。培养前去除原培养液,并利用PBS缓冲液连续进行2次漂洗。向获得的溶液中加入浓度为0.25%的胰蛋白酶消化液进行消化,倒置显微镜下观察细胞形态,待细胞回缩、变圆后,将消化液吸出,并加入完全培养液终止消化。利用吸管反复、轻柔吹打培养瓶底,使细胞充分脱离瓶壁。取细胞悬液15 mL放置在离心管中,连续进行8 min离心,离心速度1000 rpm,去除上清液;向获得的细胞悬液中加入完全培养基重悬细胞,以1∶2进行传代培养,每3天换液一次,待细胞融合90.0%时再次传代,取第三代对数生长的细胞,将其随机分装在不同的试管中进行分组。对照组不采取任何措施处理及干预,向细胞中加入培养基进行常规培养,连续完成48 h培养;抑制剂处理组在常规培养24 h后加入SANT1、GANT61处理48 h;乏氧组在收细胞前24 h由常规培养改为低氧(1%O2)培养,连续完成48 h培养;乏氧加抑制剂处理组在低氧培养24 h后加抑制剂处理48 h。各组细胞处理后放置在培养箱中进行培养,培养箱为37℃、5%CO2、饱和湿度[12]。
1.2.3 检测方法 (1)典型基因标志表达:采用Western blot检测各组细胞Smoothened(SMO)、神经胶质瘤相关癌基因同源蛋白1(GLI1)和上皮间质转化(EMT)标志蛋白E-cadherin表达[13]。具体步骤包括:①蛋白质的提取;②蛋白质SDS-PAGE凝胶电泳;③蛋白质转印;④封闭;⑤一抗、二抗孵育;⑥显影。将最终处理后的PVDF膜,以β-actin作为内参物,根据正确的位置、方法放置在发光板(蛋白面板)上,并加入少许发光液,选择合适的曝光条件,完成显影并保存。(2)细胞增殖:采用BrdU-ELISA法检测细胞增殖。取各组干预后12、24、36及48 h的细胞,以20 000/孔培养在96孔细胞培养板中,以梯度浓度CWE完成72 h处理,根据BrdU试剂盒说明,完成细胞的固定、冲洗,加入相应的抗体、洗涤后显色,在微孔板分光光度计上以450 nm波长度数进行测定[14]。(3)细胞侵袭能力:采用Transwell法检测细胞侵袭能力。取各组干预后的细胞,以1×105个/孔的密度接种在24孔板Transwell中,每孔中设置复孔5个,并且在上室加入200 μL DMEM∶F12培养基、下室加入600 μL DMEM∶F12培养基,并在37℃细胞培养箱中连续完成48 h培养,吸取下室中培养液,加入结晶紫染色液100 μL/孔,连续完成10 min染色,染色完毕后采用PBS进行2次洗涤,400倍显微镜下連续统计5个视野的细胞并取平均值[15]。
1.3观察指标
①典型基因表达:记录乏氧加抑制剂处理组、乏氧组、抑制剂处理组、对照组各典型基因的表达水平。②增殖率:记录各组干预后12、24、36及48 h的细胞增殖率。③细胞侵袭率:记录各组细胞干预后12 h的细胞侵袭率。
1.4 统计学分析
数据应用SPSS22.0统计学软件进行分析,计量资料用(x±s)表示,采用t检验;计数资料用[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组典型基因标志表达比较
Westernblot检测结果显示,乏氧加抑制剂处理组SMO、GLI1及EMT相关蛋白E-cadherin表达水平分别为(0.32±0.05)、(0.41±0.08)、(0.35±0.06),低于乏氧组的(0.78±0.12)、(0.80±0.14)、(0.79±0.13),低于抑制剂处理组的(0.57±0.11)、(0.62±0.14)、(0.59±0.12),低于对照组的(0.60±0.13)、(0.69±0.16)、(0.67±0.15),差异有统计学意义(P<0.05);乏氧组SMO、GLI1及EMT相关蛋白E-cadherin表达水平高于抑制剂处理组与对照组,差异有统计学意义(P<0.05)。见表1、图1。
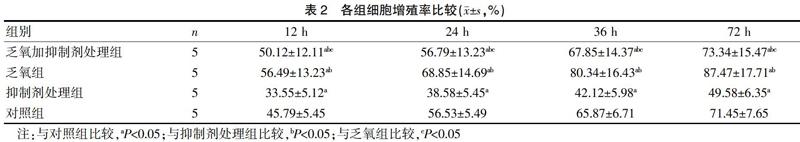
2.2 各组细胞增殖率比较
BrdU-ELISA法结果显示,乏氧加抑制剂处理组不同时间点细胞增殖率低于乏氧组,高于抑制剂处理组与对照组,差异有统计学意义(P<0.05);乏氧组不同时间点细胞增殖率高于抑制剂处理组与对照组,差异有统计学意义(P<0.05)。见表2。
2.3各组细胞侵袭率比较
Transwell法检测结果显示,乏氧加抑制剂处理组细胞侵袭率为(58.56±5.67)%,低于乏氧组的(78.57±6.83)%,但明显高于抑制剂处理组的(27.58±5.31)%与对照组的(37.59±7.21)%,差异有统计学意义(P<0.05);乏氧组细胞侵袭指数高于抑制剂处理组与对照组,差异有统计学意义(P<0.05)。见表3。
3 讨论
脑胶质瘤是由大脑和脊髓胶质细胞癌变产生的、最常见的原发性颅脑恶性肿瘤,其发病率占颅内肿瘤的35.2%~61.0%,主要由胶质细胞演化而来,具有发病率高、复发率高及死亡率高等特点,影响患者的健康和生活。缺氧是脑胶质瘤转移的基本特征,持续的缺氧能促进肿瘤侵袭与转移[16]。而介导缺氧应答的主要转录因子在脑胶质瘤中呈高表达,其表达水平与脑胶质瘤的转移、预后存在相关性[17]。目前,临床对于脑胶质瘤的病因尚未明确,可能与肿瘤本身存在紧密联系,其中主要包括病毒感染、化学、电磁辐射及环境等因素。临床研究显示,HIF-1α/HIF-1β转录复合体的稳定与活化激活下游靶基因,调控脑胶质瘤细胞的增殖、血管生成及上皮间质转化(EMT),能促进肿瘤的转移[18]。本研究中Westernblot检测结果显示,乏氧加抑制剂处理组SMO、GLI1及EMT相关蛋白E-cadherin表达水平低于乏氧组、抑制剂处理组与对照组(P<0.05),乏氧组SMO、GLI1及EMT相关蛋白E-cadherin表达水平高于抑制剂处理组与对照组(P<0.05),说明Hedgehog通路在脑胶质瘤转移中呈高表达,且乏氧状态下肿瘤转移率最高,能加剧肿瘤的转移。Hedgehog通路最早在研究果蝇基因突变时被发现,在脊椎动物中其信号通路成员较多,如膜受体Ptch、配体Hh、Smo及下游转录因子Gli。当配体处于功能状态时,Shh、Ptch结合接触,能抑制Smo受体,从而引起下游转录因子激活,能促进细胞的增殖激活。而当配体处于无功能状态时,Ptch对受体能发挥良好的抑制作用,引起Gli发生水解、失效。因此,激活Hh对配体的发育具有重要的作用。本研究中BrdU-ELISA法的结果显示,乏氧加抑制剂处理组不同时间点细胞增殖率低于乏氧组,高于抑制剂处理组与对照组(P<0.05),说明乏氧能促进脑胶质瘤细胞的增殖,而给予细胞抑制剂,则能在一定程度上抑制细胞的增殖。杨宁等[19]的研究结果显示,N-Shh能刺激脑胶质瘤细胞的侵袭、转移,而Hh信号通路特异性阻断剂的干预可降低细胞的侵袭和转移。本研究中Transwell法检测结果显示,乏氧加抑制剂处理组细胞侵袭率低于乏氧组,但明显高于抑制剂处理组与对照组(P<0.05),乏氧组细胞侵袭率高于抑制剂处理组与对照组(P<0.05),说明乏氧加抑制剂处理能降低脑胶质细胞的侵袭和转移,而乏氧则能促进脑胶质细胞的侵袭。姚军利等[20]的研究显示,阻断Hh信号通路能抑制脑胶质瘤细胞的侵袭,可能与Glil抑制血管内皮生长因子的表达有关,从而抑制肿瘤的侵袭和转移。
综上所述,Hedgehog通路可能通过SMO、GLI1调控EMT,参与疾病的發生、发展,在缺氧诱导脑胶质瘤转移中发挥重要的作用,能为脑胶质瘤转移治疗提供新的靶点。
[参考文献]
[1] 朱宏明.Notch信号通路介导EMT与肿瘤侵袭转移的研究进展[J].肿瘤学杂志,2018,24(8):808-812.
[2] Xue TQ,Jiang SZ,Li MX,et al.The unwanted cell migration in the brain:Glioma metastasis[J].Neurochemical Research,2017,42(4):1-17.
[3] 常亚男,陈红,段洁,等.Hedgehog信号通路拮抗剂GANT61对子宫颈癌裸鼠移植瘤生长的作用及其机制[J].中华妇产科杂志,2018,53(5):331-334.
[4] 李俊东,郝长来.Hedgehoge信号通路在多发性骨髓瘤中的作用[J].国际输血及血液学杂志,2017,40(2):174-177.
[5] Livia G,Noriyuki K,A.Sorana M,et al.A hematogenous route for medulloblastoma leptomeningeal metastases[J].Cell,2018,172(5):1050-1062.
[6] 曹曼卿,高君蓉,黄佳飞,等.缺氧诱导因子2α对含CUB结构域蛋白1的调控及在肝癌转移中的作用[J].中华肿瘤杂志,2017,39(1):18-23.
[7] Suh CH,Kim HS,Jung SC,et al.Diffusion-weighted imaging and diffusion tensor imaging for differentiating high-grade glioma from solitary brain metastasis:A systematic review and meta-analysis[J].American Journal of Neuroradiology,2018,39(7):1208.
[8] 朱江,任梅,許治国.miR-375对缺氧诱导的人视网膜微血管内皮细胞功能的抑制作用及其机制[J].中华实验眼科杂志,2017,35(8):695-702.
[9] Xiang Z Kebin Z,Chunhui L,et al.Nobiletin inhibits invasion via inhibiting AKT/GSK3β/β-catenin signaling pathway in slug-expressing glioma cells[J].Oncology Reports,2017,37(5):2847.
[10] 闫义涛,王晓丽,谷圆圆,等.藏红花素通过HIF-1α/VEGF通路对缺氧诱导的视网膜色素上皮细胞血管新生的抑制作用[J].中国免疫学杂志,2019,(16):1957-1961.
[11] Hiromasa K,Naito K,Tsuyoshi S,et al.Oral squamous cell carcinoma-derived sonic hedgehog promotes angiogenesis[J].Anticancer Research,2017,37(12):6731-6737.
[12] 毛汉丁,程岗,张剑宁.缺氧诱导因子-1α与核转录因子-κB在创伤性脑损伤中的作用及其串联机制综述[J].解放军医学院学报,2019,(4):391-394.
[13] Saud AA,Goutam M,Ram IM.Coadministration of polymeric conjugates of docetaxel and cyclopamine synergistically inhibits orthotopic pancreatic cancer growth and metastasis[J].Pharmaceutical Research,2018,35(1):17.
[14] 霍小东,张洪典,马钊,等.缺氧诱导因子-1α在食管鳞癌上皮-间质转化中的作用及机制[J].中华消化外科杂志,2017,16(1):83-89.
[15] 苏雅珍,张莉芸,马丹,等.Hedgehog信号通路在风湿性疾病中的研究进展[J].中华风湿病学杂志,2018,22(9):636-638.
[16] Renhui Y,Jiugeng F,Shaochun Y,et al.miR-484/MAP2/c-Myc-positive regulatory loop in glioma promotes tumor-initiating properties through ERK1/2 signaling[J].Journal of Molecular Histology,2018,49(2):1-10.
[17] 马义丽,王乐,李明霞.缺氧诱导因子1α及血管内皮生长因子在新生大鼠缺氧性肺动脉高压发病机制中的作用[J].中国新生儿科杂志,2017,32(1):64-68.
[18] Shan Y,Kong W,Zhu A,et al.Long noncoding RNA CCAL promotes gastric cancer cell proliferation and migration in a myc dependent way[J].Pharmazie,2018,73(1):42-48.
[19] 杨宁,路强,袁梦克,等.黄芩素对缺氧诱导的视网膜神经胶质细胞中脯氨酸羟化酶2表达的抑制作用[J].中华实验眼科杂志,2017,35(11):990-996.
[20] 姚军利,刘苏,吕游,等.脊髓神经元sonichedgehog信号通路在小鼠吗啡耐受中的作用[J].中华麻醉学杂志,2017,37(2):175-179.
(收稿日期:2019-12-09)

