LC/MS/MS法测定柚皮苷在大鼠血浆中的浓度及其药代动力学研究
郭俐麟 唐冰雯
摘 要:目的:建立LC/MS/MS法测定大鼠血浆中柚皮苷浓度,并考查其药代动力学特征。方法:采用Sepax HP-C18色谱柱:(100 mm×2.1 mm,5 μm),以甲醇-2 mmol·L-1醋酸铵溶液(65:35)为流动相;流速:0.3 ml·min-1。离子源为ESI源,正离子模式进行检测。结果:大鼠静脉注射给药柚皮苷后,血浆中可以迅速检测到大量的柚皮苷与少量的代谢产物柚皮素。柚皮苷的Tmax为0.083 h,达峰浓度Cmax为56583.33 ng·ml-1;柚皮素葡萄糖醛酸结合物的Tmax为12 h,达峰浓度Cmax为653.68 ng·ml-1。结论:该方法选择性强、灵敏度好,可用于测定大鼠生物样本中柚皮苷及其代谢产物柚皮素的浓度。
关键词:柚皮苷;柚皮素;LC/MS/MS;药代动力学
Abstract Objective:To establish a LC/MS/MS method for the determination and pharmacokinetic study of naringin in rats plasma.Method:A Sepax HP-C18 column was used,with the mobile phase of methanol-2 mmol·L-1 ammonium acetate(65:35).The flow rate:0.3 ml·min-1.The determination used electrospray ionization mass spectrometry with positive ionization mode.Results:After intravenous administration the naringin,in blood,we can rapidly determine many naringin and a little naringenin in vivo.Tmax of naringin is 0.083 h,Cmax is 56583.33 ng·ml-1;Tmax of naringenin glucuronides is 12 h,Cmax is 653.68 ng·ml-1.Conclution:The method is selective and sensitive and can be used to determine the concentration of naringin and its metabolite(naringenin).
Key words:naringin;naringenin;LC/MS/MS;pharmacokinetics
柚皮苷属于二氢黄酮苷,主要存在于柚、葡萄柚和酸橙及其变种的果皮及果实中,研究表明其具有抗氧化[1][2]、抑菌[3]、抗癌[4][5]等作用,柚皮苷作为一类重要的中药化学成分,由于它的功效显著,具有良好的开发前景,对其的研究也愈来愈热,对它的吸收和代谢等的药代动力学研究必将愈加深入,药代动力学方法学研究是药代动力学研究的基石,然而柚皮苷在药代动力学及其方法学方面的研究报道较少[6],多数采用高效液相色谱法进行研究,其灵敏度不够高,分析时间长。采用LC/MS/MS法对其进行定性和定量分析,可提高灵敏度,缩短分析时间,提高了工作效率,这对全面进行柚皮苷药代动力学研究发挥了厚积薄发的作用,进而对于了解柚皮苷的作用机制,指导临床合理用药、优选用药方案、指导柚皮苷剂型改革和新药研究设计都具有重要的意义。
1 仪器、试药
1.1 仪器
美国应用生物系統公司(AB)API 3000 型号LC/MS/MS 液质联用串联四极杆质谱仪,包括电喷雾离子化源(ESI),大气压化学离子化源(APCI),岛津Shimadzu LC-10 ADVP 双高压梯度洗脱装置、DGM-12 AM 在线脱气机,并配有直接进样用针泵及1 ml进样器以及AB公司ANALYST 1.3 数据处理软件;Shimadzu ΜV-2501 PC 紫外分光光度计、日本岛津Shimadzu LC-Vp series 高效液相仪系统;上海安亭科学仪器厂TGL-16G 离心机;组织匀浆器;上海沪西分析仪器厂WH-3 涡旋混合仪;分析天平(Mettler Toledo,AG 135)
1.2 试药
对照品柚皮苷(批号:110722-200708,中国生物制品检定所);对照品柚皮素(批号:09020121,上海同田生物技术有限公司);橙皮苷(批号:110721-200512,中国生物制品检定所);
甲醇(色谱纯,美国Fisher公司);醋酸铵(色谱纯,美国TEDIA公司);纯化水;乙酸乙酯(分析纯)
2 动物与给药方式
SD 大鼠(SPF级,动物合格证号为SCXK(粤)2003-0002,粤监证字2006A015)20只,雌雄各半,体重300±20 g。SD 大鼠10只,分为2组,实验前一天禁食12 h,自由饮水,按45mg/kg剂量给药,静脉注射给药柚皮苷原料,于预定的时间点(0 min,5 min,10 min,15 min,30 min,35 min,45 min,1 h,2 h,4 h,6 h,8 h,10 h,12 h,24 h)大鼠眼眶取血。
3 检测条件
3.1 色谱条件 色谱柱:Sepax HP-C18(100 mm×2.1 mm,5 μm),预柱:菲罗门;流动相:甲醇:2mmol·L-1醋酸铵(65:35);流速:0.3 ml·min-1;柱温:室温;进样体积:20 μl。
3.2 质谱条件 离子源:电喷雾离子化源(ESI);扫描方式:正离子多反应离子监测;鞘气,碰撞气,辅助气均为氮气;解离电压:58 V;聚焦电压:380 V;入口电压:26 V;碰撞池入口电压:8 V;电喷雾电压:5000 V;辅助气温度:360 ℃;雾化气:8;门帘气:10;碰撞气:7;多反应离子监测:柚皮苷:581.3/273.3,碰撞能8 V,扫描时间200 ms;柚皮素:273.4/153.1,碰撞能6 V,扫描时间200 ms;橙皮苷(内标):611.1/303.3,碰撞能:12 V,扫描时间:200 ms。采用DAS 2.0药代动力学软件,用统计距计算药物代谢动力学参数。
4 方法和结果
4.1 储备液的配制
柚皮苷标准储备液:称取105 ℃干燥至恒重的柚皮苷对照品约10 mg,精密称定,置于50 ml容量瓶中,用甲醇溶解定容,配制成浓度为200 μg·ml-1标准储备液。
柚皮素标准储备液:称取105 ℃干燥至恒重的柚皮素对照品约10 mg,精密称定,置于50 ml容量瓶中,用甲醇溶解定容,配制成浓度为200 μg·ml-1的标准储备液。
内标标准储备液:称取橙皮苷对照品10 mg,精密称定,置于50 ml容量瓶中,用甲醇定容,配制成浓度为200 μg·ml-1的溶液作标准储备液。
4.2 生物样品的制备
4.2.1 血浆样品的制备
大鼠眼眶取血,置1.5 ml肝素处理的塑料离心管中,6000 rpm离心10 min;分取血浆,置冰箱中-20℃保存;供测定用。
4.3 生物样品的处理方法
4.3.1 血浆或组织样品处理方法
取动物血样100 μl,置1.5 ml离心管中,加入5 μg·ml-1内标橙皮苷对照品溶液10 μl,涡旋混合仪上涡旋30s,加入700 μl乙酸乙酯进行萃取,涡旋2 min,离心机上9000 r/m离心10 min,取上清液,室温下挥干溶剂。残渣用流动相(甲醇:2mmol醋酸铵=65:35)100 μl重溶,进样20 μl。
4.3.2 酶解的处理方法
取血样100 μl,置1.5 ml离心管中,加入10 μl酶(β-葡萄糖苷酸酶),37 ℃水浴1小时,取出,加入内标溶液10 μl,其余操作同4.3.1。
4.4 方法学考察
4.4.1 方法专属性
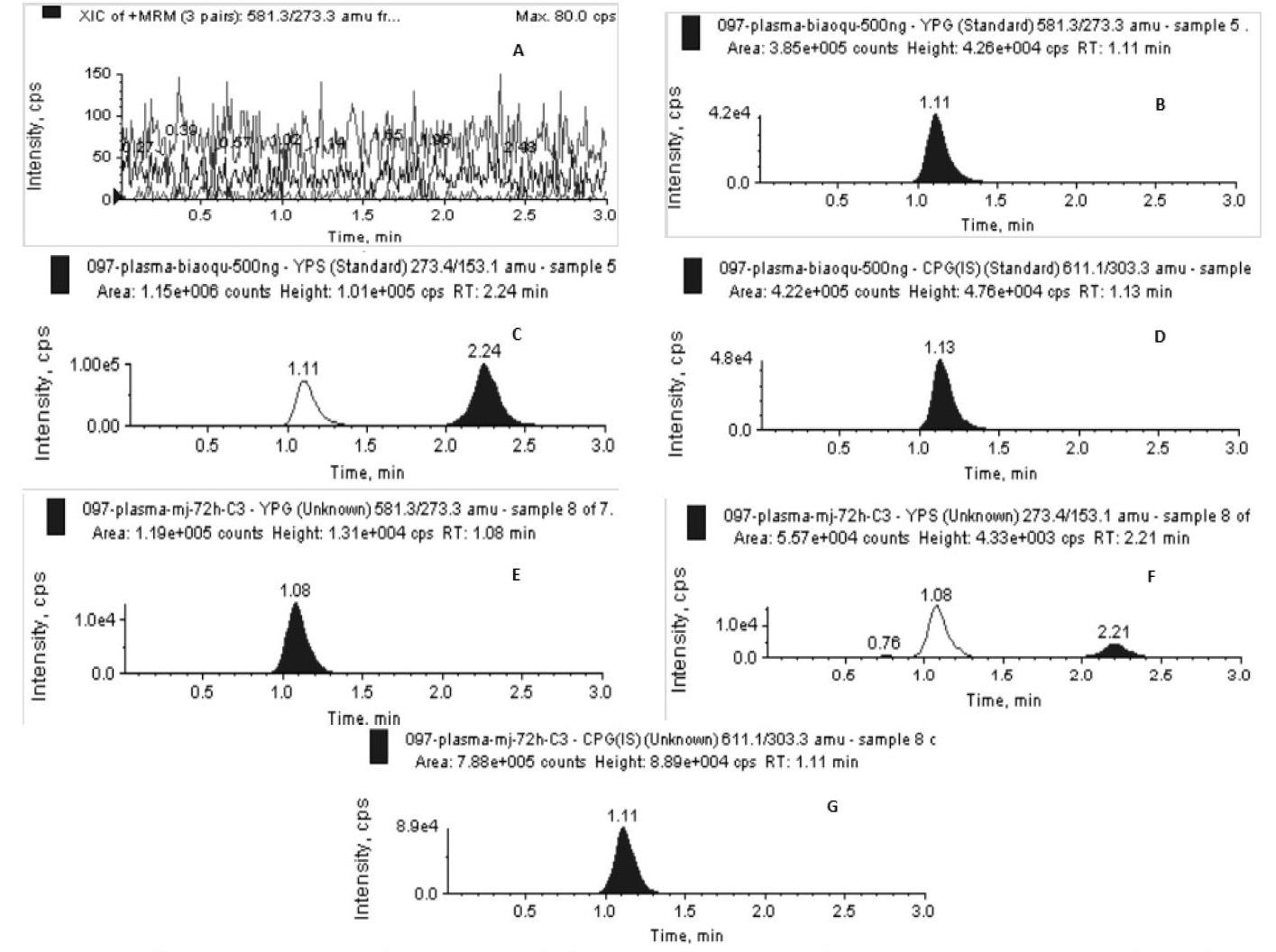
按生物样品预处理方法进行考察,考察6只不同动物个体空白样本,比较空白血浆、加入内标和对照品的血浆以及给药后的某一时间点血样的色谱图,确定方法的专属性。结果见图1,结果表明:空白血浆不干扰待测物及内标的测定。
4.4.2 灵敏度考察
将浓度为100 ng·ml-1柚皮苷标准溶液、柚皮素标准溶液进行稀释,按4.3.1分别制成血浆样品进行液质检测,当峰高为噪音的3倍(S/N=3),得到柚皮苷檢测限为0.5 ng·ml-1。柚皮素检测限为0.5 ng·ml-1。
4.4.3 标准曲线与线性范围
按4.3.1项下操作,制成血浆中柚皮苷和柚皮素浓度分别为:10 ng·ml-1、50 ng·ml-1、100 ng·ml-1、500 ng·ml-1、1000 ng·ml-1、2500 ng·ml-1的血浆样品。用液质联用仪正离子MRM方式进行检测,每个样品进样20μl。以柚皮苷与内标的峰面积比和血浆样品中柚皮苷浓度进行线性回归,即得标准曲线方程和线性范围,标准曲线方程为:Y=0.0016X+0.00672(r=0.9992),以柚皮素与内标的峰面积比和血浆样品中柚皮素浓度进行线性回归,即得标准曲线方程和线性范围,标准曲线方程为:Y=0.0015X+0.0083(r=0.9948),柚皮苷在10 ng·ml-1~2500 ng·ml-1浓度范围内线性关系良好,柚皮素在10 ng·ml-1~2500 ng·ml-1浓度范围内线性关系良好。
4.4.4 精密度、准确度试验
按4.3.1项下操作,制备柚皮苷(2000 ng·ml-1,800 ng·ml-1,20 ng·ml-1)和柚皮素(2000 ng·ml-1,800 ng·ml-1,20 ng·ml-1)高、中、低三个浓度生物样品,用液质检测(n=5),求得测定浓度值与平均值,计算RSD%,为日内精密度,每天进样一次,共三天,计算RSD%,为日间精密度。柚皮苷日内精密度RSD为4.76%、8.84%、5.99%,柚皮苷日间精密度RSD为2.88%、0.70%、4.37%;柚皮素日内精密度RSD为3.48%、6.80%、2.12%,柚皮素日间精密度RSD为5.23%、3.72%、3.51%。结果表明,柚皮苷、柚皮素日内和日间精密度良好。
4.4.5提取回收率
按4.3.1项下操作,制备柚皮苷(2000 ng·ml-1,800 ng·ml-1,20 ng·ml-1)和柚皮素(2000 ng·ml-1,800 ng·ml-1,20 ng·ml-1)高、中、低三个浓度生物样品,每个浓度5个样本。量取20 μl,注入LC/MS/MS,记录质谱图。
另取1.5 ml塑料离心管,分别加入相应的柚皮苷和柚皮素标准溶液用流动相稀释,制成相应浓度的标准溶液样品,记录质谱图。按公式计算,分别求出柚皮苷和柚皮素提取回收率和RSD值。结果显示柚皮苷高、中、低3个浓度提取回收率分别为40.2%、43.1%、41.6%,RSD为3.55%、4.62%、6.14%。柚皮素高、中、低3个浓度提取回收率分别为61.6%、64.2%、74.0%,RSD为3.01%、2.20%、7.96%。
4.4.6方法回收率试验
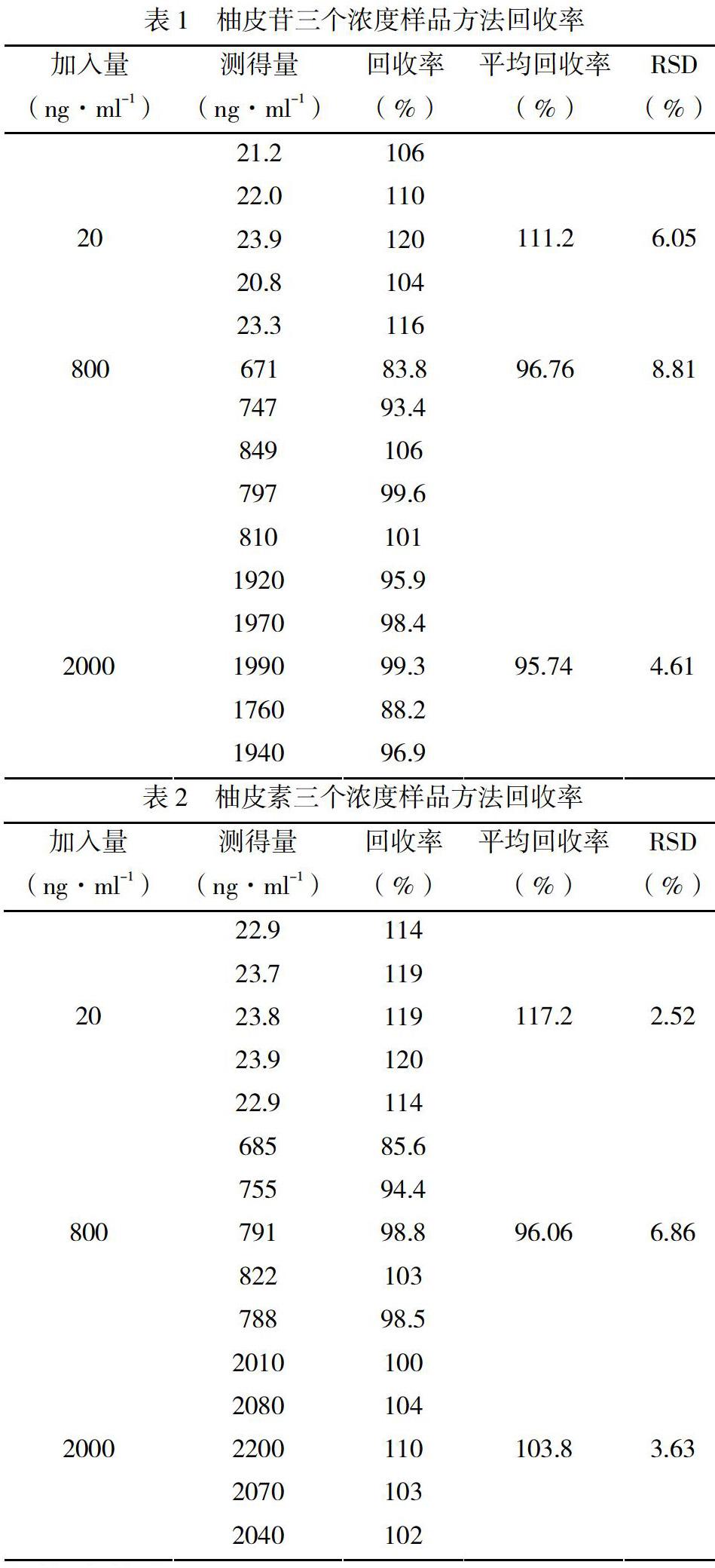
按4.3.1项下操作,制备柚皮苷(2000 ng·ml-1,800 ng·ml-1,20 ng·ml-1)和柚皮素(2000 ng·ml-1,800 ng·ml-1,20 ng·ml-1)高、中、低三个浓度生物样品,每个浓度5个样本。用液质进行检测,测得信号值代入回归方程,求得测定值。以测得浓度与加入量比较,计算高、中、低3个浓度的方法回收率,结果见表1、表2:
4.4.7 稳定性试验
按4.3.1项下操作,制备浓度分别为20ng·ml-1、800ng·ml-1、2000ng·ml-1的血浆样品,考察室温放置4 h,-20℃冻融2次(每次间隔24 h),-20℃放置10 d,20 d,30 d后,样品处理后的稳定性(n=3),柚皮苷生物样品室温稳定性RSD为7.43%、5.52%、3.38%。柚皮素生物样品室温稳定性RSD为0.85%、1.15%、1.37。柚皮苷生物样品冻融稳定性RSD为13.45%、8.54%、0.80%。柚皮素生物样品冻融稳定性RSD为1.05%、2.85%、4.55%。柚皮苷在-20℃放置10 d,20 d,30 d的稳定性RSD为9.76%、5.68%、9.45%。柚皮素在-20℃放置10 d,20 d,30 d的稳定性RSD为9.63%、6.62%、6.77%。结果表明:含药生物样品于室温放置4 h、于-20℃下反复冻融2次后、于-20℃放置30天稳定性良好。
4.4.7 血浆样品测定
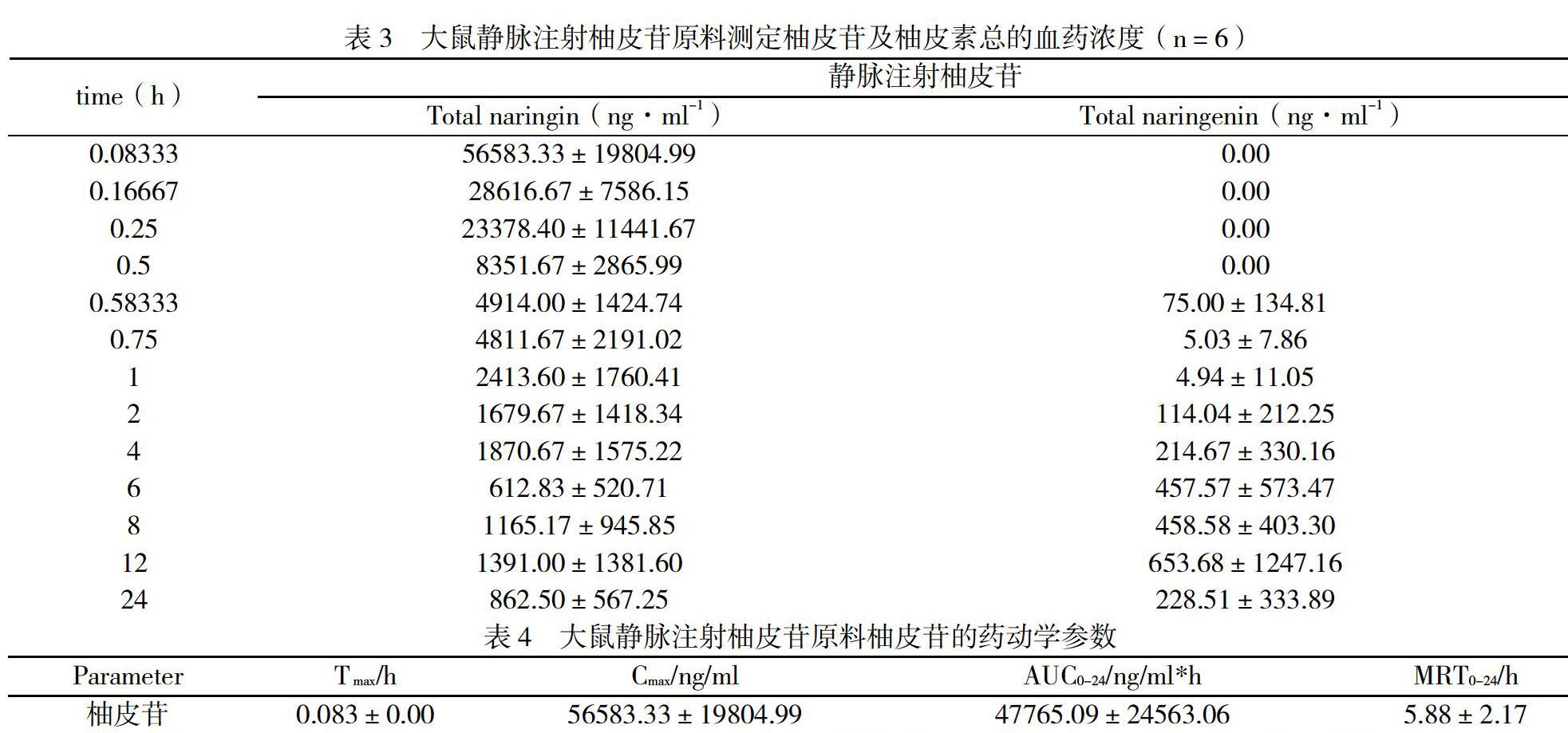
本试验根据药效试验所用剂量,在安全、有效的剂量范围内,设计了大鼠静脉注射给药柚皮苷 45 mg·kg-1,于给药后预定时间点取血,按4.3.1项下操作,制备血浆样品并进行测定,测定结果用DAS 2.0软件的统计距进行计算。结果见表3,表4,图2。
结果表明,大鼠静脉注射柚皮苷原料后,在大鼠体内迅速检测到柚皮苷,其达峰时间Tmax为5 min,达峰浓度Cmax为56583.33 ng·ml-1,达峰后血药浓度迅速下降。可检测到少量的游离和葡萄糖醛酸结合物形式存在的柚皮苷代谢产物柚皮素,其柚皮素结合物的达峰时间Tmax为12 h,达峰濃度Cmax为653.68ng·ml-1。可见柚皮苷在大鼠体内可部分转化为代谢产物柚皮素,且主要是以葡萄糖醛酸结合物形式存在。
5 讨论
本研究在方法学考察中分别考察了甲醇和水、甲醇和0.1%甲酸、甲醇和醋酸铵的混合溶液等几种流动相,结果表明流动相为甲醇:醋酸铵(2 mmol·L-1)=65:35时,柚皮苷、柚皮素在液质上可达到基线分离,且在此条件下离子对较为稳定,信号强度较高,峰形较好。
研究表明乙酸乙酯对黄酮类化合物的提取较理想,柚皮苷和柚皮素属于二氢黄酮苷,本研究根据二者的理化性质,选择乙酸乙酯作提取溶剂,并对文献报道的方法进行了改进,将多次提取改为单次大体积提取,此法简单易行,提取率稳定,能满足体内低浓度药物的测定和药代动力学研究。
本研究曾使用了甲醇蛋白沉淀法,发生信号抑制,无离子对信号,基质干扰严重。还尝试了乙酸乙酯提取前加入饱和NaCO3,饱和NH4Ac,0.1 mol·ml-1HCl进行盐析处理,使用乙酸乙酯:正丁醇(1:1),乙酸乙酯:正丁醇(1:2),乙酸乙酯:正丁醇(95:5),乙酸乙酯:异丙醇(95:5)混合溶剂进行提取,均未得到改善提取率的效果,与其它样品前处理方法(如:蛋白沉淀法等)相比,该液-液提取法给LC/MS/MS分析带来的基质效应(matrix effects)干扰相对较少。
从药时曲线可以看出,静脉注射柚皮苷原料后在大鼠体内并非大部分转化为柚皮素,大部分仍然以柚皮苷的形式存在。静脉注射柚皮苷原料后,柚皮苷的血药浓度5 min达峰,消除很快,而代谢产物柚皮素主要是以葡糖醛酸结合物形式存在,几乎测不到游离的柚皮素,柚皮素葡萄糖醛酸结合物的血药浓度12 h达峰。
参考文献
[1] Nzuza S,Ndwandwe DE,Owira PMO.Naringin protects against HIV-1 protease inhibitors-induced pancreatic β-cell dysfunction and apoptosis[J].Molecular & Cellular Endocrinology,2016,437:1-10.
[2] Ren X,Shi Y,Zhao D,et al.Naringin protects ultraviolet B-induced skin damage by regulation p38 MAPK signal pathway[J].Journal of Dermatological Science,2016,82(2)106-14.
[3] Yi ZB,Yu Y,Lian YZ,et al.In vitro antioxidant and antimicrobial activities of the extract of pericarpium citri reticulatae of a new citrus cultivar and its main flavonoids[J].LWT-Food Science and Technology,2008,41(4):597-603.
[4] Yoshinaga A,Kajiya N,Oishi K,et al.NEU3 inhibitory effect of narigin suppresses cancer cell growth by attenuation of EGFR signaling through GM3 ganglioside accumulation[J].Eur J Pharmacol,2016,5(782):21-29.
[5] Zeng L,Zhen Y,Chen Y,et al. Narigin inhibits growth and induces apoptosis by a mechanism dependent on reduced activation of NF-kB/COX 2-caspase-1 pathway in HeLa cervical cancer cells[J].International Journal of Oncology,2014,45(5):1929-36.
[6] 曾令軍,陈丹,郑利,等.玳玳黄酮提取物特征活性成分不同生理状态的药动学特性比较[J].中国中药杂志,2014,39(2):309-315.
第一作者简介:郭俐麟,硕士研究生,从事药物分析研究。

