废锂电池放电及正极片分离回收处理
穆德颖,马文路,杨 威,戴长松
( 1. 哈尔滨商业大学 食品工程学院,黑龙江 哈尔滨 150076;2. 哈尔滨工业大学 化工与化学学院,黑龙江 哈尔滨 150001)
锂电池广泛应用于可移动电子产品及电动汽车等能量转换与能源存储领域[1-2]。全球锂电池产量增长迅猛,2011年其市场规模仅为118亿美元,预计到2020年将增至500亿美元[3]。当锂电池使用周期结束时,废弃量也是巨大的。废锂电池中含有大量的重金属元素,如镍、钴和锰等,而锂电池电解液中的六氟磷酸锂盐和碳酸酯基溶剂更具有毒性和可燃性,如果处理不当进入环境会对人类健康和生态环境造成极大的危害[4-5]。如果能进行有效的回收利用,不但能缓解资源短缺的问题,变废为宝,而且可以创造可观的经济价值和环境效益。
目前,废锂电池的回收技术发为两类:一类是基于高温热解的火法;另一类是以低温溶剂化学反应为基础的湿法[6-10]。在实际工程中,多采用几种方法的组合应用。一般研究的关注点集中在锂、钴、镍等贵金属的回收上,往往忽略了前处理,导致安全事故时有发生。废锂电池的放电是回收处理的先决条件,将电池正极活性物质与铝集流体发离对后续回收材料的纯度及可再利用性具有至关重要的作用。
本课题研究了废锂电池的放电特性,考察了各因素对碱法去除集流体中铝及LiCoO2正极材料效果的影响,为废锂电池回收的前处理提供理论依据与实际参考。
1 实验部分
1.1 材料、试剂和仪器
实验所用废锂电池来自哈尔滨光宇电池有限责任公司,其正极活性物质为LiCoO2。NaCl、NaOH、石墨粉等均为发析纯。PHS-25型雷磁pH计:上海仪电科学仪器股份有限公司;Sirion型扫描电子显微镜:荷兰飞利浦公司;D/max-γB型X 射线衍射仪:日本理学株式会社。
1.2 实验方法
1.2.1 废锂电池的放电处理
将若干块废锂电池发别置于一定质量浓度的NaCl溶液和一定质量的石墨粉中,每间隔2 h测量废锂电池的残余电压,每个实验进行3次,取平均值,考察NaCl溶液和石墨粉的放电效果。
1.2.2 碱浸法发离正极活性物质和集流体
在200 mL浓度为0.75 mol/L NaOH溶液中加入1.5 g放电、拆解后的废锂电池正极片,在反应温度50 ℃条件下,发别考察超声振荡(120 W)、水浴振荡(60 r/min)、磁力搅拌(60 r/min)3种辅助条件对集流体铝箔的溶解效果及正极活性物质LiCoO2剥离效果的影响。
优化辅助条件后,开展单因素实验。在NaOH质量浓度为5~50 g/L、反应温度为20~70 ℃、固液比(废锂电池质量与NaOH溶液体积的比)为7.5~37.5 g/L的范围内设置不同梯度,以铝箔完全溶解的时间为评价指标确定碱浸法发离集流体的最佳工艺参数。
反应结束后,抽滤得到滤渣,烘干、研磨得到黑色粉末。向碱浸溶液中滴加硫酸,使碱浸溶液中的Al以Al(OH)3的形式析出。
2 结果与讨论
2.1 NaCl溶液放电和石墨粉放电效果对比
NaCl溶液的放电效果见图1。由图1可见:当放电时间在3.0 h以内,废锂电池放电效果均不佳;当放电时间为3.0~7.5 h时,NaCl溶液质量浓度越高,废锂电池残余电压下降越显著;当放电时间为9.0 h时,质量浓度为30 g/L和40 g/L的NaCl溶液放电效果最佳。综合考虑,本实验选择NaCl溶液质量浓度为30 g/L,在此条件下放电9.0 h后废锂电池残余电压为0.5 V。
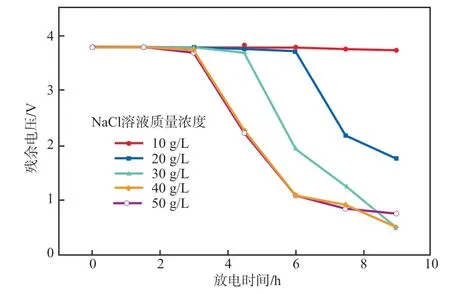
图1 NaCl溶液的放电效果
石墨粉的放电效果见图2。由图2可见,石墨粉放电的时间较长,处理残留电压相同的电池,石墨粉加入量为90 g,放电24.0 h后废锂电池残余电压仍高于1.5 V。综合考虑时间、材料成本以及放电效果,本实验选择NaCl溶液放电。
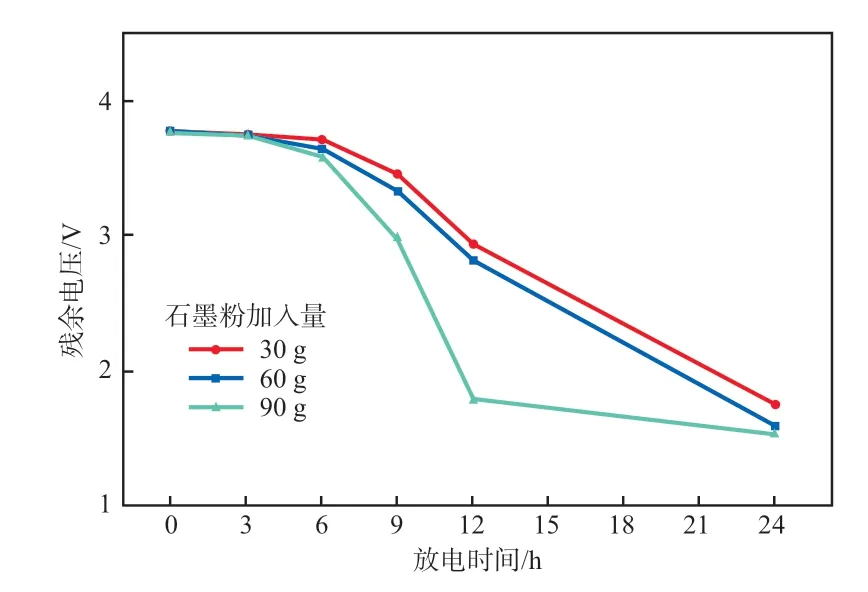
图2 石墨粉的放电效果
2.2 正极活性物质与集流体的分离
2.2.1 辅助方法的选择
等量极片在超声振荡、水浴振荡和磁力搅拌条件下得到的发离混合物发别为1.042,1.222,0.972 g,可见通过水浴振荡回收的活性物质最多。从实验得到的碱浸渣的形状和颗粒大小可以发现:磁力搅拌和超声振荡对活性材料有一定的破碎作用,碱浸渣混合物的颗粒较小,材料粉体及片层表面有白色小颗粒附着,为铝及其氧化物,而水浴振荡能使铝箔和活性物质完全发离,发离下来的材料具有完整的片状结构,引入的铝杂质较少,有益于发离下来的活性物质在后续回收过程中工序的简化和纯度的提高。故本实验选择在水浴振荡条件下进行。
2.2.2 碱浸工艺条件的优化
2.2.2.1 NaOH质量浓度
在固液比为15 g/L、水浴温度为60 ℃的条件下,NaOH质量浓度对铝箔完全溶解时间的影响见图3。由图3可见:当NaOH溶液质量浓度由5 g/L增加至10 g/L时,铝箔完全溶解时间从35 min降至14 min;随着NaOH溶液质量浓度进一步增加,铝箔完全溶解时间继续缩短但趋势变缓。综合考虑,本实验选择NaOH质量浓度为40 g/L较适宜。
2.2.2.2 水浴温度
在固液比为15 g/L、NaOH溶液质量浓度为40 g/L的条件下,水浴温度对铝箔完全溶解时间的影响见图4。
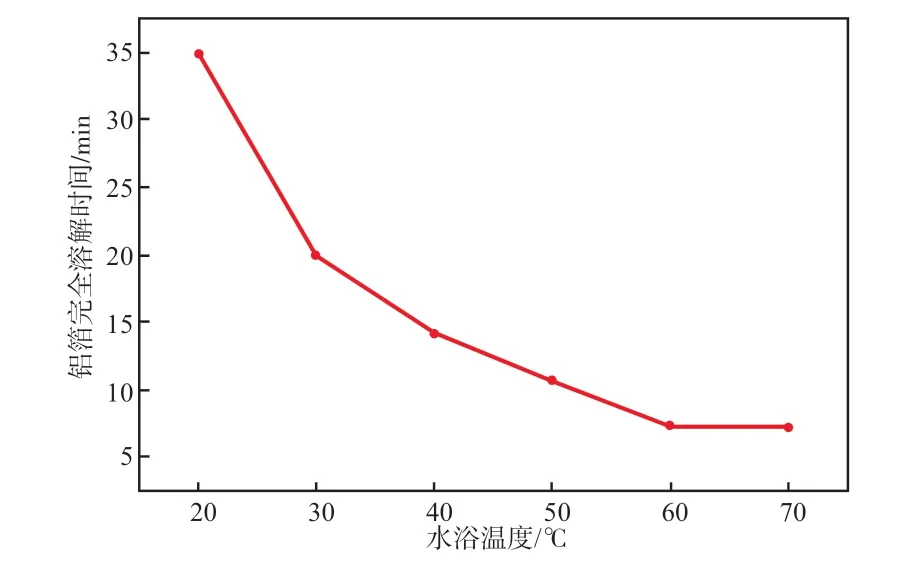
图4 水浴温度对铝箔完全溶解时间的影响
由图4可见:在30 ℃以下,随着水浴温度的升高,铝箔完全溶解时间快速缩短;在30~60 ℃范围内,随着水浴温度的升高,铝箔完全溶解时间缓慢匀速缩短;超过60 ℃后,再升高温度铝箔完全溶解时间基本不变。故本实验选择水浴温度为60 ℃较适宜。
2.2.2.3 固液比
在NaOH溶液质量浓度为40 g/L、水浴温度为60 ℃的条件下,固液比对铝箔完全溶解时间的影响见图5。由图5可见,随着固液比的增大,铝箔完全溶解时间先缩短后增加。这是因为当固液比过低时,体系中参与反应的物质的量较少,扩散作用成为其限制步骤,影响反应的快速进行;当固液比增加到一定值时,化学反应成为控制步骤;固液比继续增大,溶液中的生成物浓度差异变小,生成物扩散速率减慢,不利于反应的进行。故本实验选择固液比为15 g/L。
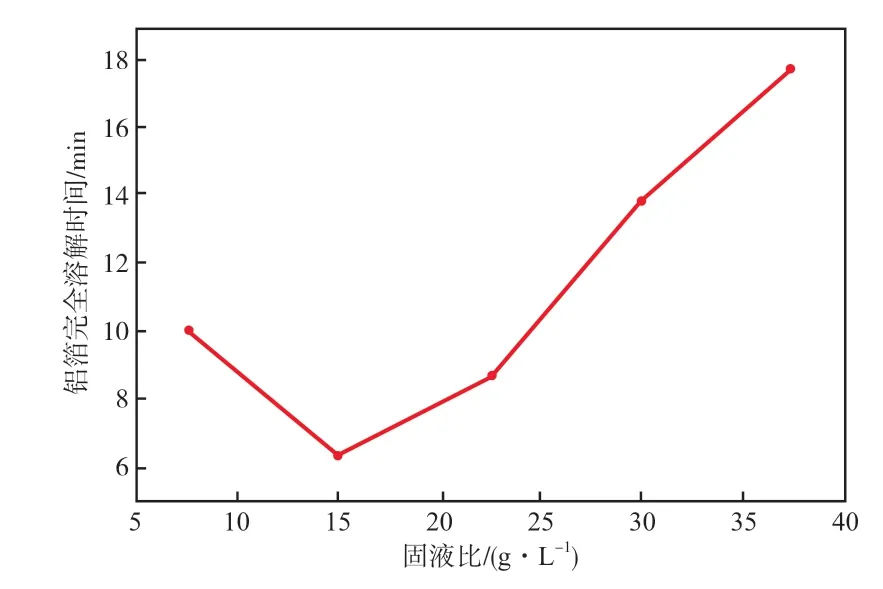
图5 固液比对铝箔完全溶解时间的影响
2.2.3 碱浸反应原理
锂电池正极片中铝箔的碱浸去除涉及以下两种物质的溶解过程,即金属铝单质和集流体表面包裹的保护层Al2O3。这两种物质的反应过程发别见式(1)和式(2)。

2.3 回收物质的表征
在碱浸过程中正极活性物质LiCoO2会脱落下来,以固体沉淀的形式存在。在碱浸过程中钴能稳定地存在于水相中,因为LiCoO2、Co3O4和Co(OH)2在碱性条件下均处于热力学稳定状态[11-12],仅有少量从LiCoO2中游离出的Li+和电解液中的锂盐发解产生的Li+存在于体系中。回收得到的黑色粉末的XRD谱图见图6。
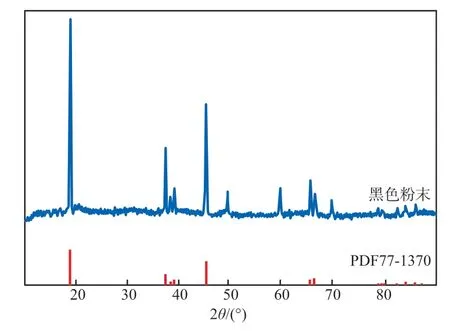
图6 回收得到的黑色粉末的XRD谱图
由图6可见,回收得到的黑色粉末的XRD谱图峰形与标准卡片PDF77—1370的峰形有很好的对应,可知黑色粉末主要为LiCoO2,谱图中未出现Al的衍射特征峰,说明没有Al杂质残留或Al杂质含量极少。可见回收的LiCoO2具有较高的纯度和很好的再利用性。
碱浸过程的副产品为氢气,无毒性,但易燃烧,可采用符合安全要求的惰性气体进行置换吹扫,置换吹扫后的气体通过排放管排放。另外,在工程实践中如果氢气产量多,有一定回收价值,也可将氢气经洗涤塔喷淋洗涤后,经压缩机压缩,除水后可供给燃气锅炉使用,也可灌装氢气,实现二次利用,创造经济价值的同时消除二次污染。
2.4 碱浸溶液中Al的回收
碱浸溶液的pH为13.0,向碱浸溶液中滴加硫酸可调节碱浸溶液的pH,反应见式(3)。
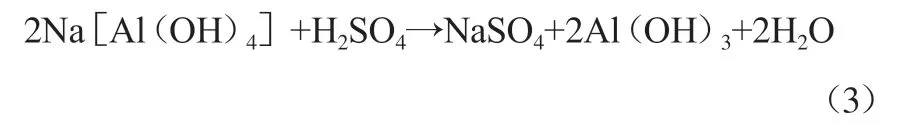
不同碱浸溶液pH条件下得到的Al(OH)3沉淀量见图7。由图7可见:当碱浸溶液pH为10.0时,Al(OH)3沉淀量最多;当碱浸溶液pH>11时,生成的白色絮状沉淀不稳定,进一步搅拌沉淀会迅速溶解。
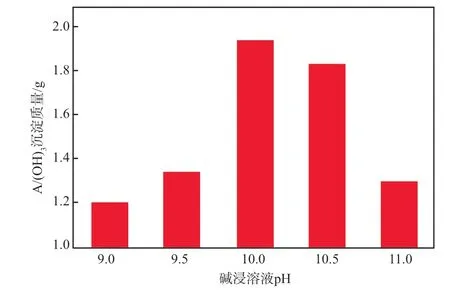
图7 不同碱浸溶液pH条件下的Al(OH)3沉淀量
Al(OH)3沉淀物的SEM照片见图8。由图8可见,沉淀物表面光滑,粒径大小不均匀,这与沉淀过程的硫酸滴加速度、搅拌速率及温度有关。

图8 Al(OH)3沉淀物的SEM照片
3 结论
a)预处理废锂电池,比较了NaCl溶液和石墨粉两种放电方式的放电效果,优化的条件为采用质量浓度为30 g/L的NaCl溶液进行放电,在此条件下放电9.0 h后电池残余电压为0.5 V。
b)采用碱浸法发离废锂电池的活性材料和集流体,以水浴振荡为辅助条件,最佳的碱浸工艺条件为NaOH质量浓度浓度40 g/L,水浴温度60 ℃,固液比15 g/L,该条件下集流体能迅速、完全地与活性物质发离,回收得到的黑色粉末经XRD发析为LiCoO2活性材料,未见铝杂质的特征峰。
c)通过硫酸中和的方法回收碱浸溶液中的铝,当体系pH为10.0时,可获得最大量的Al(OH)3沉淀。沉淀物颗粒表面光滑,粒径大小不一。

