Adk1过表达和柠檬酸钠补料促进酵母S-腺苷甲硫氨酸的合成
陈海龙, 蒋丽华, 陈帅, 张晓戈, 朱年青, 韦平和*, 周长林
(1.泰州学院, 江苏手性医药化学品省高校重点建设实验室, 江苏 泰州 225300;2.中国药科大学生命科学与技术学院, 南京 210009)
S-腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM)是重要生理活性物质。它作为甲基供体、丙氨基供体及巯基化合物前体等参与体内众多生化反应,如核酸、蛋白质、磷脂质、神经递质和维生素等的合成,半胱氨酸、谷胱甘肽、多胺以及辅酶A和牛磺酸等含硫化合物的相互转化[1-3],常被用于肝炎、原发胆汁性肝硬化、酒精造成的肝损伤等疾病的防治,同时SAM还是抗衰老高级保健药品[4-7]。在植物体内,SAM还参与乙烯、甜菜碱以及木质素的合成和代谢过程[8-9],在植物生长发育、新陈代谢及逆境胁迫响应过程中都发挥重要作用,如SAM处理黄瓜扦插苗可促进根系生长发育、叶绿素积累、光合速率增强,增加下胚轴内生长素和多胺的积累及其相关基因的表达[10]。
微生物发酵法因其底物转化率高及产物纯度高等优点而成为获取SAM的重要途径,一直倍受关注[3-4]。微生物合成SAM的研究集中在以下几个方面[1, 2, 5]:①通过菌种诱变选育和发酵过程优化;②利用基因工程技术改善SAM合成酶的活性;③敲除胱硫醚-β合成酶基因提高胞内前体甲硫氨酸(Met)水平;④通过异源酶引入或关键酶重组等方法来解除胞内大量积累的SAM对SAM合成酶(SAMS)和甲叉四氢叶酸还原酶的反馈抑制作用;⑤通过ATP代谢调控提高胞内ATP水平等。酵母属微生物很多基因与SAM合成和积累有关,如SAM1、SAM2、MET13、MET6、CYS4等[2-6]。但微生物生物合成和积累SAM的能力尚未得到充分发掘,SAM积累量并未得到突破,其工业化生产尚存在一些问题:如发酵过程中,随着外源甲硫氨酸流加到发酵液中,SAM生产成本增加,且发酵液中大量Met存在会抑制Met透性酶基因MUP1及SAM合成酶基因SAM2的表达;胞内调控SAM合成与积累的机制并未阐明,胞内ATP水平限制SAM的合成,SAM在胞内大量积累后引起反馈抑制作用等[11-12]。
在生物体内,SAM在S-腺苷甲硫氨酸合成酶(SAMS)催化下将ATP腺苷基团转移给Met而合成,会消耗酵母细胞内ATP[1]。因此,酵母胞内ATP的水平是限制胞内SAM合成的因素之一[13]。在前体氨基酸充分情况下,向酵母发酵液中添加适量ATP可以改善SAM的合成与积累,但ATP价格昂贵,通过ATP补料策略改善SAM发酵工艺难以实现。Wang等[14]发现,通过添加具有ATP导向作用的氨基酸能够改善胞内ATP水平,从而增加SAM的积累量。顾振霆等[15]对E.coli的腺嘌呤补救途径进行系统研究,敲除E.coli腺苷脱氨酶基因add、AMP核苷酶基因amn和嘌呤核苷磷酸酶基因deoD并引入酵母腺苷酸激酶基因Adk1,结果发现,工程菌胞内AMP、ADP和ATP的水平均得到显著改善。关于利用微生物细胞内ATP代谢调控来直接生产ATP或将ATP利用到一些药用化学物分子的生物合成研究也已成为热点问题。这些研究大多集中在基于腺嘌呤补救途径相关基因的调控来提高ATP的供给最终实现目的产物积累量的提高。
酿酒酵母腺苷酸激酶ADK1,由Adk1基因编码,主要负责催化AMP生成ATP。本研究以课题组前期通过紫外诱变育种技术并结合乙硫基抗性筛选得到一株高产SAM的突变菌株SaccharomycescerevisiaeCGMCC 2842为出发菌株,通过Adk1基因的过表达和柠檬酸钠补料调控酵母胞内ATP水平,考察其对工程菌胞内SAM积累的影响和机理,为基于ATP代谢调控而改善SAM合成提供理论依据。
1 材料与方法
1.1 菌株和载体
酿酒酵母CGMCC 2842(2842)及其表达载体pYES-KanMx为中国药科大学周长林课题组筛选和构建,酵母重组工程菌YPA和空质粒对照菌株YPK均为本课题组构建。
1.2 培养基
YPD培养基:葡萄糖 20 g·L-1,酵母浸粉 10 g·L-1,蛋白胨10 g·L-1,自然pH,115 ℃灭菌30 min;YPD固体培养基在YPD培养基基础上加2%琼脂。
O-medium培养基:葡萄糖 50 g·L-1,蛋白胨 10 g·L-1,酵母浸粉 5 g·L-1,KH2PO44g·L-1,K2HPO42 g·L-1,MgSO4·7H2O 1.5 g·L-1,L-methionine 3 g·L-1,用磷酸调至pH 6.0,115 ℃灭菌30 min。
1.3 主要试剂和仪器
SanPrep柱式DNA质粒提取试剂盒、酵母基因组DNA提取试剂盒、酵母总RNA提取试剂盒、a StepOnePlus Instrument试剂盒、ExTaq聚合酶、T4 DNA连接酶、ATP、Met和SAM标准品等购自生工生物工程(上海)股份有限公司;BamHⅠ、EcoRⅠ和PrimeScript RT reagent Kit with gDNA Eraser试剂盒购自宝生物工程(大连)有限公司,其他试剂均为国产分析纯。
C1000 PCR仪、Gel Doc XR 凝胶成像系统、CFX96实时荧光定量PCR仪,美国伯乐公司;DYY-6C型双稳定时电泳仪电源、DYCP-31 DN型电泳槽,北京六一仪器厂;Scientz JY92-II超声波细胞破碎仪,宁波新芝生物科技有限公司;LC10A高效液相色谱仪,日本岛津;Hypersil ODS C18色谱柱(250 mm × 4.6 mm,5 μm),大连依利特分析仪器有限公司。
1.4 Adk1基因扩增
根据GenBank上公布的Adk1(GenBank:NC_001136.10)核苷酸序列设计引物,Adk1-F:5’-CGCGGATCCATGTCTAGCTCAGAATCC-3’;Adk1-R:5’-CCGGAATTCGCTAGGTAAGGATTAATGA-CC-3’。
以酿酒酵母基因组DNA为模板进行PCR扩增,反应体系25 μL:10×ExTaqPCR Buffer 2.5 μL,MgCl2(25 mmol·L-1)1.5 μL,dNTPs(10 mmol·L-1)3 μL,基因组DNA 1 μL,PrimerAdk1-F/R各1 μL;ExTaqDNA polymerase 0.25 μL。反应条件:95 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,32个循环;72 ℃延伸10 min。
1.5 pGAL1-Adk1质粒构建及酵母转化
将Adk1基因和质粒pYES-KanMax分别用BamH I和EcoR I酶切后,T4 DNA连接酶连接后采用CaCl2法[6, 16]转化E.coliDH5α感受态细胞,挑取阳性克隆,用SanPrep柱式DNA质粒提取试剂盒提取重组质粒DNA,电泳检测采用0.8%琼脂糖凝胶。重组质粒用BamH I和EcoR I进行双酶切并测序验证后,成功获得重组表达质粒pGAL1-Adk1。
采用醋酸锂法[6]制备和转化酿酒酵母CGMCC 2842的感受态,用200 μg·mL-1的G418筛选阳性克隆,获得Adk1过表达菌株YPA。同时,用空质粒pYES-kanMx转化2842菌株,得到空质粒对照菌株YPK。
1.6 重组工程菌YPA柠檬酸钠补料试验
1.6.1补料时间确定 挑取酵母重组菌株YPA菌种,于含有200 μg·mL-1G418的YPD斜面划线接菌,于30 ℃培养箱倒置培养20 h。挑取活化菌落转接到YPD液体培养基中, 30 ℃、200 r·min-1振荡培养20 h。以5%接种量转接到含50 mL O-medium培养基的250 mL摇瓶,30 ℃、200 r·min-1振荡培养。分别在发酵0、8、16 和24 h后,向发酵液中添加2 g·L-1柠檬酸钠,振荡培养。每4 h取样并测定生物量和SAM积累量。
1.6.2补料浓度确定 获得最佳补料时间后,分别添加0、2、4、6和8 g·L-1柠檬酸钠,振荡培养。每4 h取样测定生物量和SAM积累量。
1.7 荧光定量PCR
按照总RNA提取试剂盒提取RNA。利用PrimeScript RT reagent Kit with gDNA Eraser试剂盒以1 μg总RNA为模板进行反转录。IDH基因的转录水平使用一步法荧光定量PCR测定,步骤按照a StepOnePlus Instrument试剂盒说明书进行。Real-time qPCR程序:95 ℃预变性30 s;循环参数为95 ℃变性5 s,60 ℃延伸31 s,40个循环。
1.8 异柠檬酸裂解酶IDH酶活测定
取5 mL发酵液,8 000 r·min-1、4 ℃离心10 min,收集细胞,5 mL 0.2 mol·L-1的磷酸缓冲液(pH 7.0)重悬。然后用超声波细胞破碎仪于冰浴中超声波处理破碎细胞, 4 ℃、12 000 r·min-1离心20 min,上清液即为测定IDH粗酶液,于-80℃冰箱保存备用。细胞粗提液的总蛋白浓度用Folin-酚试剂法测定[16-17]。IDH酶活测定方法参照LIN等[18]方法进行。1 mg蛋白1 min内催化形成NADH的量为一个酶活力单位(U)。
1.9 胞内ATP水平测定
样品制备:取1 mL发酵液离心取细胞沉淀,与2.0 mL 1.5 mol·L-1的高氯酸溶液混匀,于40 ℃恒温水浴锅中水浴反应30 min充分裂解,再以KOH调节pH至7,以8 000 r·min-1离心10 min,取上清过0.22 μm滤膜即为HPLC测定胞内ATP水平的样品。
色谱条件:反相C18柱(5 μm,4.6 mm×250 mm),柱温为室温,流动相流速为1.0 mL· min-1,上样体积10 μL,检测波长为254 nm,流动相为50 mmol·L-1,pH 6.0的磷酸盐缓冲溶液(含1 mmol·L-1EDTA)与甲醇(体积比95/5)混合溶液。
1.10 SAM积累量测定
样品制备:每隔4 h取1.0 mL发酵液,与2.0 mL 1.5 mol·L-1的高氯酸溶液混匀,于40 ℃恒温水浴反应30 min,再与2.0 mL 1.25 mol·L-1的氨水中和,8 000 r·min-1离心10 min,取上清过0.22 μm滤膜,即为测定SAM含量的样品。
色谱条件:反相C18柱(5 μm,4.6 mm×250 mm),柱温为40 ℃,上样体积为10 μL;检测波长为254 nm;流动相为0.1 mol·L-1的甲酸铵溶液(pH 3.0),流速为1.0 mL·min-1。
1.11 Met积累量测定
HPLC法检测波长为210 nm,样品制备和其余他色谱条件同SAM的测定。
1.12 DCW测定
每隔4 h取3 mL发酵液于预先编号并称重(W0)的5 mL EP管中,8 000 r· min-1离心10 min,弃去上清,双蒸水清洗两次,110 ℃烘干至恒重,冷却称重(W1),计算细胞干重。
DCW= (W1-W0) ×1 000/3
1.13 葡萄糖消耗分析
用3, 5-二硝基水杨酸法(DNS法)[19]测定发酵液中还原糖的含量。
2 结果与分析
2.1 工程菌YPA的构建与筛选
将PCR产物Adk1与pYES-KanMx经BamHⅠ和EcoRⅠ双酶切后通过T4连接酶酶连后转化大肠杆菌DH5α感受态细胞,成功获得pGAL1-Adk1重组质粒。将重组质粒pGAL1-Adk1转化酿酒酵母2842,阳性克隆转接到含有50 mL O-medium的摇瓶中,发酵16 h时添加2% D-半乳糖诱导基因表达,测定48 h SAM积累量。从图1中可看出,YPA 1~5号工程菌SAM产量分别达到0.72、0.77、0.79、0.79和0.81 g·L-1,较出发菌2842均显著提高。结果表明,成功构建酿酒酵母工程菌YPA。

注:不同小写字母表示处理间差异具有统计学意义(P<0.05)。Note: Different lowercase letters indicate significant difference at P<0.05 level between different treatments. 图1 工程菌YPA的SAM积累量Fig.1 Construction and screening of the recombinant strain YPA
2.2 工程菌YPA发酵性能分析
由图2可知,48 h时工程菌YPA的发酵液中SAM积累量达到了0.81 g·L-1,较出发菌株提高47%,同时考察YPA菌株发酵液中生物量变化及葡萄糖消耗的情况。发酵48 h时,DCW达到7.59 g·L-1,其葡萄糖消耗能力较2842和空质粒重组菌没有明显变化,表明Adk1过表达对工程菌生长状况没有显著影响。

注:不同小写字母表示处理间差异具有统计学意义(P<0.05)。Note: Different lowercase letters indicate significant difference at P<0.05 level between different treatments.图2 Adk1的过表达有效促进酵母SAM的积累Fig.2 Overexpression of Adk1 efficiently enhanced SAM accumulation in S. cerevisiae
另外,分析比较工程菌YPA的SAM和生物量得率变化情况,结果表明,与出发菌株2842相比,YPA菌株SAM对生物量的得率和SAM对葡萄糖消耗的得率显著提高,生物量对葡萄糖的得率较2842稍有下降(表1)。

表1 Adk1的过表达有效促进酵母细胞SAM的合成和得率Table 1 Overexpression of Adk1 improved SAM production and yield in Saccharomyces cerevisiae
2.3 Adk1基因过表达对工程菌YPA胞内ATP水平的影响
由于Adk1基因过表达能够有效提高工程菌SAM合成,对工程菌YPA胞内ATP水平进行考察,结果发酵36 h时,重组酿酒酵母YPA、YPK和2842胞内ATP水平分别达到0.75、0.50和0.51 g·L-1,与出发菌2842相比,工程菌YPA胞内ATP水平提高47.1%(图3)。结果表明,Adk1过表达能够有效改善酿酒酵母胞内ATP水平,进而促进Met转化为SAM。
2.4 柠檬酸补料对发酵液中SAM的积累和得率的影响
在发酵开始0、8、16 和24 h时,向发酵液中添加 2 g·L-1柠檬酸钠。对照组(Control)未添加补料,发酵48 h后测定其SAM积累量。在发酵开始0、8、16和24 h时向发酵培养基中一次性补加2 g·L-1柠檬酸钠,发酵液中SAM的积累量分别达到0.81、0.85、1.19、1.32和1.01 g·L-1。结果(图4)表明,发酵开始16 h柠檬酸钠补料组的SAM积累量最高。

注:不同小写字母表示处理间差异具有统计学意义(P<0.05)。Note: Different lowercase letters indicate significant difference at P<0.05 level between different treatments.图3 工程菌YPA胞内ATP水平测定Fig.3 ATP level of recombinant strain YPA
由图4可知,在发酵16 h时向发酵培养基中一次性补加0、2、4、6和8 g·L-1柠檬酸钠,分别使发酵液中SAM积累量达到0.81、0.92、1.05、1.45和1.32 g·L-1。其中,发酵开始16 h时补加6 g·L-1柠檬酸钠使SAM积累量及其对生物量和葡萄糖得率较对照组分别提高79%、78.8%和35.2%(表2)。结果表明,发酵开始16 h时补加6 g·L-1柠檬酸钠能够有效促进工程菌YPA的SAM积累及其得率。

注:不同小写字母表示处理间差异具有统计学意义(P<0.05)。Note: Different lowercase letters indicate significant difference at P<0.05 level between different treatments. 图4 柠檬酸钠补料促进工程菌SAM的合成Fig.4 Sodium citrate feeding enhanced SAM accumulation in the recombinant strain

表2 柠檬酸钠补料改善重组菌SAM得率Table 2 Sodium citrate feeding improved SAM yield in the recombinant strain YPA
2.5 柠檬酸钠补料对IDH基因转录和IDH酶活性的影响
考察对照组和补料组酵母TCA循环中异柠檬酸脱氢酶mRNA水平和酶活性。从图5可以看出,柠檬酸钠补料组mRNA相对水平显著高于对照组,与之相对应的是补料组IDH酶活也显著高于未补料组。结果表明,柠檬酸钠补料能够有效促进工程菌YPA胞内IDH基因的转录及IDH的酶活性。
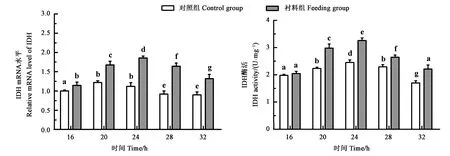
注:不同小写字母表示处理间差异具有统计学意义(P<0.05)。Note: Different lowercase letters indicate significant difference at P<0.05 level between different treatments. 图5 柠檬酸钠补料改善工程菌IDH基因表达和IDH酶活性Fig.5 Sodium citrate improve IDH gene expression and IDH activity
2.6 柠檬酸钠补料对胞内ATP水平和胞内Met转化SAM的影响
为验证IDH酶活性改善是否提高工程菌YPA胞内ATP水平及高ATP水平是否能够促进Met转化为SAM,分析未补料组和补料组胞内ATP和Met水平(图6)。结果发现,补料组重组工程菌YPA胞内ATP水平显著高于未补料组,在发酵24 h时,柠檬酸钠补料组胞内ATP的水平较未补料组提高39.4%。与之对应,柠檬酸钠补料组胞内Met水平显著低于未补料组。结果表明,柠檬酸钠补料有效改善工程菌YPA胞内ATP水平,进而有效促进胞内Met转化成SAM。

注:相同时间不同小写字母表示处理间差异具有统计学意义(P<0.05)。Note: Different lowercase letters at the same time indicate significant difference at P<0.05 level between different treatments.图6 柠檬酸钠补料提高工程菌胞内ATP水平进而促进SAM合成Fig.6 Sodium citrate addition elevate intracellular ATP levels and promote SAM synthesis
3 讨论
在生物体内,SAM是S-腺苷甲硫氨酸合成酶(SAMS)催化下将ATP腺苷基团转移到Met而合成,该反应必需有K+、Mg2+等金属离子参与[1]。关于利用微生物细胞内ATP代谢调控来直接生产ATP或者将ATP利用到一些药用化学物分子的生物合成的研究也已经成为热点问题。这些研究大多集中在关于基于腺嘌呤补救途径相关基因的调控来提高ATP的供给最终实现目的产物积累量的提高。
本研究基于课题组前期通过紫外诱变育种技术并结合乙硫基(ethionine)的抗性筛选得到的一株高乙硫氨酸抗性且高产SAM的突变菌株SaccharomycescerevisiaeCGMCC 2842(2842)[6]。由于2842具有较高的乙硫氨酸耐受性,而乙硫氨酸是作为SAM前体物质之一Met的结构类似物,因而2842对Met及SAM都具有了较高耐受性,在发酵培养基中添加足够量的Met的前提下,胞内ATP水平就成为限制SAM大量合成的因素之一[9,18-19]。本研究在2842菌株中克隆和过表达Adk1,发现工程菌YPA发酵液中SAM积累量达了0.81 g·L-1,较出发菌株提高47%;同时考察YPA菌株发酵液中生物量变化及葡萄糖消耗的情况,其葡萄糖消耗能力较2842和空质粒重组菌没有明显变化,即Adk1过表达对工程菌生长状况没有显著影响。而与出发菌株2842相比,YPA菌株的SAM对生物量的得率和SAM对葡萄糖消耗的得率有所提高,生物量对葡萄糖的得率和2842稍有下降。徐柏年等在酿酒酵母中克隆表达了Adk1基因,结果工程菌胞内ATP的积累量较出发菌株提高了75%[7]。HARIT等[7]在毕赤酵母中异源表达来自酿酒酵母Saccharomycescerevisiae的Sam2基因、一个甲硫氨酸透性酶Mup1基因和腺苷激酶编码基因Adk1基因,结果通Adk1的过表达提高了腺苷的供给,通过过表达Met透性酶Mup1提高前体蛋氨酸水平的可利用度,通过这三个基因的共表达最终将胞内SAM的积累量较单独过表达Sam2提高77%。因此,通过前体物质代谢途径关键酶基因的过表达技术提高前体蛋氨酸可利度以及提高ATP供给,对于SAM大量积累具有积极的作用。
为进一步改善酵母胞内SAM的合成与积累,继而考察柠檬酸钠补料对重组工程菌胞内ATP和SAM积累的影响。柠檬酸盐作为一种常见化学试剂,能够调整磷酸己糖(HMP)和糖酵解(EMP)途径之间的碳原子流的比例,同时柠檬酸还可抑制磷酸果糖激酶和丙酮酸激酶的活性从而导致在磷酸尿嘧啶代谢中丙酮酸及其他副产物的产生[17];另外,柠檬酸盐对发酵液具有碱化作用,这起到改善微生物对逆境的耐受性;最后,柠檬酸盐能够加速NAD+-相关脱氢酶催化的反应,从而形成大量NADH,NADH进入线粒体电子传递链可以改善ATP的产生,加大ATP和ADP间的比值[16,18]。本研究为基于ATP代谢调控而改善SAM合成提供有力的理论依据。

